混菌发酵葡萄汁对葡萄糖苷类芳香前体物水解作用的影响
2018-09-07王凤梅张邦建岳泰新
王凤梅,张邦建,岳泰新
(包头轻工职业技术学院 食品药品学院,内蒙古 包头 014035)
单萜醇类物质存在于绝大多数酿酒葡萄的葡萄汁中。然而,这些单萜醇类物质以单体形式存在的量很少,绝大多数单萜醇与葡萄糖或二糖以葡萄糖苷键相结合,形成葡萄糖苷、6-O-α-L-呋喃阿拉伯糖基-β-D-吡喃葡萄糖苷(6-O-α-L-arabinofuranosyl-β-D-glucopyranosides)、6-O-α-L-吡喃鼠李糖基-β-D-吡喃葡萄糖苷(6-O-α-L-rhamnopyranosyl-β-D-glucopyranosides)及6-O-β-D-呋喃芹糖基-β-D-吡喃葡萄糖苷(6-O-β-D-apiofuranosyl-β-D-glucopyranosides)等芳香前体物,从而失去了其原有的香气[1-2]。这些葡萄糖苷在加热条件下可酸水解,然而酸水解产物中单萜醇的苷配基会发生重排,从而改变了其原有的香气[3]。β-葡萄糖苷酶可水解单萜醇芳香前体物的葡萄糖苷键,使单萜醇芳香物得以释放,增加葡萄酒的香气与风味[1]。
在一些酵母菌种中发现了β-葡萄糖苷酶的存在,这些酵母菌株绝大多数属于非酿酒酵母(non-Saccharomyces),如葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、异常毕赤酵母(Pichia anomala)、浅黄隐球酵母(Cryptococcus flavescens)及星形假丝酵母(Candida stellata)等[2,4-5],也有报道从一些野生及商业化酿酒酵母菌株中检测到β-葡萄糖苷酶的存在[4,6]。在前期的研究工作中,也从分属5个属5个种的葡萄酒相关酵母菌种中分离到66株β-葡萄糖苷酶活性菌株。在葡萄酒的发酵过程中,酵母中的β-葡萄糖苷酶活性较弱,导致成酒中绝大多数单萜醇仍以结合的形式存在,无法赋予葡萄酒独特的香气与风味[6-7]。其原因在于在葡萄汁发酵过程中,起主导作用的酿酒酵母与一些非酿酒酵母菌种相比,β-葡萄糖苷酶的活性相对较弱,甚至一些商业化酿酒酵母菌种中未检测到β-葡萄糖苷酶活性的存在[4,8];此外,酵母菌中的β-葡萄糖苷酶大多以胞内酶的形式存在,胞壁结合及胞外酶的活性相对较弱,甚至绝大多数β-葡萄糖苷酶活性菌株无法检测到胞外酶的存在[6,8];发酵液中高浓度的葡萄糖、低pH值及高浓度的酒精也会抑制β-葡萄糖苷酶的活性[1-2,8]。基于这些原因,采用酿酒酵母与非酿酒酵母混合发酵,对非酿酒酵母进行胞壁透化处理使其胞内β-葡萄糖苷酶得以释放,可能是解决这一问题的方法。
本研究以内蒙古西部地区筛选到的分属于5个属5个种的具有β-葡萄糖苷酶活性5株酵母菌株为实验菌株,并对其进行胞壁透化处理;以霞多丽葡萄汁为发酵液,采用酿酒酵母单独发酵或与非酿酒酵母混合发酵的方式探究这些菌株中的β-葡萄糖苷酶对葡萄糖苷类芳香前体物的水解作用,为采用本土野生酵母发酵酿制具有地区特色的葡萄酒提供理论及实践基础。
1 材料与方法
1.1 材料与试剂
1.1.1 酵母菌种
酵母菌种为实验室冷冻保存的、分离于内蒙古西部地区2种酿酒葡萄(霞多丽及品丽珠)浆果表面分属5个属5个种(酿酒酵母(Saccharomyces cerevisiae)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、浅黄隐球酵母(Cryptococcus flavescens)、异常毕赤酵母(Pichia anomala)及星形假丝酵母(Candida stellata))的5株具有β-葡萄糖苷酶活性菌株。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YPD)培养基:10 g/L酵母膏,20 g/L蛋白胨,20 g/L葡萄糖,pH5.0。115℃灭菌30 min。
1.2 仪器与设备
MJ-250B型霉菌培养箱:上海跃进医用光学器械厂;5430台式高速离心机:德国艾本德公司;NanoDrop 2000分光光度计:美国赛默飞世尔科技有限公司;FE 20 pH计:瑞士梅特勒-托利多国际贸易有限公司;葡萄糖苷检测试剂盒:上海西宝生物科技股份有限公司。
1.3 方法
1.3.1 菌种活化及扩大培养
上述冷冻保藏的5个酵母菌株分别接种于YPD液体培养基中,于28℃条件下培养48 h。随后按5%(V/V)接种量将活化后的菌株接种于含100 mL YPD液体培养基的三角瓶中,于28℃、72 r/min摇床培养24 h,用于后续实验。
1.3.2 酵母细胞透化处理
酵母细胞透化处理参照ROSI I等[5-6]报道的方法,略加改动。取5mL上述酵母培养液,离心(5000×g、10min、4℃),细胞沉淀经冰冷的超纯水洗涤后,采用1 mL 75 mmol/L咪唑缓冲液(pH7.5)重悬细胞,迅速向细胞悬液中加入透化液(50 μL 0.3 mmol/L还原型谷胱甘肽,10 μL 10%Triton X-100及50 μL甲苯/乙醇(1/4,V/V)混合液),剧烈振荡5 min后,离心收集细胞,经冰冷的超纯水洗涤2次后,细胞重悬于3 mL冰冷的柠檬酸盐-缓冲液(100 mmol/L,pH5.0)中,用于后续实验。
另取5 mL酵母培养液,离心沉淀酵母细胞,经冰冷的超纯水洗涤3次后,采用3 mL冰冷的柠檬酸缓冲液(100 mmol/L,pH5.0)重悬细胞,用于后续实验。
对透化及未透化处理的酵母细胞采用血细胞计数板确定酵母细胞的浓度。
1.3.3 乙醇脱氢酶活性检测
为了检验酵母细胞的透化效果,需对透化处理后的酵母细胞进行乙醇脱氢酶(alcohol dehydrogenase,ADH)活性检测,具体方法参照BISOTTO A等[6]报道的方法。
配制含0.2mol/L甘氨酸及1.2mmol/L乙醇的溶液,采用NaOH调整pH值至8.1。随后向其中加入等体积的0.6mmol/L NAD+溶液,混合均匀。取1mL上述溶液,向其中加入200μL透化后的酵母细胞悬液,于25℃条件下水浴5 min。随后,采用分光光度计检测溶液在波长340 nm处的吸光度值(OD340nm),每10 s记录一次OD340nm值,连续记录5 min。以OD340nm值对时间作图,取反应的最初线性部分,计算1 min内OD340nm值的增加值。NADH在波长340 nm处的摩尔消光系数为6.22×103L/(mol·cm),据此计算1 min内NADH的生成量。ADH的酶活单位(U)定义为每108个细胞1 min生成1 nmol NADH所具有的活性。
1.3.4 葡萄汁发酵液制备及发酵条件
采集成熟霞多丽葡萄,经压榨、搅拌后,8 000×g离心5 min后,上清液经0.45 μm滤膜过滤除菌后,用于后续发酵反应。
发酵在250 mL密闭锥形瓶中进行,150 mL葡萄汁按105个细胞/mL葡萄汁接种透化或未透化处理的酵母细胞。酿酒酵母单独接种或与非酿酒酵母混合接种(接种细胞数量比1∶1)后,于28℃条件下静置发酵7 d。
1.3.5 酵母菌株发酵能力检测
于发酵7 d后检测发酵液中酵母细胞的数量、总生物量、发酵液pH值、总CO2生成量、酒精浓度及残糖量等参数,确定不同组合酵母菌株的发酵能力。
酵母细胞数量采用血细胞计数板进行计数,发酵液pH值及酒精浓度分别采用pH计及酒精计进行检测,残糖量采用费林试剂直接滴定法。发酵过程中,每隔24 h,摇动瓶子,以驱除CO2,称质量,确定CO2生成量,连续统计7 d,确定总CO2生成量。
取50 mL发酵液悬液,经预先称质量的0.45 μm滤膜过滤,酵母细胞经超纯水洗涤2次后,于105℃烘箱中过夜,待其彻底干燥后称质量,确定发酵液中的总生物量。
1.3.6 发酵液中葡萄糖苷类物质浓度检测
发酵液中剩余的葡萄糖苷能够反映发酵过程中酵母细胞β-葡萄糖苷酶的活性。葡萄糖苷的测定方法参照WILLIAMS P J等[9]报道的方法。
于发酵结束后,取3 mL发酵液经0.22 μm滤膜过滤后,采用C18烷基Bakerbond SPE(Solid Phase Extraction)小柱对滤液进行固相萃取,萃取柱经超纯水洗涤3次后,采用乙醇洗脱结合于萃取柱上的葡萄糖苷(1.5 mL乙醇洗脱1次,2 mL超纯水洗脱2次,收集3次洗脱液共5 mL)。取0.5 mL洗脱液向其中加入1mL2.25mol/LH2SO4,于100℃条件下水解1h,自然冷却至室温。随后,向反应液中加入1mL2.25mol/L NaOH,中和H2SO4。采用葡萄糖苷检测试剂盒与分光光度计于波长340 nm处检测上述溶液的吸光度值(OD340nm)。另制备系列浓度梯度的葡萄糖溶液(1~20mmol/L,每2mmol/L一个梯度),经葡萄糖苷检测试剂盒处理后,测定其OD340nm值,制备葡萄糖含量与OD340nm值的标准曲线。通过标准曲线,确定发酵液中剩余的葡萄糖苷的量(葡萄糖苷的物质的量浓度等于其水解后葡萄糖的物质的量浓度)。
1.3.7 数据处理
所有实验均重复3次,取3次重复的平均数±标准差。采用SPASS19.0软件对数据进行方差分析,P<0.05视为差异显著。
2 结果与分析
2.1 酵母细胞透化效果
未透化处理的5株酵母菌株均未检测到胞外ADH活性。因此经透化处理后,酵母菌株的胞外ADH活性能够反映透化处理的效果,实验结果见表1。

表1 透化处理后酵母菌株ADH活性Table 1 ADH activity in yeast strains after permeabilization
由表1可以看出,5株酵母菌株均表现出胞外ADH活性,其中以酿酒酵母为最高,为(10.72±0.42)U,其次为葡萄汁有孢汉逊酵母及异常毕赤酵母,星型假丝酵母及浅黄隐球酵母酶活性最低。这一结果表明本实验条件下5株酵母菌株的胞壁均可被成功透化,从而为后续胞内β-葡萄糖苷酶活性的研究提供了理论依据。不同菌株ADH活性的差异可能由于其自身的ADH活性高低不同,也可能由于不同菌株经透化处理后胞壁的透化程度不同。
2.2 酵母菌株单一或混合接种的发酵能力
酵母菌强劲的发酵能力是葡萄酒酿制的基本条件。因此,本研究在采用酿酒酵母与4株产β-葡萄糖苷酶的非酿酒酵母混合发酵时,不同菌株搭配时的发酵能力是首先需要考虑的问题,其发酵结果见表2。

表2 酵母菌株单一或混合接种的发酵能力比较Table 2 Comparison of fermentation performance of yeast strains with single or mixed inoculation way
由表2可以看出,当酿酒酵母单独发酵时,其发酵能力较强,然而当其被透化处理后,发酵能力迅速下降,甚至丧失了发酵能力。这一结果表明,透化处理会导致大量酵母细胞自溶及死亡。因此既想利用酿酒酵母强劲的发酵能力,又想利用其胞内的β-葡萄糖苷酶,两个目标无法同时实现。基于此,采用未透化处理的酿酒酵母与非酿酒酵母按1∶1的比例接种,观察其发酵能力。可知除星形假丝酵母外,其他3株透化或未透化处理的非酿酒酵母与酿酒酵母混合接种时,对发酵力的影响不大。酿酒酵母与星形假丝酵母混合发酵时的低发酵能力可能在于不同酵母菌株间的相互作用,具体机理有待进一步研究。
2.3 不同酵母菌株组合对发酵液中葡萄糖苷的水解能力
于发酵结束后,对上述发酵液中的葡萄糖苷糖浓度进行检测,结果见图1。
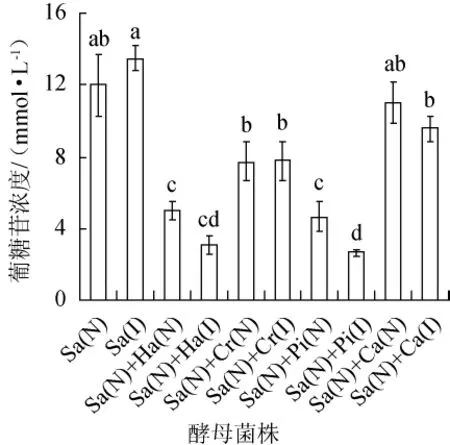
图1 不同酵母菌株组合对发酵液中葡萄糖苷浓度的影响Fig.1 Effects of combination of different yeast strains on glucoside concentration in fermentation broth
由图1可以看出,除星形假丝酵母外,其他3种非酿酒酵母与酿酒酵母混合发酵时,发酵液中的葡萄糖苷浓度均得到显著降低(P<0.05)。这一结果表明,这3株非酿酒酵母具有较高的β-葡萄糖苷酶活性,其中尤以萄萄汁有孢汉逊酵母及异常毕赤酵母的β-葡萄糖苷酶活性最高。此外,经透化处理后,2株非酿酒酵母(萄萄汁有孢汉逊酵母及异常毕赤酵母)与酿酒酵母混合发酵时,发酵液中的葡萄糖苷浓度得到进一步降低至浓度分别为3.04mmol/L和2.66mmol/L。这一结果表明,透化处理可使这2株菌的胞内β-葡萄糖苷酶发挥水解葡萄糖苷的作用。浅黄隐球酵母与酿酒酵母混合发酵也可显著降低发酵液中的葡萄糖苷浓度(P<0.05),然而是否透化处理对发酵液中的葡萄糖苷浓度的影响不大(P>0.05)。其原因可能在于这1株浅黄隐球酵母的胞内β-葡萄糖苷酶活性较低,或细胞透化处理效果欠佳,从而导致胞内酶无法发挥水解作用。
结合上述发酵能力检测结果,酿酒酵母与透化处理的葡萄汁有孢汉逊酵母或异常毕赤酵母按1∶1配比接种发酵葡萄汁,在对总体发酵结果影响不大的情况下,可显著降低发酵液中的葡萄糖苷浓度(P<0.05)。
2.4 讨论
酵母细胞的β-葡萄糖苷酶主要分布于其细胞内或与细胞壁相结合[6,8],为此,本实验预先对部分酵母细胞进行透化处理,并采用检测处理后酵母细胞的ADH酶活性确定透化处理的效果,这种方法被前人广泛采用,透化处理后的酵母细胞显示更高的β-葡萄糖苷酶活性[5-6]。透化处理破坏了酵母细胞壁及细胞膜的完整性,最终导致细胞自溶及死亡。因此,采用酿酒酵母与非酿酒酵母混合发酵是解决这一问题的思路。
在葡萄汁自发发酵的早期,酿酒酵母与大量非酿酒酵母共同存在于发酵液中,其中,非酿酒酵母有助于起始自发的发酵过程,随着发酵的进行,发酵液中酒精浓度逐渐升高,非酿酒酵母由于低酒精耐受力而受到抑制甚至死亡,而酒精耐受力强的酿酒酵母逐渐占据支配地位,最终主导发酵的完成[1,11]。为了增加或改善葡萄酒的香气与风味,酿酒酵母与非酿酒酵母混合接种发酵被广泛研究,结果表明一些非酿酒酵母可提高葡萄酒中的萜醇、芳香酯等物质,降低乙酸等物质[12-14]。酿酒酵母与星形假丝酵母混合接种发酵能力低,可能在于不同酵母菌株间复杂的相互作用[15]。葡萄汁中绝大多数单萜醇类芳香物与葡萄糖或二糖以葡萄糖苷键相结合的形式存在[1-2],因此,进一步检测发酵结束后的发酵液中葡萄糖苷的浓度,据此可以间接反映非酿酒酵母中β-葡萄糖苷酶的活性。
3 结论
实验结果表明,透化处理对5个酵母菌株都具有一定的胞壁穿孔作用。透化处理使酿酒酵母丧失了发酵能力,因此发酵初期将酿酒酵母与透化或未透化处理的非酿酒酵母混合接种于葡萄汁中,除星形假丝酵母外,酿酒酵母与其他3株透化或未透化处理的非酿酒酵母混合接种对发酵结果的影响不大(P>0.05),且可显著降低发酵液中葡萄糖苷类物质的浓度(P<0.05),其中尤以萄萄汁有孢汉逊酵母及异常毕赤酵母的能力最强,葡萄糖苷类物质的浓度分别为3.04 mmol/L和2.66 mmol/L。
