山西老陈醋酿造过程中乳酸菌和醋酸菌的分离鉴定及高粱单宁对其生长的影响
2018-09-07郭旭凯柳青山
郭旭凯,杨 玲*,刘 聪,王 琪,段 冰,郭 睿,邵 强,柳青山
(1.山西省农业科学院 高粱研究所,山西 晋中 030600;2.山西大学 生命科学学院,山西 太原 030006)
山西老陈醋是我国的四大名醋之一,具有醇厚浓郁的香味和多种保健功效,因此广受消费者的喜爱[1]。
山西老陈醋因其有独特的酿造工艺和特定的地理气候而形成了独一无二的风味。在山西老陈醋的酿造过程中,各种微生物类群相互作用共同决定了老陈醋的产量和品质,其中乳酸菌和醋酸菌是不可或缺的类群[2]。赵国忠等[3]从天津独流老醋中分离到的优良乳酸菌是植物乳杆菌(Lactobacillus plantarum)。王梦颖等[4]采用16S rDNA宏基因组的测序手段对山西老陈醋发酵过程中的菌群微生态进行了分析,并分离出19株乳酸菌,包括6株植物乳杆菌(Lactobacillus plantarum)、7株干酪乳杆菌(Lactobacillus casei)和6株瑞士乳杆菌(Lactobacillus helveticus)。于迪等[5]从山西老陈醋发酵过程的酒化阶段分出的10株乳酸菌和醋化阶段分出的25株乳酸菌进行产酸定量试验,最终筛选出产酸量高、耐受性好的2株菌分别是发酵乳杆菌(Lactobacillus fermentium)和干酪乳杆菌(Lactobacillus casei)。吕艳歌等[1]从山西老陈醋醋醅中连续采样分离的产酸菌群主要是醋酸杆菌、乳酸杆菌和芽孢杆菌,优势种群为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和巴氏醋酸杆菌(Acetobacter pasteurianus)。弓晓艳等[6]从山西老陈醋醋醅中连续采样筛到了4株产酸功能菌,分别是植物乳杆菌(Lactobacillus plantarum)和巴氏醋酸杆菌(Acetobacter pasteurianus)。胡会萍[7]对山西老陈醋不同发酵阶段醋醅中的醋酸菌进行了遗传学分类鉴定和生产性能的研究,得到了60株醋酸菌,分别归为巴氏醋杆菌(Acetobacter pasteurianus)、汉氏醋杆菌(Acetobacter hansenii)、醋化醋杆菌(Acetobacter aceti)、恶臭醋杆菌(Acetobacter rancens)和液化醋杆菌(Acetobacter liquefaciens)。国内关于山西老陈醋的研究已有许多,然而在醋醅中仍然存在着大量的未被开发利用的乳酸菌和醋酸菌。因此,从山西老陈醋的醋醅中分离有益乳酸菌和醋酸菌,可以为山西老陈醋的发展奠定基础。
已有研究表明,除菌种外,影响山西老陈醋风味的另一个主要原因是酿造原料。在酿造原料中,高粱是主要的,高粱中含有单宁。植物单宁对多种微生物的生长具有抑制作用[8-12]。而在山西老陈醋的酿造过程中,高粱单宁对主要微生物的生长具有什么样的影响尚不清楚,目前也没有相关的研究报道。因此,本研究从山西老陈醋酿造过程中分离鉴定乳酸菌和醋酸菌,并研究高粱单宁对它们生长的影响,可以为选育具有合理单宁含量的高粱品种提供理论依据,从而进一步提高山西老陈醋的原料利用率、产量和品质。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
采集山西老陈醋酒精发酵阶段的酒醅,从第1天开始,每3d采集一次,共8个样品;采集醋酸发酵阶段第1天、第4天和第8天的醋醅,共3个样品。每个样品3个平行。
体积分数为30%和80%乙醇洗脱单宁的制备:称取高粱外种皮粉末,以体积分数为70%乙醇溶液为提取溶剂,料液比1∶20(g∶mL),超声波辅助提取60 min(超声功率100 W,频率40 kHz),提取温度为50℃。提取后的溶液经过滤、减压蒸馏获得高粱单宁浓缩液,后经过大孔吸附树脂AB-8进行纯化,分别用超纯水、体积分数为30%、80%乙醇溶液洗脱,并对提取液分别进行减压抽真空浓缩、后放置于真空干燥器常温干燥后得相应固体粉末。
1.1.2 试剂
Ezup柱式细菌基因组DNA抽提试剂盒、琼脂糖凝胶DNA回收试剂盒、100 bp DNA Ladder、λDNA/Hind III、6×DNA Loading Buffer、琼脂糖、制霉素:生工生物工程(上海)股份有限公司。
1.1.3 培养基
乳酸菌分离培养基[13]:酵母膏10 g,蛋白胨10 g,牛肉膏10 g,葡萄糖10 g,番茄汁100 mL,吐温80 0.5 mL,CaCO32g,琼脂15g,胡萝卜40g,溴甲酚绿0.1mL,自来水900mL,pH6.5。121℃灭菌15 min,倒平板前加入过滤除菌的制霉素,使其终浓度为50 μg/mL。
乳酸菌液体培养基:酵母膏10 g,蛋白胨10 g,牛肉膏10g,葡萄糖10g,番茄汁100mL,吐温-800.5mL,琼脂15g,胡萝卜40g,溴甲酚绿0.1mL,自来水900mL,pH6.5。121℃灭菌15 min。
醋酸菌分离培养基[13]:葡萄糖100g,酵母膏10 g,CaCO320g,琼脂20g,自来水1000mL,pH6.8。121℃灭菌15min,倒平板前加入过滤除菌的制霉素(终浓度为50 μg/mL)和过滤除菌的无水乙醇(终浓度为1%)。
醋酸菌液体培养基:葡萄糖100g,酵母膏10g,琼脂20g,自来水1 000 mL,pH 6.8。121℃灭菌15 min。
1.2 仪器与设备
ZWY-240恒温培养振荡器:上海智城分析仪器制造有限公司;SPX-250B-Z型生化培养箱、XM-30R立式压力蒸汽灭菌器、GZX-9076MBE电热鼓风干燥箱、CS601超级恒温水浴:上海博迅实业有限公司医疗设备厂;HC-2518高速离心机:安徽中科中佳科学仪器有限公司;Centrifuge 5430R小型台式高速冷冻离心机、Innova U360超低温冰箱:德国艾本德公司;T100 Thermal Cycler PCR仪、Gel Doc 2000 UV凝胶成像系统:美国Bio-Rad公司;DYY-6C型电泳仪:北京六一仪器厂;CS601超级恒温水浴:上海博迅实业有限公司。
1.3 方法
1.3.1 不同发酵阶段样品中乳酸菌的分离
无菌条件下称取样品10 g,加入盛有90 mL无菌水的装有适量玻璃珠的三角瓶中,200 r/min摇床振荡1 h,制成10-1稀释度菌悬液。吸取10-1稀释度菌悬液1 mL到9 mL无菌水的试管中,混合均匀,制成10-2稀释度悬液。依此类推,制成10-5~10-8稀释度菌悬液。分别吸取10-5~10-8稀释度菌悬液0.2 mL,涂布于乳酸菌平板,每个稀释度3个平行,对应品温培养12~72 h后挑取单菌进一步纯化。
1.3.2 不同发酵阶段样品中乳酸菌的鉴定
乳酸菌的富集培养:将每株乳酸菌分别接种于乳酸菌液体培养基中,25 ℃、200 r/min振荡培养3 d,12 000 r/min离心10 min收集菌体沉淀。用无菌水反复洗涤沉淀3次,用于提取基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)。
乳酸菌基因组DNA的提取、检测:利用试剂盒来提取每株乳酸菌的总基因组DNA,-20℃保存。取5 μL基因组DNA,并加入1 μL 6×DNA Loading Buffer,混匀后用0.7%琼脂糖凝胶电泳检测。
乳酸菌16S rDNA V3-V4序列的聚合酶链反应(polymerase chain reaction,PCR)扩增:扩增引物为338 F:5'-ACT CCTACGGGAGGCAGCAG-3',806R:5'-GACTACHVGGG TWTCTAAT-3'。
PCR反应体系 (50 μL):2×TaqDNA MasterMix 25 μL;338F(10 μmol/L)5 μL;806R(10 μmol/L)5 μL;基因组DNA模板1 μL;ddH2O补至50 μL。所有试剂添加完毕后,轻轻混匀。阴性对照不加模板。反应条件:预变性94℃、5 min;变性94 ℃、30 s;退火55℃、30 s;延伸72 ℃、90 s;35个循环后,72℃保温10 min。PCR扩增产物经2%的琼脂糖凝胶电泳分离,凝胶成像系统检测。
乳酸菌16S rDNA V3-V4序列PCR扩增产物的回收:将PCR扩增产物利用琼脂糖凝胶回收试剂盒回收,经2%的琼脂糖凝胶电泳分离,凝胶成像系统检测。
乳酸菌16SrDNAV3-V4序列的测定:将回收产物送华大基因研究中心测序。将测序结果用BLAST与GenBank数据库中的核苷酸序列来比对,找出最相似的序列。
1.3.3 高粱单宁对不同发酵阶段样品中乳酸菌生长的影响
体积分数为30%、80%乙醇洗脱的单宁溶液的配制:称取一定量的体积分数为30%、80%乙醇洗脱的高粱单宁,溶于少量无水乙醇中,再加入一定量的蒸馏水,使单宁终含量分别为6.0%、4.0%、3.0%、2.0%、1.5%、1.0%、0.5%。过滤除菌备用。
乳酸菌菌悬液的制备:将试管纯菌株接种到50 mL乳酸菌液体培养基内,28℃、150r/min振荡培养3~5d。培养结束后,在无菌条件下转入离心管中,8000r/min离心10min。取菌体沉淀在无菌条件下用无菌水洗涤3次,用无菌水制备成10-5~10-8的菌悬液。
单宁对乳酸菌生长的影响:分别向灭菌后约50℃的乳酸菌培养基中加入200 μL不同浓度的单宁,充分混匀倒平板。将每株乳酸菌的10-5~10-8菌悬液分别均匀涂布于上述平板,每个稀释度3个平行,每个单宁浓度3个平行。在28℃条件下培养2~3 d,培养结束后进行菌落计数,以无单宁的平板为对照。
1.3.4 不同发酵阶段样品中醋酸菌的分离及鉴定
方法同1.3.1、1.3.2,培养基用醋酸菌培养基。
1.3.5 高粱单宁对不同发酵阶段样品中醋酸菌生长的影响
方法同1.3.3。
2 结果与分析
2.1 不同发酵阶段的样品中乳酸菌的分离、鉴定
从不同发酵阶段的酒醅和醋醅样品中共分离到乳酸菌36株,编号为L1~L36,其形态特征见表1。36株乳酸菌通过前期的形态观察、生理生化特性结合16S rDNA序列测定分别归为以下几类:植物乳杆菌(Lactobacillus plantarum),发酵乳酸杆菌(Lactobacillus fermentium),干酪乳酸杆菌(Lactobacillus casei),肠膜明串珠菌(Leuconostoc mesenteroides),类食品乳杆菌(Lactobacillus paralimentarius)和短乳杆菌(Lactobacillus brevis)。

表1 不同温度样品中乳酸菌的菌落特征Table 1 Colony characteristics of lactic acid bacteria in samples at different temperature
2.2 高粱单宁对不同发酵阶段的样品中乳酸菌生长的影响
2.2.1 体积分数为80%乙醇洗脱的单宁对乳酸菌生长的影响
单宁含量在0~6.0%的范围内对36株乳酸菌生长的影响结果见表2。由表2可知,随着单宁含量的升高,不同乳酸菌的生长情况不同。在单宁含量为0~1.5%范围内,所有乳酸菌的生长均被促进。在单宁含量为2.0%时,干酪乳杆菌(L1、L4、L7、L9、L24)生长受到非常明显的促进;肠膜明串珠菌(L2、L3、L5、L8、L11、L12)、短乳杆菌(L15、L16、L18、L19、L20)、植物乳杆菌(L17)和发酵乳杆菌(L21、L22、L23、L25、L27~L30、L32、L36)的生长受到不明显的促进;类植物乳杆菌(L6、L10、L13、L14、L26)、植物乳杆菌(L31、L33~L35)的生长受到抑制。随着单宁含量的继续增加,所有乳酸菌的生长均开始被抑制,单宁含量越大抑制作用越强。所有菌株在单宁含量为6.0%时都不能生长。

表2 体积分数为80%乙醇洗脱的单宁对乳酸菌菌落数的影响Table 2 Effect of tannin eluted by volume fraction 80%ethanol on the number of colony of lactic acid bacteria CFU/mL

续表
2.2.2 体积分数为30%乙醇洗脱的单宁对乳酸菌生长的影响
单宁含量在0~6.0%范围内对36株乳酸菌生长的影响结果见表3。由表3可知,随着单宁含量的升高,不同乳酸菌的生长情况不同。在单宁含量为0~1.5%范围内,所有乳酸菌的生长均被促进。在单宁含量为2.0%时,干酪乳杆菌(L1、L9、L24)的生长被明显地促进;干酪乳杆菌(L4)、肠膜明串珠菌(L11、L12)、植物乳杆菌(L17、L34)、短乳杆菌(L20)和发酵乳杆菌(L21、L22、L25、L27、L32)的生长稍有促进;肠膜明串珠菌(L2、L3、L8)、干酪乳杆菌(L7)、短乳杆菌(L15、L16、L18、L19)和发酵乳杆菌(L23、L28~L30、L36)的生长几乎不受影响;肠膜明串珠菌(L5)、类植物乳杆菌(L6、L10、L13、L14、L26)和植物乳杆菌(L31、L33、L35)的生长被抑制。但是随着单宁含量的继续增加,所有菌株的生长都开始受到抑制,单宁含量越高抑制作用越强。所有菌株在单宁含量为6.0%时都不生长。
综上所述,体积分数为80%和30%乙醇洗脱的单宁在含量为0~1.5%时,所有菌的生长均被促进;在单宁含量为2.0%时,27株菌的生长受到不同程度的促进,9株菌的生长受到抑制;当单宁含量为3.0%~6.0%时,所有乳酸菌的生长均被抑制,直到单宁含量为6.0%时菌株彻底不生长。
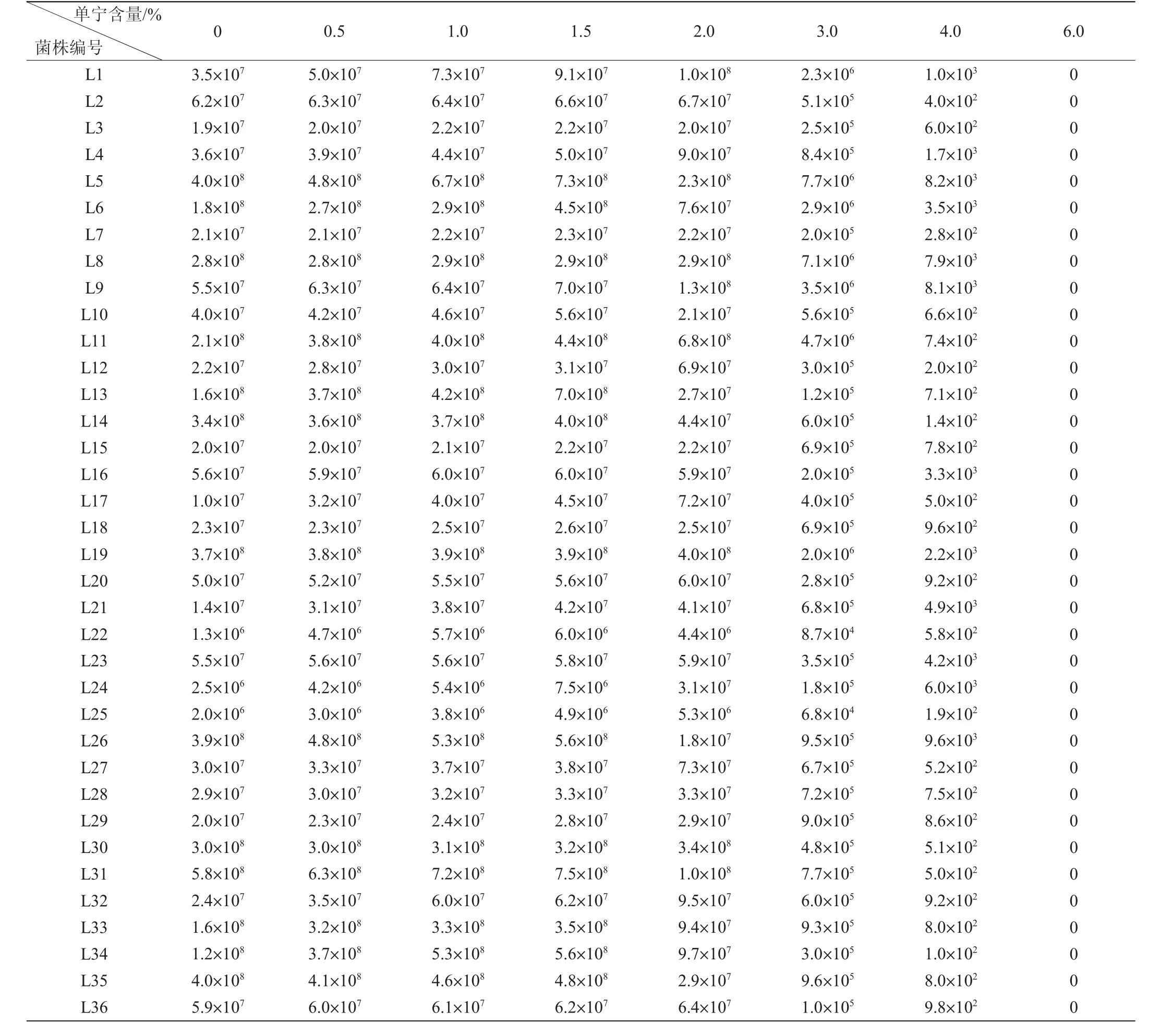
表3 体积分数为30%乙醇洗脱的单宁对乳酸菌菌落数的影响Table 3 Effect of tannin eluted by volume fraction 30%ethanol on the number of colony of lactic acid bacteria CFU/mL
2.3 不同发酵阶段的样品中醋酸菌的分离、鉴定
从不同发酵阶段的酒醅和醋醅样品中共分离到醋酸菌25株,编号为V1~V25,其形态特征见表4。25株醋酸菌通过前期的形态观察、生理生化特性结合16S rDNA测序分别归为以下几类:巴氏醋酸杆菌(Acetobacter pasteurianus)、醋化醋杆菌(Acetobacter aceti),液化醋杆菌(Acetobacter liquefaciens)和恶臭醋酸杆菌(Acetobacter rancens)。

表4 不同温度样品中醋酸菌的菌落特征Table 4 Colony characteristics of acetic acid bacteria in samples at different temperature
2.4 高粱单宁对不同发酵阶段的样品中醋酸菌生长的影响
2.4.1 体积分数为80%乙醇洗脱的高粱单宁对醋酸菌生长的影响
在单宁含量为0~6.0%范围内对25株醋酸菌生长的影响结果见表5。由表5可知,不同含量的单宁对不同醋酸菌生长的影响不同。在单宁含量在0~1.5%时,绝大部分醋酸菌的生长呈现促进的规律(醋化醋杆菌V2、V3、V8、V18除外)。当单宁含量为2.0%时,液化醋杆菌(V4、V7、V9和V15)的生长受到明显的促进;巴氏醋杆菌(V5、V14、V16、V19、V23)、液化醋杆菌(V12)和醋化醋杆菌(V11)的生长稍被促进;醋化醋杆菌(V1~V3、V8、V18、V24和V25)和恶臭醋杆菌(V6、V10、V13、V17)的生长被抑制。当单宁含量继续增大时,所有菌的生长都开始表现出抑制,且单宁含量越高抑制作用越强。单宁含量为6.0%时所有菌均不生长。

表5 体积分数为80%乙醇洗脱的单宁对醋酸菌菌落数的影响Table 5 Effect of tannin eluted by volume fraction 80%ethanol on the number of colony of acetic acid bacteriaCFU/mL
2.4.2 体积分数为30%乙醇洗脱的高粱单宁对醋酸菌生长的影响
单宁含量在0~6.0%的范围内对25株醋酸菌生长的影响结果见表6。由表6可知,随着单宁含量的升高,醋酸菌的生长受到不同程度的影响。在单宁含量在0~1.5%的过程中,绝大部分菌株的生长均表现出促进的趋势(醋化醋杆菌V2、V3、V8、V18除外)。当单宁含量为2.0%时,液化醋杆菌(V7、V9)被明显地促进;液化醋杆菌(V12)、醋化醋杆菌(V11)和巴氏醋杆菌(V19、V20、V22、V23)被轻微地促进生长;醋化醋杆菌(V1~V3、V8、V18、V24、V25)、液化醋杆菌(V4、V15)、巴氏醋杆菌(V5、V14、V16、V21)和恶臭醋酸杆菌(V6、V10、V13、V17)被抑制。随着单宁含量的增加,所有菌株的生长都开始被抑制,且单宁含量越高抑制作用越强。单宁含量为6.0%时所有菌不生长。
综上所述,体积分数为80%和30%乙醇洗脱的单宁含量在0~1.5%内,所有醋酸菌的生长均被促进;体积分数为80%乙醇洗脱的单宁含量为2.0%时,14株菌的生长被不同程度地促进,11株菌的生长受到抑制;体积分数为30%乙醇洗脱的单宁含量为2.0%时,8株菌的生长被不同程度地促进,17株菌的生长被抑制;而当单宁含量为3%~6%时,所有菌的生长均被抑制,直到单宁含量为6.0%时菌株彻底不生长。
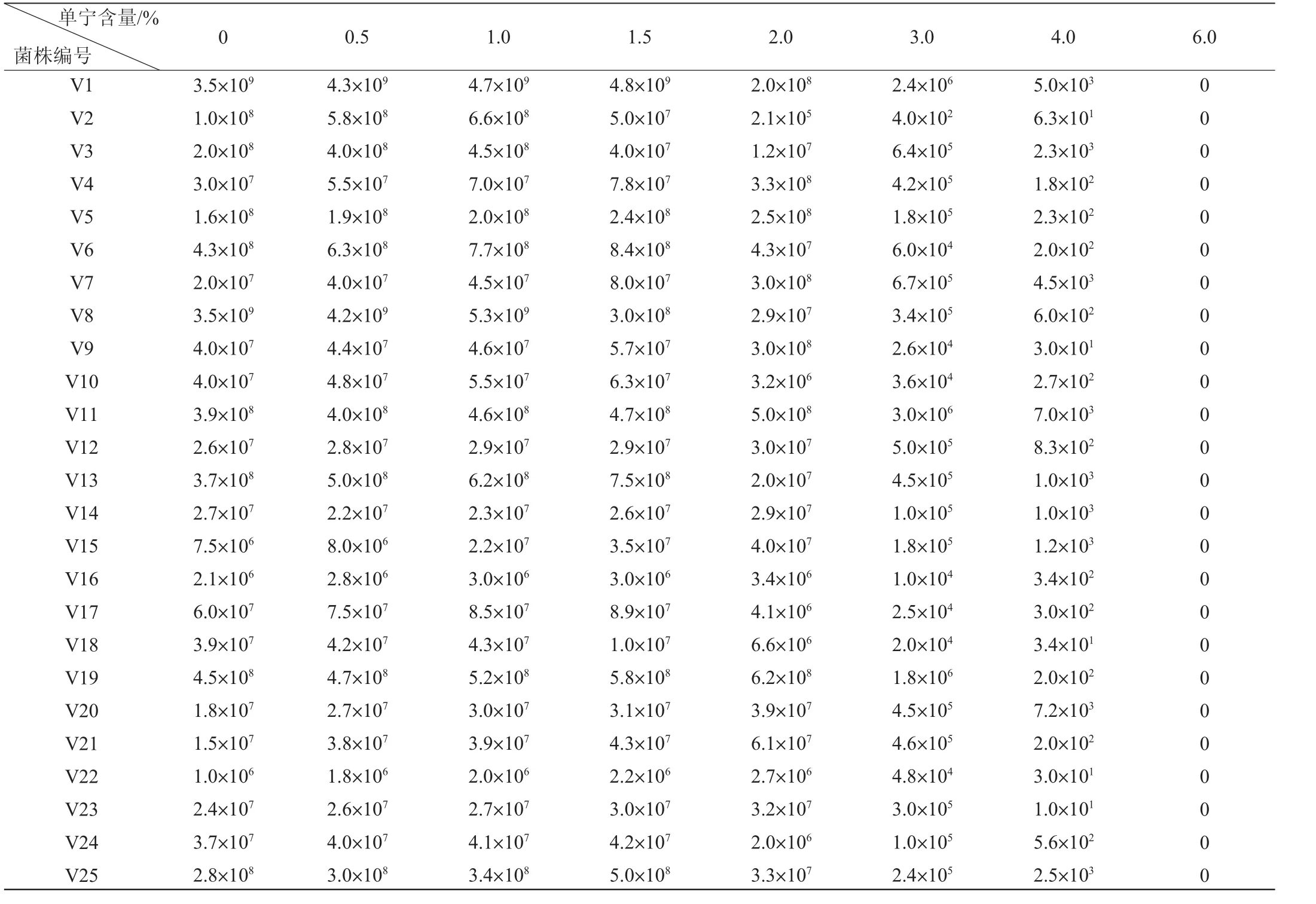
表6 体积分数为30%乙醇洗脱的单宁对醋酸菌菌落数的影响Table 6 Effect of tannin eluted by volume fraction 30%ethanol on the growth of acetic acid bacteria CFU/mL
2.5 讨论
本研究从山西老陈醋酒醅和醋醅中分离到的乳酸菌和醋酸菌与其他文献中的有所区别,这可能与酿醋的大曲和原料有关,不同地域环境中的微生物类群不同,因此分自不同厂家的样品中的微生物种类也有所差异。
乳酸菌和醋酸菌是食醋酿造的主要微生物。而山西老陈醋酿造主要原料高粱中的单宁对乳酸菌和醋酸菌生长的影响必然会影响整个酿造过程和醋的品质。目前,研究者们已发现,单宁能促进部分乳酸菌等的生长。田延楚等[14]研究发现乳酸菌发酵果蔬汁过程中有些菌对单宁酸的抑制不敏感。林款等[15]研究发现,添加2 g/L的柿单宁能有效地促进肠道有益菌(乳杆菌和双歧杆菌)的增殖,抑制有害菌(肠球菌、大肠杆菌、梭菌和拟杆菌)的增殖。侯海锋等[16]发现,添加了0.1%和0.15%水解单宁酸的蛋鸡肠道中乳酸杆菌和双歧杆菌数量提高,同时大肠杆菌数量显著降低。李大彪等[17]的研究表明,饲粮单宁添加量达6%时抑制瘤胃固相纤维降解菌的增殖。杨德莲等[18]发现在奶牛瘤胃体外发酵液中添加葡萄籽原花青素能显著影响瘤胃的微生物区系。目前,普遍认为细菌抗单宁的主要机制是与生物大分子的络合反应和金属离子的螯合作用。但是,如果细菌中的酶并不依赖金属离子,那么单宁与金属离子螯合就不会影响细菌的生长。如婴儿双歧杆菌和嗜酸乳杆菌就不会被单宁所抑制,乳酸菌不需要铁离子是因为乳酸菌含有腺甙钴胺素的酶取代了含有铁离子的核苷酸还原酶[19]。以上研究主要集中在单宁对体内乳酸菌的影响,对于高粱单宁在山西老陈醋酿造过程中的的联系与区别有待进一步进行研究。
3 结论
本研究从山西老陈醋发酵过程中共分离了36株乳酸菌和25株醋酸菌。36株乳酸菌分别为植物乳杆菌(L.plantarum),发酵乳酸杆菌(L.fermentium),干酪乳酸杆菌(L.casei),肠膜明串珠菌(Leuconostoc mesenteroides),类食品乳杆菌(L.paralimentarius)和短乳杆菌(L.brevis)。
通过对分离得到的菌株进行含一定浓度高粱单宁培养基的生长试验发现,不同洗脱梯度所获得的高粱单宁对乳酸菌和醋酸菌的影响不大,主要影响因子是其浓度含量。当高粱单宁含量在0~1.5%时,所有乳酸菌和大部分醋酸菌的生长均被促进;当单宁含量为2.0%时,对不同菌的生长影响不同(有一些菌株生长被促进,而另一些菌株生长被抑制);而当单宁含量为3.0%~6.0%时,所有乳酸菌和醋酸菌的生长均被抑制,且单宁含量越高抑制作用越强;直到单宁含量为6.0%时菌株彻底不生长。
