银胶菊内酯减轻氧糖剥夺/再灌注诱导的PC12细胞损伤
2018-09-05张军峰徐仓宝张一博房智超郝佳晖赵朝华
张军峰,徐 曦,徐仓宝,张一博,房智超,郝佳晖,赵朝华*
(西安医学院 1.陕西省缺血性心血管疾病重点实验室;2.人体解剖学教研室,陕西 西安710021)
脑缺血/再灌注(ischemia/reperfusion, I/R)损伤是一种常见病[1],近年来其诊治取得了一定进展,但其疗效仍不理想[2],因此,更好的揭示脑I/R损伤的分子机制非常重要。许多研究表明氧化应激与脑I/R损伤发病密切相关,抑制氧化应激或许是治疗脑I/R损伤的一种好方法。
银胶菊内酯/小白菊内酯(parthenolide,PTN)是从菊科植物(小白菊)中分离出来的一种药倍半萜烯内酯[3],在永久性大脑中动脉阻塞模型的研究中发现,PTN可以明显减轻神经功能损伤、脑水肿及减少脑梗死体积[4]。但是PTN是否能对抗脑I/R损伤尚不清楚。本研究用氧-葡萄糖剥夺-再灌注(oxygen-glucose deprivation-reperfuison, OGD/R)模型观察PTN对OGD/R诱导的大鼠肾上腺髓质嗜铬瘤细胞(PC12细胞)凋亡的神经保护作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞:大鼠肾上腺嗜铬细胞瘤细胞系PC12细胞(ATCC公司)。
1.1.2 试剂:胎牛血清(Gibco公司);PTN、链霉素、青霉素(Sigma-Aldrich公司);DMEM/F12培养基(Hyclone公司);Hank’s平衡盐溶液(Invitrogen公司);CCK-8(Dojindo公司);乳酸脱氢酶(lactate dehydrogenase, LDH)(Promega公司);二喹啉甲酸(bicinchonininc acid, BCA)、2’,7’-二氯荧光素二乙酸酯(DCFH-DA)、过氧化氢酶(catalase)、超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)活性检测试剂盒(上海碧云天生物技术有限公司);capase-3活性检测试剂盒(Abcam公司);小鼠抗Bcl-2、Bax、Akt、GSK-3β、p-Akt、p-GSK-3β、GAPDH单克隆抗体和HRP标记的兔抗小鼠二抗(Santa Cruz公司);ECL试剂盒(Pierce公司)。
1.2 方法
1.2.1 细胞分组及处理:将细胞分为对照组、OGD/R组和OGD/R+PTN预处理组(1、5、10和20 μmol/L),每组n=3。对照组PC12细胞用含10%胎牛血清、100 U/mL链霉素、100 U/mL青霉素的DMEM和F12(DMEM∶F12=1∶1)混合液(完全培养基)进行培养,细胞置于含有95%空气和5% CO2孵箱中,在37 ℃条件下培养。OGD/R组参照文献[5],OGD处理4 h,再正常培养24 h。OGD/R+PTN预处理组:在OGD之前1 h,将PTN加入细胞培养基中,最终工作浓度分别为1、5、10和20 μmol/L。
1.2.2 CCK-8法检测细胞活力:用CCK-8检测细胞活力,将PC12细胞接种于96孔板中(1.0×104个/孔),加入不同浓度PTN(1、5和10 μmol/L)后,进行OGD/R处理。OGD/R结束后,每孔加入10 μL CCK-8。37 ℃孵育1 h,用分光光度计在490 nm波段检测吸光度值。
1.2.3 LDH法检测细胞毒性:按照操作说明,在各种处理结束后,收集细胞培养上清液,检测LDH含量。以正常培养的PC12细胞培养基中LDH含量为基准(100%),用百分比表示各组细胞LDH释放量。
1.2.4 检测活性氧(reactive oxygen species, ROS)含量:按荧光探针DCFH-DA试剂盒说明书检测细胞内ROS含量。主要步骤如下:将细胞用DCFH-DA以20 μmol/L的终浓度于37 ℃孵育30 min(避光),PBS洗3次(5 min/次),用荧光酶标仪检测荧光强度。
1.2.5 抗氧化酶及caspase-3活性的检测:各组处理完成后,收集细胞、冰上裂解20 min,收集细胞匀浆,以4 ℃、12 000 r/min,离心15 min,收集上清液。细胞内抗氧化酶活性用试剂盒分别检测过氧化氢酶、SOD和GPx的活性。用caspase-3活性检测试剂盒检测caspase-3活性。
1.2.6 Western blot检测蛋白表达:RIPA裂解法抽提细胞总蛋白后,用BCA蛋白定量试剂盒测定的蛋白浓度,将各样品的蛋白浓度调节一致;经过SDS-PAGE、蛋白转印后,用含有5%脱脂奶粉的封闭液将转印好的硝酸纤维素膜,室温孵育,封闭1 h;加一抗:小鼠抗Bcl-2单克隆抗体(1∶1 000)、小鼠抗Bax单克隆抗体(1∶1 000)、小鼠抗Akt、GSK-3β单克隆抗体(1∶500)、小鼠抗p-Akt、p-GSK-3β单克隆抗体(1∶500)、小鼠抗GAPDH单克隆抗体(1∶2 000),4 ℃孵育过夜;加入HRP标记的兔抗小鼠二抗(均为1∶2 000),37 ℃孵育2 h; ECL成像,全自动凝胶成像系统G:BOX中采集图像。
1.3 统计学分析
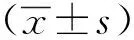
2 结果
2.1 PTN增加ODG/R处理后PC12细胞活力及减少LDH释放
与对照组相比,OGD/R处理组PC12细胞活力明显减小(P<0.01)、培养上清液中LDH量均明显升高(P<0.05)。1、5、10和20 μmol/L PTN预处理组PC12细胞活力均较OGD/R组明显回升(P<0.05)、培养上清液中LDH含量均明显减少(P<0.05)(图1)。
2.2 PTN降低ODG处理后PC12细胞中ROS水平及增加酶活性
与正常组相比,OGD/R处理可以明显增加PC12细胞内ROS水平(2.8倍)P<0.01)(图2)。与OGD/R组相比,PTN预处理(1、5和10 μmol/L)组PC12细胞内ROS水平又明显降低(P<0.05)(图2),过氧化氢酶(P<0.05)、SOD(P<0.05)和GPx(P<0.05)(图2)的活性明显升高。
2.3 PTN对ODG/R后PC12细胞中Bax/Bcl-2-caspase3信号通路的影响
与正常组相比,OGD/R处理组PC12细胞Bax表达量和caspase-3活性明显升高,Bcl-2表达量明显降低(P<0.05)(图3)。而与OGD/R处理组相比,10 μmol/L PTN预处理组PC12细胞内Bax表达量和caspase-3活性明显降低,Bcl-2表达明显升高(P<0.05)(图3)。
2.4 PTN促进ODG处理后PC12细胞内Akt和GSK-3β的磷酸化
与正常组相比, ODG/R组PC12细胞内p-Akt/Akt和p-GSK-3β/GSK-3β值明显减少(P<0.01)(图4)。而与OGD/R组相比,PTN预处理组PC12细胞内p-Akt/Akt和p-GSK-3β/GSK-3β值明显回升(P<0.01)(图4)。
3 讨论
OGD/R是在体外研究缺血的一种常用模型,其可以模拟缺血诱导的细胞损伤[6]。本研究发现OGD/R处理明显降低PC12细胞活力,增加LDH释放,与文献报道一致[5,7]。而PTN可以明显促进PC12细胞存活,减少LDH释放,提示PTN具有对抗OGD/R诱导细胞损伤的作用。在检测细胞活力实验中,由于10 μmol/L与20 μmol/L PTN预处理对PC12细胞活力无显著差异,因此选择了10 μmol/L作为工作浓度。
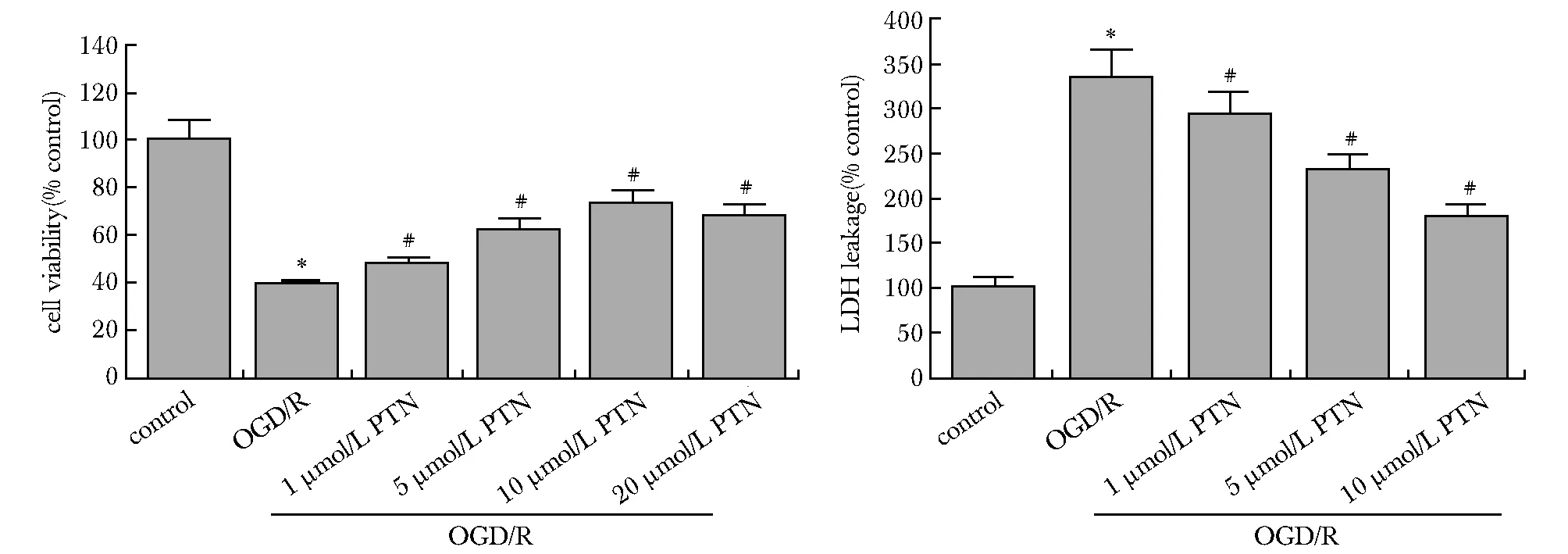
*P<0.01 compared with control group; #P<0.05 compared with OGD/R group图1 PTN预处理对OGD/R后PC12细胞的活力及LDH释放的影响Fig 1 Pretreatment with PTN increased cell viability and prevented LDH release in OGD-treated PC12 n=3)

*P<0.05, **P<0.01 compared with control group; #P<0.05 compared with OGD/R group图2 PTN预处理对OGD/R后PC12细胞内ROS及酶活性的影响
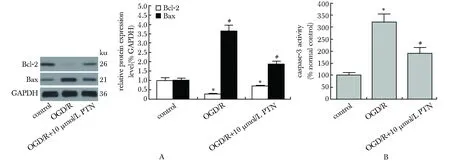
A.Western blot; B.caspase-3 activity assay; *P<0.05 compared with control group; #P<0.05 compared with OGD/R group
本研究发现OGD/R诱导ROS产物,但PTN可以明显抑制这一过程。PTN还可以明显修复OGD/R处理后PC12细胞中过氧化氢酶、SOD和GPx的活性。说明PTN可以抑制OGD/R诱导的氧化应激,其可能是通过抑制ROS的聚集、增加酶的活性来实现的[8-9]。

*P<0.01 compared with control group; #P<0.01 compared with OGD/R group图4 PTN预处理增强OGD/R后PC12细胞内Akt和GSK-3β磷酸化Fig 4 PTN promoted the phosphorylation of Akt and GSK-3β in OGD-treated PC12 n=3)
凋亡是引起脑I/R损伤的主要原因[8]。Bcl-2家族蛋白包括抗凋亡蛋白 (如Bcl-2和Bcl-xL)和促凋亡蛋白(如Bax和Bak)。Bcl-2/Bax的比值可以很好的反映凋亡的调节情况[10]。在缺血性脑卒中的动物模型中,caspase-3也是一个非常重要的凋亡调节因子[11]。本研究发现,PTN可以明显下调OGD/R处理后PC12细胞中Bax的表达及caspase-3的活性,而上调Bcl-2的表达量。提示PTN可以通过降低OGD/R介导的caspase-3激活、上调Bcl-2表达,对体外培养的PC12细胞产生保护作用。
在脑I/R损伤的进程中,Akt/GSK-3β信号通路也起着非常重要的作用[12-13]。Akt是PI3K的一个下游激酶,其可以通过磷酸化被激活,进而调控细胞死亡和存活。在脑缺血病理进程中,Akt可以通过磷酸化下游的靶分子GSK-3β,进而调控线粒体信号传导和细胞凋亡[14]。本研究发现PTN可以明显促进OGD/R处理后PC12细胞内Akt和GSK-3β的磷酸化。提示PTN可能通过激活Akt/ GSK-3β信号通路,对OGD/R诱导的PC12细胞损伤产生保护作用。
综上所述,本研究发现PTN对OGD/R诱导的损伤具有神经保护作用,其可能是通过激活Akt/ GSK-3β信号通路来实现的,PTN可能会成为一种潜在的治疗脑I/R损伤的药物。
