便秘型肠易激综合征大鼠结肠黏膜下神经元的变化
2018-09-05费贵军胡福境樊文娟梁列新方秀才
费贵军,胡福境,,樊文娟,梁列新,方秀才*
(1.中国医学科学院 北京协和医学院 北京协和医院 消化内科,北京 100730;2.广西壮族自治区人民医院 消化内科, 广西 南宁 530021)
肠易激综合征(irritable bowel syndrome, IBS)是一种以腹痛或腹部不适伴随粪便性状改变和/或排便习惯改变的功能性肠病,临床上主要根据症状学标准进行诊断。依据罗马IV诊断标准[1],将IBS分为腹泻型、便秘型、混合型和未定型,其发病机制尚未明确。肠神经系统(enteric nervous system,ENS)是调节胃肠道感觉、运动和分泌等复杂功能协调运行的基础。目前IBS发病机制中肠道动力异常研究较多,而从ENS的角度进行黏膜分泌相关的研究很少。本研究采用冰水灌胃法建立便秘型IBS(IBS with constipation,IBS-C)大鼠模型,应用免疫荧光多重染色技术检测大鼠结肠黏膜下神经丛(submucosal plexus,SMP)中兴奋性分泌运动神经元[胆碱乙酰转移酶即ChAT免疫反应(immunoreactivity,IR)阳性神经元和血管活性肠肽即VIP-IR(vasoactive intestinal palypeptide-IR)阳性神经元]和抑制性神经元[一氧化氮合酶即NOS-IR(nitric oxide synthase-IR)阳性神经元]的活化状态,探讨ENS在IBS-C发病中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性Wistar大鼠,体质量为140~150 g[北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012- 0001]。
1.1.2 试剂:一抗:抗神经核抗体Anti-Hu (Abcam公司);抗c-fos抗体和抗VIP抗体(Santa Cruz公司);抗 ChAT抗体和抗NOS抗体(Chemicon公司)。二抗: TRITC-驴抗小鼠IgG、DyLight405-驴抗兔IgG和FITC-驴抗山羊IgG(Jackson公司)。
1.2 方法
1.2.1 大鼠分组及处理:将大鼠分为对照组和IBS-C模型组。参考文献[2]应用冰水灌胃法建立IBS-C模型。
1.2.2 粪便性状检测:计数2组大鼠粪便颗粒数,称干湿质量,计算粪便含水量。大鼠出现粪便颗粒数和粪便含水量下降,认为IBS-C造模成功。
1.2.3 肠道传输功能测定:大鼠禁食24 h后,予每只大鼠10%活性炭混悬液2 mL灌胃。6 h后颈椎脱臼法处死大鼠,将幽门至直肠末端完整取出,测量肠道的全长和炭末混悬液在肠道内推进的距离。计算肠道内活性炭末通过率:活性炭末混悬液推进长度/肠道全长×100%。
1.2.4 SMP全层铺片标本的解剖制备:取距肛门6~9 cm远端结肠组织,剖开平铺后于室温下中性福尔马林溶液浸泡固定至少24 h。漂洗标本后,在解剖显微镜下,用显微分离器械小心地逐层剥除黏膜层、纵行肌和环形肌肌束,所得的黏膜下层组织即含有完整SMP的全层铺片标本。
1.2.5 免疫荧光三重染色法:磷酸盐缓冲液漂洗制备好的结肠SMP全层铺片标本,用驴血清封闭2 h。加抗神经核抗体(Anti-Hu,1∶100)/ Anti c-fos(1∶100)/抗 ChAT一抗(1∶100)或抗VIP一抗(1∶100)或抗NOS一抗(1∶100)混合液孵育,室温过夜;漂洗后加二抗即TRITC标记驴抗小鼠IgG(1∶300)、DyLight405标记驴抗兔IgG(1∶100)和FITC标记驴抗山羊IgG(1∶300)混合液,4℃避光孵育1 h。然后按常规步骤进行漂洗和封片。
1.2.6 荧光显微镜(Nikon eclipse 80i)观察计数:每只大鼠分别取6张结肠SMP全层铺片标本,从每张标本中随机选取5个不重叠高倍视野(10×20),计数每个高倍视野中SMP的神经节数、SMP神经元总数(以Anti-Hu-IR阳性为标志)、特异性SMP神经元数(即ChAT-IR阳性神经元、VIP-IR阳性神经元和NOS-IR阳性神经元);以c-fos-IR阳性作为神经元活化标志,计数相应的活化神经元数。
1.3 统计学分析
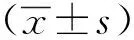
2 结果
2.1 冰水灌胃后大鼠粪便颗粒数及含水量变化
模型组体质量增长缓慢,粪便颗粒数减少的同时,粪便含水量较对照组显著下降(P<0.01)(图1)。
2.2 IBS-C模型组大鼠肠道传输减慢
IBS-C模型大鼠活性炭悬浊液在全肠道中通过率为87.1%±3.8%,显著低于对照组的92.6%±5.0%(P<0.05)。
2.3 模型组大鼠结肠SMP中神经元的变化
神经元总数和活化神经元数显著增多(表1)。
2.4 模型组大鼠结肠SMP中胆碱能神经元的变化
活化的胆碱能神经元数量和比例显著降低(表2)。
2.5 模型组大鼠结肠SMP中VIP能神经元的变化
活化的VIP能神经元比例显著降低(表3)。
2.6 模型组大鼠结肠SMP中氮能神经元的变化
NOS-IR阳性神经元总数以及其活化的数量和比例明显增高(表4)。
3 讨论
IBS发病机制涉及动力、感觉、脑-肠轴和黏膜通透性等, 其中ENS的作用受到高度重视[1]。ENS肌间神经丛主要调控肠道运动功能,黏膜下神经丛(SMP)主要调控黏膜分泌功能。IBS-C模型 SMP内兴奋性和抑制性神经递质表达有变化[3];IBS患者乙状结肠黏膜及血浆VIP含量升高,VIP表达上调[4]。而有关IBS的SMP神经元活化状态的研究鲜见报道。本研究以c-fos作为神经元活化标志物[5],发现IBS模型大鼠多种SMP神经元活化状态出现明显变化,存在神经可塑性。

*P<0.05 compared with control图1 大鼠粪便颗粒数及含水量变化趋势Fig 1 Changes of number of fecal granules and water content of feces in n=7)

groupganglia/HPFneurons/HPFactivated neurons/HPFcontrol5.0±1.436.1±9.819.9±9.6model6.0±2.9*44.4±17.5*24.3±12.7*
HPF:high power field;*P<0.05 compared with control.
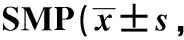
表2 结肠SMP胆碱能神经元的变化Table 2 Changes of cholinergic neurons in colonic n=7)
*P<0.05 compared with control.
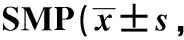
表3 结肠SMP VIP能神经元的变化Table 3 Changes of VIPergic neurons in colonic n=7)
*P<0.05 compared with control.
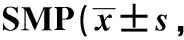
表4 结肠SMP氮能神经元的变化Table 4 Changes of nitrergic neurons in colonic n=7)
*P<0.05 compared with control.
乙酰胆碱(Ach)是SMP神经元释放的主要兴奋性递质。ChAT是胆碱能神经元特异性标志[6]。不同类型胆碱能神经元释放Ach发生变化,均能够影响肠道的分泌反射。本研究发现,IBS-C模型大鼠结肠SMP中胆碱能神经元比例以及活化比例均显著降低,提示其对结肠分泌功能的促进作用可能下降,结肠黏膜分泌减少。
VIP是SMP分泌运动神经元释放的主要兴奋性递质[7- 8],促进上皮的分泌。本研究发现,IBS-C模型大鼠结肠SMP中,VIP能神经元数量和比例显著降低,并且其活化比例明显降低,提示SMP神经元释放VIP减少,相应的黏膜上皮分泌功能下降,促进便秘的发生。
NO是ENS氮能神经元释放的最主要的抑制性递质,NO含量在不同亚型IBS患者中的变化存在差异[9- 10],IBS-D患者结肠黏膜NO含量显著减少,而IBS-C患者NO含量明显增高;黏膜NO含量与乙状结肠、直肠的运动指数呈负相关。氮能神经元在ENS肌间神经丛中密集分布,仅少量分布于SMP;NOS是这类神经元标志物。本研究发现IBS-C大鼠结肠SMP中NOS-IR阳性神经元总数和比例均显著增多,并且活化的程度增高;推测该变化可能导致分泌运动神经元的兴奋性受抑制,黏膜分泌功能减弱,相应出现粪便颗粒数和含水量下降;并且分泌运动神经元兴奋性受抑制还可导致黏膜下小血管的舒张作用减弱,而后者与黏膜分泌反射调控密切相关[11]。
综上所述,IBS-C模型大鼠的结肠SMP兴奋性分泌运动神经元活化减少,抑制性神经元活化增多,可能参与结肠黏膜分泌调节的异常,提示肠神经系统SMP的变化可能在IBS-C的发病中发挥重要作用。
