miR-185在妊娠合并系统性红斑狼疮患者的T细胞异常甲基化中的作用及分子机制
2018-09-05刘恩令周玉秀张冬红
刘恩令,刘 铮,周玉秀,张冬红,陈 梅
(1.河北医科大学附属唐山市工人医院 妇产科,河北 唐山 063000; 2.天津医科大学总医院 风湿免疫科,天津 300052; 3.河北医科大学附属唐山市工人医院 风湿免疫科, 河北 唐山 063000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多个器官的慢性自身免疫性疾病。SLE主要在女性群体中发病[1]。虽然遗传、种族、激素和环境因素等都会影响到SLE的发生发展,但SLE的确切致病机制仍不十分明确[2-3]。最近报道,miR-185可以直接靶向作用于DNA甲基转移酶1(DNA methyltransferase 1,DNMT1),从而导致全基因组甲基化(global DNA methylation,GDM)的减少和调控胶质瘤细胞中启动子-超甲基化基因的表达[4]。然而,miR-185如何通过调控DNMT1的表达和基因组DNA甲基化,从而影响SLE的发生发展的机制尚无系统的探讨。本研究的主要目的是阐明miR-185在SLE患者的T细胞异常甲基化中所起的作用及潜在分子机制。
1 材料与方法
1.1 材料
1.1.1 受试者: 实验组为20例患有SLE的妊娠女性患者,平均年龄(31.9±10.7)岁。对照组为20名健康的女性志愿者,平均年龄(31.2±11.4)岁,所有患者都符合美国风湿病学会的SLE分类标准, 用SLE疾病活动指数(SLEDAI)评估SLE活性, 所有参与者都来自中国汉族人群, 合并感染者被排除在研究之外。本研究经河北医科大学附属唐山市工人医院伦理委员会批准,并经患者知情同意。收集所有受试者外周血样本进行实验研究。
1.1.2 试剂: 磁珠(Miltenyi Biotec公司); 人T细胞Nucleofector试剂盒、 Trizol试剂(Life Technologies公司);PrimeScript RT Master Mix和SYBR PrimeScript miRNA RT-PCR反转录和实时定量PCR试剂盒、miR-185和U6的引物(Genepharm公司); 硝酸纤维素膜(Millipore)(Bedford公司);Dual-Glo荧光素酶测定系统(E1960)(Promega公司);MethyflashTMDNA甲基化定量试剂盒(Epigentek公司);抗DNMT1抗体、CD11a、CD70和β-肌动蛋白抗体(Abcam公司)。
1.2 方法
1.2.1 T细胞的分离、培养和转染: 通过Ficoll-Hypaque密度梯度离心分离外周血单核细胞(peripheral blood mononuclear cell,PBMC)。通过磁珠阳性选择分离法分离CD4+T细胞,通过流式细胞计量术进行纯度评估(纯度为95.5%±1.2%)。分离得到的细胞在AIM V无血清培养基中培养。使用人T细胞Nucleofector试剂盒和Amaxa核转染技术(V-24程序),用FAM标记的miRNA瞬时转染CD4+T细胞。核转染后48 h分析DNMT1 mRNA和蛋白的表达,核转染后72 h检测甲基化敏感性基因的水平。
1.2.2 实时定量PCR(RT-qPCR): 使用Trizol试剂按照说明书从细胞系中提取总RNA。使用PrimeScript RT Master Mix和SYBR PrimeScript miRNA RT-PCR试剂盒分别进行mRNA和miRNA的反转录和实时定量PCR。所有反应都进行3组平行实验。通过U6和β-肌动蛋白对miRNA进行定量。使用2-△△Ct方法计算相对表达水平。引物如下:DNMT1上游引物:5′-CG-GTTCTTCCTCCTGGAGA ATGTCA-3′,下游引物:5′-CACTGATAGCCCATGCG GACCA-3′;β-肌动蛋白上游引物:5′-GCACCACACC TTCTACAATGAGC-3′,下游引物:5′-GGATAGCACA GCCTGGATAGCAAC-3′。
1.2.3 蛋白质提取和蛋白质印迹分析: 将细胞在补充有蛋白酶抑制剂混合物的RIPA缓冲液中置冰上裂解30 min。4 ℃,10 000×g,离心10 min至裂解液澄清。通过10% SDS-PAGE凝胶电泳分离等量的蛋白质,并通过电转将分离的蛋白质转移到硝酸纤维素膜上。在含有0.1% Tween-20的Tris中用5%(w/v)脱脂牛奶封闭硝酸纤维素膜。将膜与抗待检蛋白抗体(一抗)反应过夜,与共价结合有HRP的二抗在室温条件下反应1 h。用ECL技术观察条带。使用Quantity One软件(Bio-Rad)定量相对表达水平。
1.2.4 荧光素酶报告实验: 为了确定DNMT1是否是miR-185的直接靶标,本研究构建了荧光素酶质粒,质粒中包含有3′-UTR(非翻译区)片段的miR-185可能的靶序列及下游区的荧光素酶基因。使用Dual-Glo荧光素酶测定系统测定裂解物,通过光度计进行定量。
1.2.5 DNA提取和全基因组DNA甲基化检测: 使用All Prep DNA/RNA/Protein Mini试剂盒按照说明书中的方案从CD4+T细胞中提取基因组DNA。使用MethyflashTMDNA甲基化定量试剂盒评估CD4+T细胞中DNA的全基因组甲基化水平。全基因组甲基化比率在结果中展示(甲基化%)。
1.2.6 亚硫酸氢钠法测序: 使用QIAamp DNA Blood Midi试剂盒从miRNA转染后的细胞中分离基因组DNA,然后使用Imprint DNA修饰试剂盒用亚硫酸氢盐处理基因组DNA。基于亚硫酸氢盐转化的PCR引物用MethPrimer程序设计:CD70上游引物:5′-GAGGTTATGAATTTTGGGAGGATAT-3′,下游引物:5′-TCCCATCTCAACCTTTTACATAATTA-3′; CD11a上游引物:5′-GTTATTTAGGTAGGAGTGTA GTGGTA-3′,下游引物:5′-ACAAATCAACTAAAATC AAAAATTC-3′。使用Wizard DNA Clean-up System(Promega公司)纯化PCR产物,然后克隆到pGEM-T Easy载体Ⅰ(Promega)中。每个样本中均选取8个独立的克隆,并使用T7和Sp6引物对插入的片段进行测序。
1.3 统计学分析
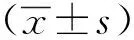
2 结果
2.1 妊娠合并SLE患者的CD4+ T细胞中miR-185表达与DNMT1表达呈负相关
妊娠合并SLE患者的CD4+T细胞中miR-185表达水平显著高于健康对照者(图1A)(P<0.01),而DNMT1的结果正好相反(图1B)(P<0.01)。此外,miR-185的表达量与DNMT1表达量之间呈非常显著的负相关关系(图1C)(r=-0.8432,P<0.0001)。
2.2 miR-185的靶标DNMT1
根据miR-185表达水平的显著变化(图2B, 2C),miR-185能够明显抑制携带野生型3′-UTR的DNMT1报告载体的活性;而携带突变miR-185潜在3′-UTR区域结合位点的载体,miR-185的作用受到了明显的抑制(图2D)(P<0.01)。miR-185的过表达会显著降低DNMT1的蛋白水平(P<0.01),而敲除miR-185则促进了DNMT1蛋白水平的提高(图2E,F,G)(P<0.01)。
2.3 miR-185的过表达降低全基因组DNA甲基化且诱导CD11a和CD70的表达
如图3A所示,miR-185的上调降低全基因组DNA甲基化水平,并且增加CD11a和CD70的mRNA(图3C)和蛋白质表达水平(图3D)(P<0.05)。此外,实验结果显示,CD11a和CD70启动子的甲基化水平显著降低(图3B)(P<0.05),这与两种基因的mRNA和蛋白表达增加一致。

A.expression of miR-185 in SLE and control group;B.expression of DNMT1 in SLE and control group; C.expression and correlation analysis of miR-185 and DNMT1
图1miR-185和DNMT1的表达及相关性分析
Fig1ExpressionandcorrelationanalysisofmiR-185andDNMT1
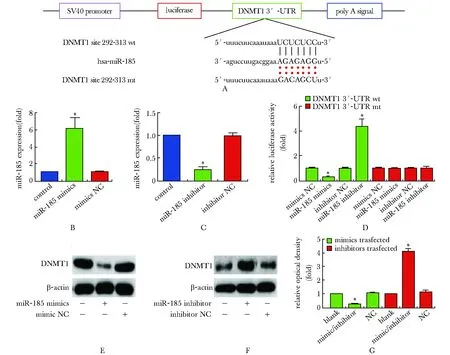
A.luciferase reporter gene construction; B.expression of miR-185 after treatment with mimics; C.expression of miR-185 after treatment with inhibitor; D.effects on the activity of luciferase of miR-185 mimics and inhibitor; E.expression of DNMT1 after treatment with mimics; F.expression of DNMT1 after treatment with inhibitor;G.quantitative analysis of Western blot with BandScan 5.0 software
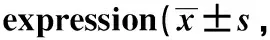
2.4 miR-185敲除可潜在降低妊娠合并SLE患者的CD4+ T细胞的低甲基化
miR-185抑制剂转染SLE患者的CD4+T细胞72 h后,CD11a和CD70启动子DNA(图4A)和全基因组DNA(图4B)的甲基化水平显著增加(P<0.05),这两个基因的mRNA(图4C)和蛋白质水平(图4D)显著降低(P<0.05)。
3 讨论
DNA甲基化是染色质结构的基本决定因素,对基因表达具有有效的抑制作用。最近的研究表明,T细胞DNA去甲基化在SLE的发病机制中起着重要的作用[5]。更多数据表明,SLE患者的T细胞中DNA转移酶(DNMTs)的表达明显减少[6]。DNA甲基化抑制剂如5-氮杂胞苷可诱导小鼠的T细胞发生自身免疫,表现出狼疮症状[7]。此外,药物诱导的狼疮与DNA甲基化和DNA甲基转移酶的异常表达相关[8]。DNMTs是基因组甲基化状态和强度的关键调节因子。目前,已经确定了3种具有催化活性的DNMT1,即DNMT、DNMT3A和DNMT3B[9]。DNMT1是基础性表达基因,在DNA复制期间负责DNA甲基化的正常进行。本研究通过检测妊娠合并SLE患者的T细胞样本,发现miR-185在CD4+细胞中表达显著上调。从机制上看,miR-185与SLE中的DNA低甲基化有关,通过直接抑制DNMT1的表达参与SLE的发病机制。
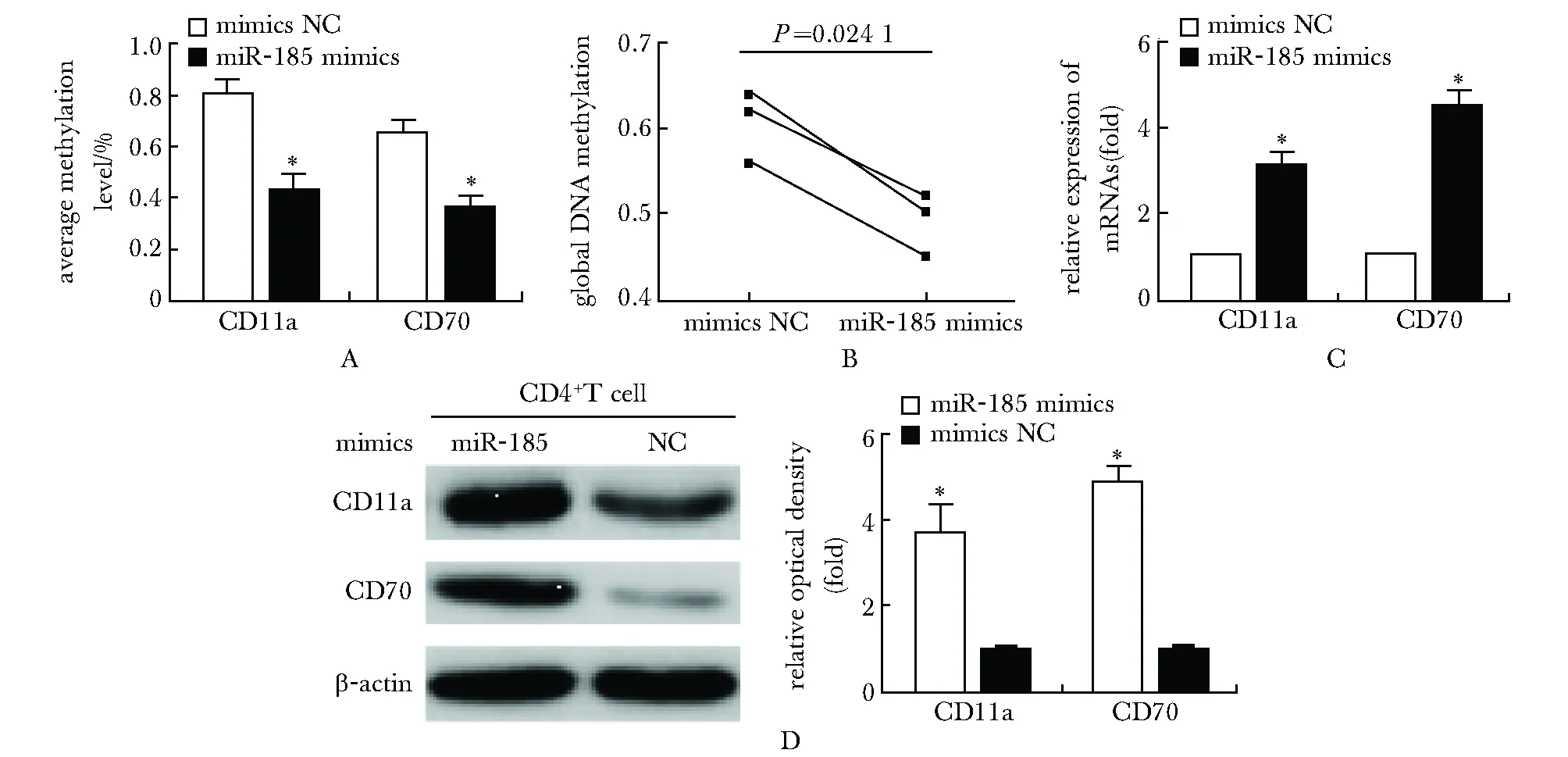
A.effect on the average methylation level in the promoter region of CD11a and CD70 of miR-185 mimics or negative control transfection;B.effect on the global DNA methylation status of miR-185 mimics; C.effect on the mRNA expression of CD11a and CD70 of miR-185 mimics; D.effects on the protein expression of CD11a and CD70 of miR-185 mimics
图3miR-185的表达和CD11a和CD70启动子DNA的低甲基化导致CD11a和CD70表达增加
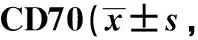

A.effect on the average methylation level in the promoter region of CD11a and CD70 of miR-185 inhibitor or negative control transfection;B.effect of miR-185 inhibitor on the DNA methylation status of the global DNA of miR-185 inhibitor; C.effect on the expression of mRNA in CD11a and CD70 of miR-185 inhibitor; D.effect on the protein expression of CD11a and CD70 of miR-185 inhibitor
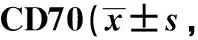
最近Dai Y等人对比SLE患者和健康人的PBMC,发现其中一部分miRNA发生了失调[10]。miR-146a可通过抑制SLE患者PBMC中的IFN信号通路来调节SLE的进展[11]。同时,部分miRNA可直接与DNMT1的3′-UTR区域结合,从而抑制其在狼疮患者的CD4+T细胞中的表达,如miR-126、miR-148a和miR-21[12-13]。此外,人T细胞中miR-29b的上调会抑制SP1表达,这就说明其可抑制DNMT1的表达并调节DNA甲基化。也有更深入的研究显示,在SLE患者的T细胞中抑制miR-29b可逆转DNA低甲基化且上调下游基因[14]。在本研究中发现,来自健康对照的CD4+T细胞中,miR-185的过表达会导致全基因组DNA和CD11a和CD70基因启动子甲基化程度下调,其他相关基因的上调。如果敲除SLE患者CD4+T细胞中的miR-185,会提高DNMT1的表达,降低甲基化敏感性基因的表达。
总之,综合整个实验结果,干预miR-185的表达水平可为SLE的干预治疗提供新的有潜在研究价值的治疗策略。对基因敲除和转基因动物模型的进一步研究将有助于确定miR-185在自身免疫性疾病中所起的作用。
