一株银耳污染菌的分离鉴定及其生长条件研究
2018-09-05邱希斌
邱希斌
一株银耳污染菌的分离鉴定及其生长条件研究
邱希斌1,2
(1. 福建省产品质量检验研究院,国家加工食品质量监督检验中心,福建 福州 350002; 2. 福建农林大学食品科学学院,福建 福州 350002)
对生产中在银耳子实体表面发现的一种产红色色素的污染菌进行分离,经形态学和分子水平分类鉴定为丝枝蜡蚧霉()。在pH为8.0、培养温度为28 ℃时,该菌的菌丝生长最快;其生长的最佳碳、氮源及用量分别为8%乳糖和6%酵母浸粉。
银耳;污染菌;鉴定;丝枝蜡蚧霉;分子特性;生长条件
银耳()又名白木耳、雪耳等,有“菌中之冠”的美称。其美味可口,营养丰富,又具有抗癌等药用价值,在市场上非常受欢迎。但银耳在栽培中,容易受到杂菌污染,导致减产或栽培失败,其中真菌作为主要病害菌是研究的热点。
经典的微生物分离鉴定方法,主要运用选择性培养基,在适宜的培养条件下进行培养,进而进行分离纯化,而后根据菌体在培养基上生长的形态学特征等作出分类。苏春丽等认为仅依靠经典分类学方法来对未知病原菌进行细致分类和准确鉴定,存在很多难以攻克的壁垒和严重的不足[1]。随着分子生物学的发展,White等在总结前人研究的基础上,开拓性地为真菌的rRNA基因核糖体内转录间隔区设计了3对特异引物,命名为ITS 1、ITS 4、ITS 5。这3对特异性引物,对于绝大多数的担子菌和子囊菌都表现出了较为良好的可扩增特性,这为ITS引物的特异性设计,及其成功运用于真菌鉴定奠定了重要基础[2]。
本研究对银耳子实体表面发现的一种产红色色素的污染真菌进行了形态学和分子生物学鉴定,研究温度、培养基pH、碳源及氮源对该菌株的影响,为今后该菌的防治或应用提供参考。
1 材料和方法
1.1 材料
(1)供试菌株。由福建农林大学菌物研究中心从被污染的银耳上分离获得,命名为FQ-01。
(2)供试试剂。PDA培养基:琼脂粉20 g,葡萄糖20 g,马铃薯浸粉5 g,氯霉素0.1 g,蒸馏水1 L;121 ℃高压灭菌15 min,制成平板培养基待用。PDB液体培养基:葡萄糖20 g,马铃薯浸粉5 g,氯霉素0.1 g,蒸馏水1 L;121 ℃高压灭菌15 min,待用。
1.2 菌株的形态学观察和鉴定
(1)银耳污染菌(FQ-01)的分离。从患病的子实体(图1)上用灭过菌的接种针钩取病原菌的尖端菌丝,移入PDA平板,28 ℃恒温培养。再从无污染的培养皿上用灭过菌的接种针钩取前端菌丝,移入新鲜的PDA试管,28 ℃恒温培养。

图1 患病的银耳子实体
(2)形态观察。将污染菌接种至PDA平板上,28 ℃培养3~5天后,观察菌落形态。随后从培养的菌落上切取一小块菌块,转接到新的PDA平板上,接近接种块2~3 mm处,斜插入一块无菌的盖玻片,待菌丝爬上盖玻片后,取出在电子显微镜下观察:菌丝生长形态,分生孢子梗形态,分生孢子形态及大小等。测定孢子的长度和宽度,根据菌落特征形态、孢子特征,对FQ-01菌进行初步形态学鉴定[3, 4]。
(3)分子生物学鉴定。将接种至PDA平板上,28 ℃培养3~5天的菌株,用直径9 mm 的打孔器在菌落边缘切取菌块。接种于PDB培养基中,置于28 ℃的振荡培养箱中,150 r/min振荡培养120 h。之后用滤纸过滤,使用无菌蒸馏水冲洗7~8次,并置于无菌滤纸上吸干后待用。
菌丝体使用Ezup柱式真菌基因组DNA抽提试剂盒提取基因组DNA。ITS-r DNA序列扩增采用真菌通用PCR 扩增引物[5]:ITS1-F:5’-CTT GGTCAT TTA GAG GAA GT-3’ ITS4-R:5’-CCT CCGCTT ATT GAT ATG C-3’ 。PCR反应体系(50 μL)为:基因组DNA(200 ng/μL)2.0 μL,引物ITS1(20 μM)1.0 μL,引物ITS4(20 μM)1.0 μL,2×Taq PCR Master Mix 25.0 μL,ddH2O 21.0;反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,32个循环,72 ℃延伸10 min。
电泳结束后将琼脂糖凝胶转移至溴化乙锭溶液(1 mg/L)中,浸没染色20 min,再用清水漂洗2 min后将凝胶转移至凝胶成像系统,开启紫外观察,并拍照记录电泳结果。回收的PCR产物交由生工生物工程(上海)股份有限公司进行测序,将测序在GenBank进行同源性比对,并在NCBI-Blast中选择重合率较高的菌株,再运用MEGA 6.0软件构建FQ-01菌的系统发育树。
1.3 碳源利用实验
以PDA培养基为基础培养基。以乳糖、蔗糖、甘油、可溶性淀粉等量替换基础培养基中的葡萄糖。进行最佳碳源及最佳添加比例实验,添加质量百分比分别为6%、8%、10%、12%。使用内径为9 mm的打孔器,在已经过活化培养3天的菌株供试平板菌落的同一半径处打孔取出菌块,接种到供试平板培养基上,置于28 ℃下正置培养,培养至第三天后开始采用直尺十字交叉法测量菌落的生长直径。每隔2天观测一次,直到第11天。
1.4 氮源利用实验
以PDA培养基为基础培养基。以蛋白胨、硝酸钾、硫酸铵、尿素和酵母浸粉等量加入基础培养基,进行最佳氮源及最佳添加量实验,添加质量百分比分别为6%、8%、10%、12%,其余操作同碳源实验。
1.5 最适生长温度实验
将菌块分别接种于新的PDA平板上,分别置于20 ℃、25 ℃、28 ℃、30 ℃、36 ℃五个不同温度的生化培养箱内正置培养。其余操作同碳源实验。
1.6 最适pH实验
将灭菌后的PDA培养基pH分别调至4.0、5.0、6.0、7.0、8.0后倾注平板,冷却后接种菌株,置于28 ℃下正置培养。其余操作同碳源实验。
2 结果与分析
2.1 菌落形态特征
于28 ℃培养9天时,PDA培养基上的菌落形态特征为:菌丝呈白色絮状,菌丝体生长较为致密(图2-A),在PDA培养皿上,菌落背面呈现红色或深红色,色素常常扩散到整个琼脂培养基内(图2-B),平均生长速度为4.69 mm/d。
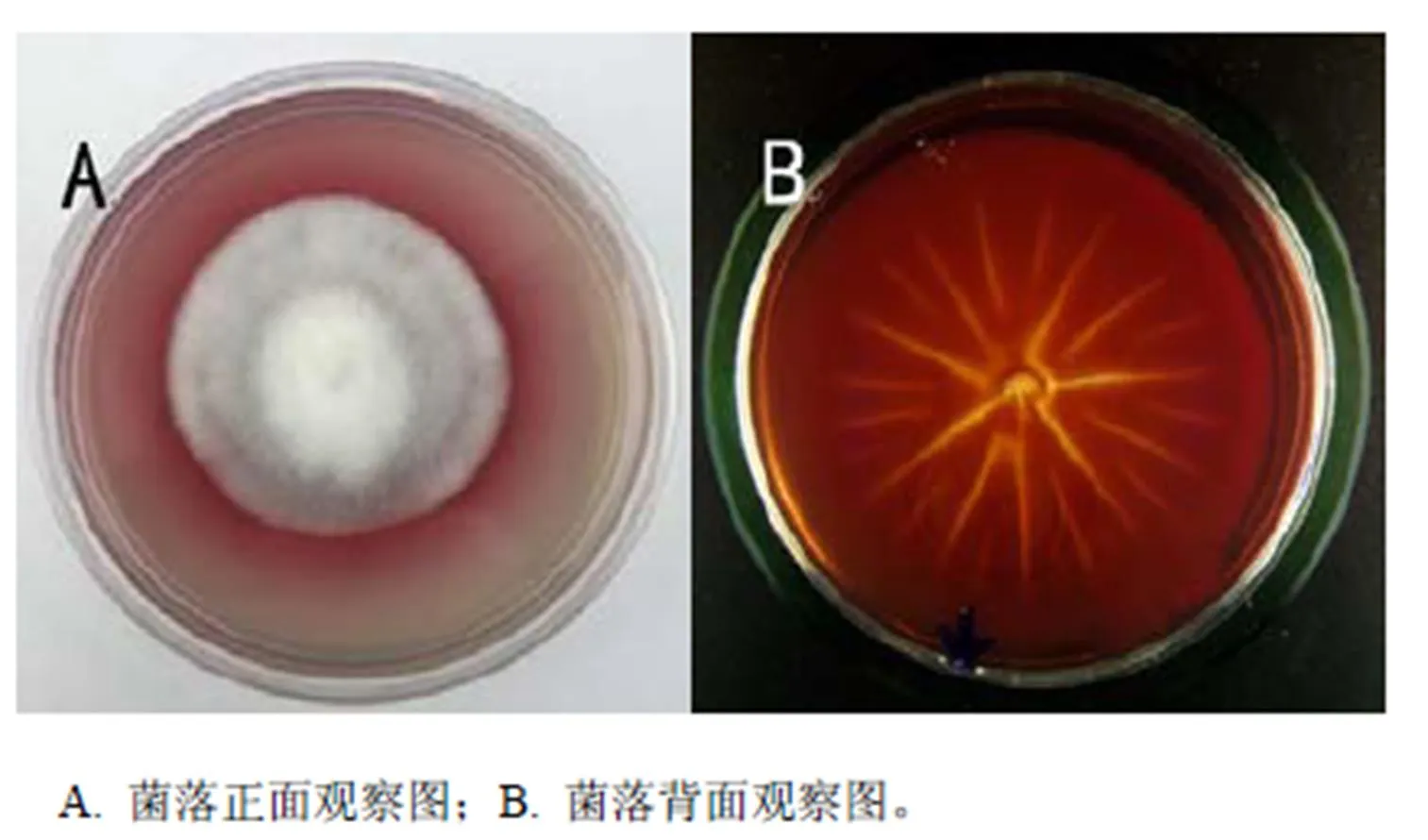
图2 经分离纯化的银耳污染菌(FQ-01)
2.2 显微观察形态特征
电镜下观察,FQ-01菌的孢子梗细胞呈花瓶状,多为对生,瓶梗顶端形成卵圆形或椭圆形分生孢子,大小约为1.8 μm×2.0 μm(图3),且FQ-01菌的菌丝可以侵入银耳子实体内(图4)。
2.3 分子生物学鉴定结果
以提取的FQ-01菌的DNA为模板进行ITS扩增,扩增出的片段结果如图5所示,在分子量600 bp左右得到一条清晰的条带。
分别将测序得到的FQ-01菌ITS序列,利用BLAST软件(Basic Local Aligment Search Tool,Ver2126)与GenBank数据库的已知序列进行同源性比对。软件构建该菌株的系统发育树如图6所示,FQ-01菌与strain Z06的系统发育关系最为亲密,ITS序列的同源性达到99%。

图3 FQ-01菌孢子及孢子梗形态(A:3000×;B:9000×)
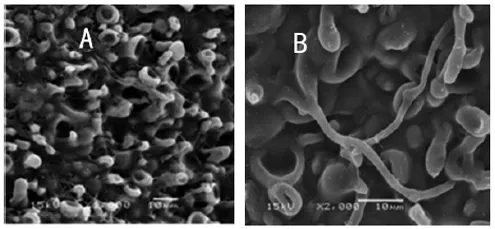
A:正常银耳,1000×;B:染菌银耳,2000×。
根据相关文献对丝枝蜡蚧霉()的主要属的特征描述[5]:分生孢子梗通常着生于气生菌丝上,其一至几个瓶状小梗轮生至对生。这与本文显微观察的生物学特征一致,结合生物学和分子学特征,确定污染菌为丝枝蜡蚧霉()。
2.4 培养特性
(1)碳源。实验结果(图7)显示,FQ-01菌在乳糖培养基上生长速度较快,其次是蔗糖、可溶性淀粉、葡萄糖培养基,为甘油时生长较慢。
不同乳糖浓度培养,FQ-01菌在8%乳糖培养基上生长速度最快,以下依次是6%乳糖、12%乳糖和10%乳糖(图8)。
(2)氮源。实验结果(图9)显示,FQ-01菌在酵母浸粉培养基上生长最快,其次是硝酸钾培养基、蛋白胨培养基、硫酸铵培养基、尿素培养基,均优于未额外添加氮源的对照PDA培养基。
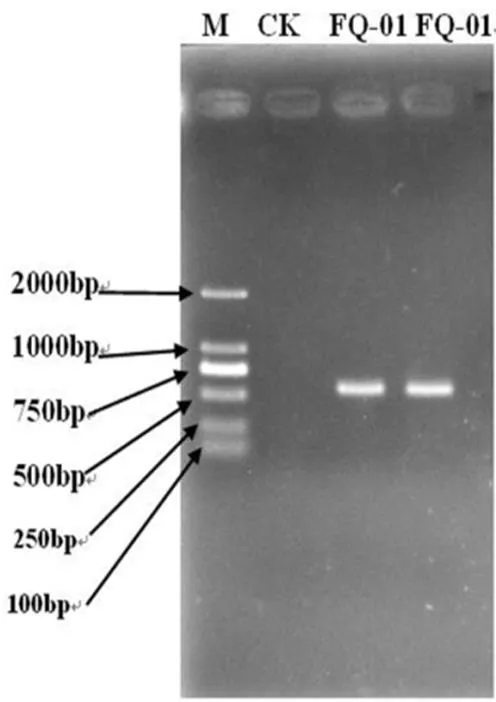
图5 FQ-01菌 ITS序列扩增产物琼脂糖凝胶电泳图
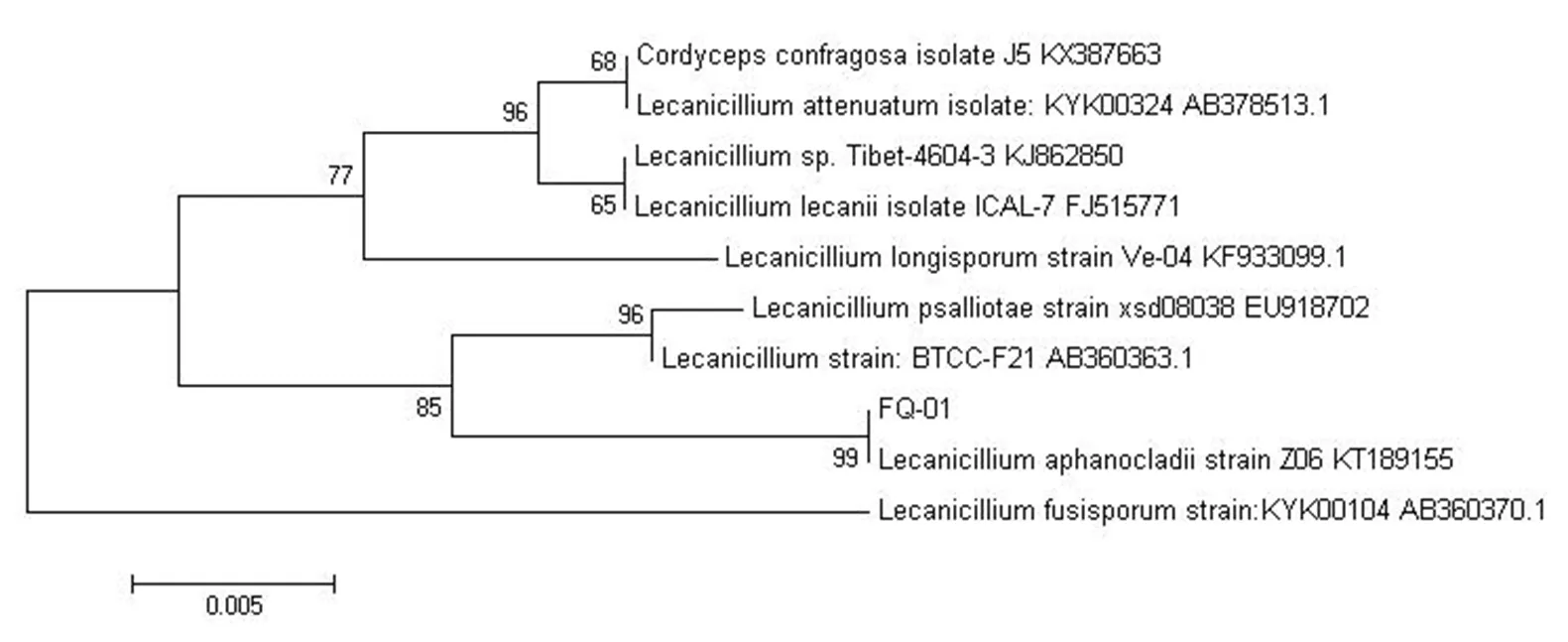
图6 FQ-01菌 ITS系统发育树
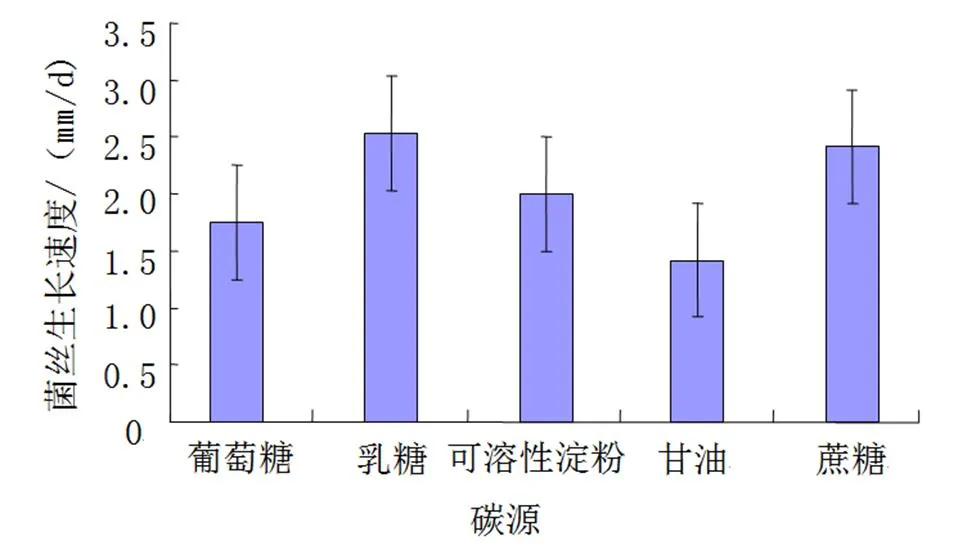
图7 不同碳源培养基FQ-01菌的生长速度
在相同乳糖浓度培养下,FQ-01菌在6%酵母浸粉培养基上生长最快,其次是8%酵母浸粉培养基、12%酵母浸粉培养基、10%酵母浸粉培养基(图10)。
(3)温度。实验结果显示,FQ-01菌菌丝除在36 ℃下停止生长外,其他温度均可生长。28 ℃时菌落生长较快,为2.13 mm/d;其次是25 ℃(图11)。
(4)pH。实验结果显示,pH为8时菌丝生长速度较快,为2.46 mm/d;其次为pH 7、6、5,均优于pH 4的生长速度(图12)。
3 结果与讨论
本研究对一株产红色素银耳污染菌进行分离,参考李永红的研究方法,对该菌进行生物学分类和分子学分类鉴定[6]。
污染菌在电镜下的菌株形态呈现分生孢子着生于单个孢子梗上,孢子呈椭圆形,孢子梗呈花瓶状,梗顶端着生卵圆形或椭圆形分生孢子,产生红色色素,与丝枝蜡蚧霉的特征相似。通过ITS测序进行基因序列比对,与丝枝蜡蚧霉的相似性为99%。综合生物学特征和分子学特征,鉴定该菌为丝枝蜡蚧霉(Lecanicillium aphanocladii)。该菌在以乳糖、酵母浸粉为碳、氮源,pH为8的培养基上,28 ℃培养时菌丝生长速度较快,乳糖、酵母浸粉较适添加量分别为8%和6%。
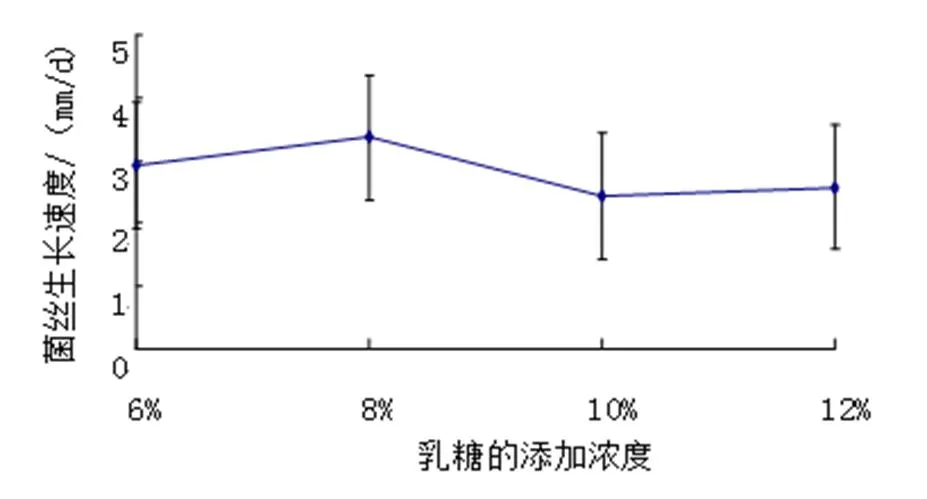
图8 不同乳糖含量培养基FQ-01菌的生长速度
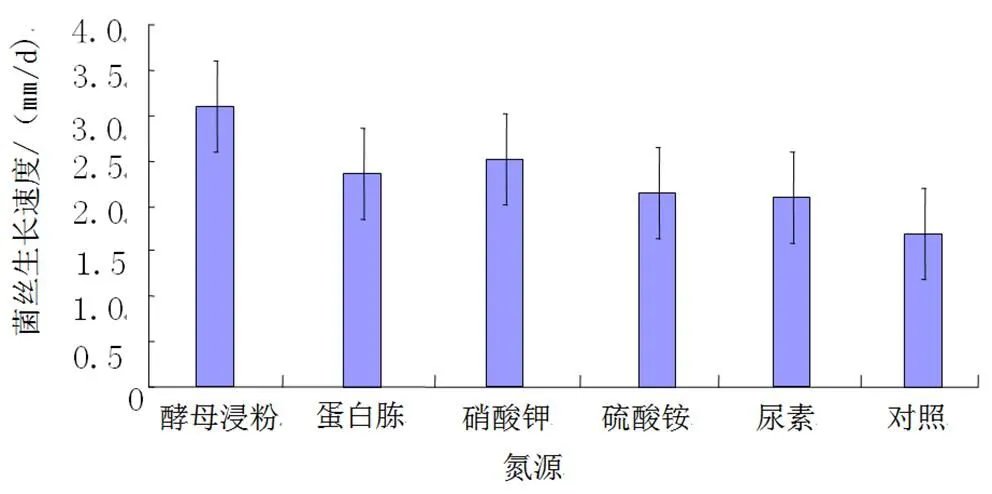
图9 不同氮源培养基FQ-01菌的生长速度
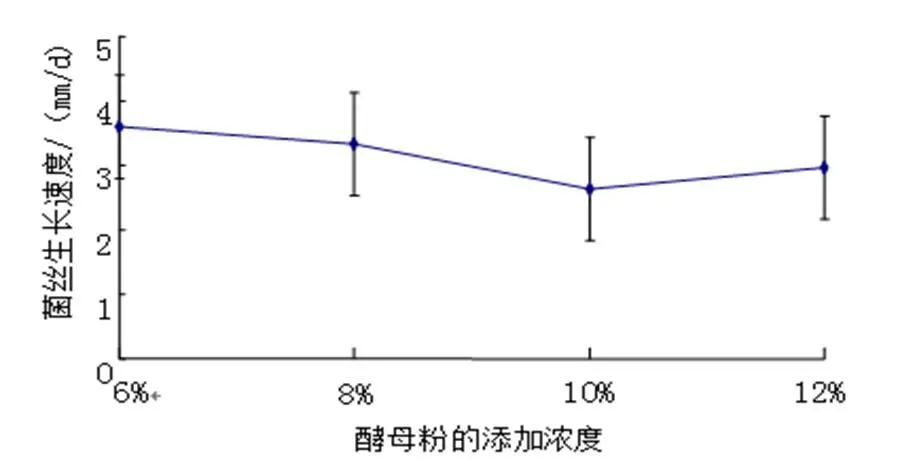
图10 不同浓度酵母浸粉培养基FQ-01菌的生长速度
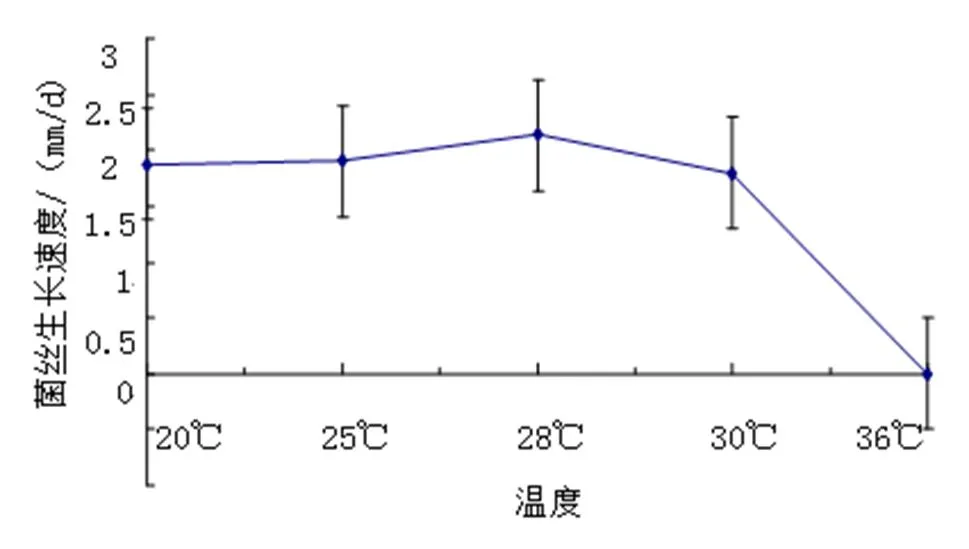
图11 不同温度FQ-01菌的生长速度
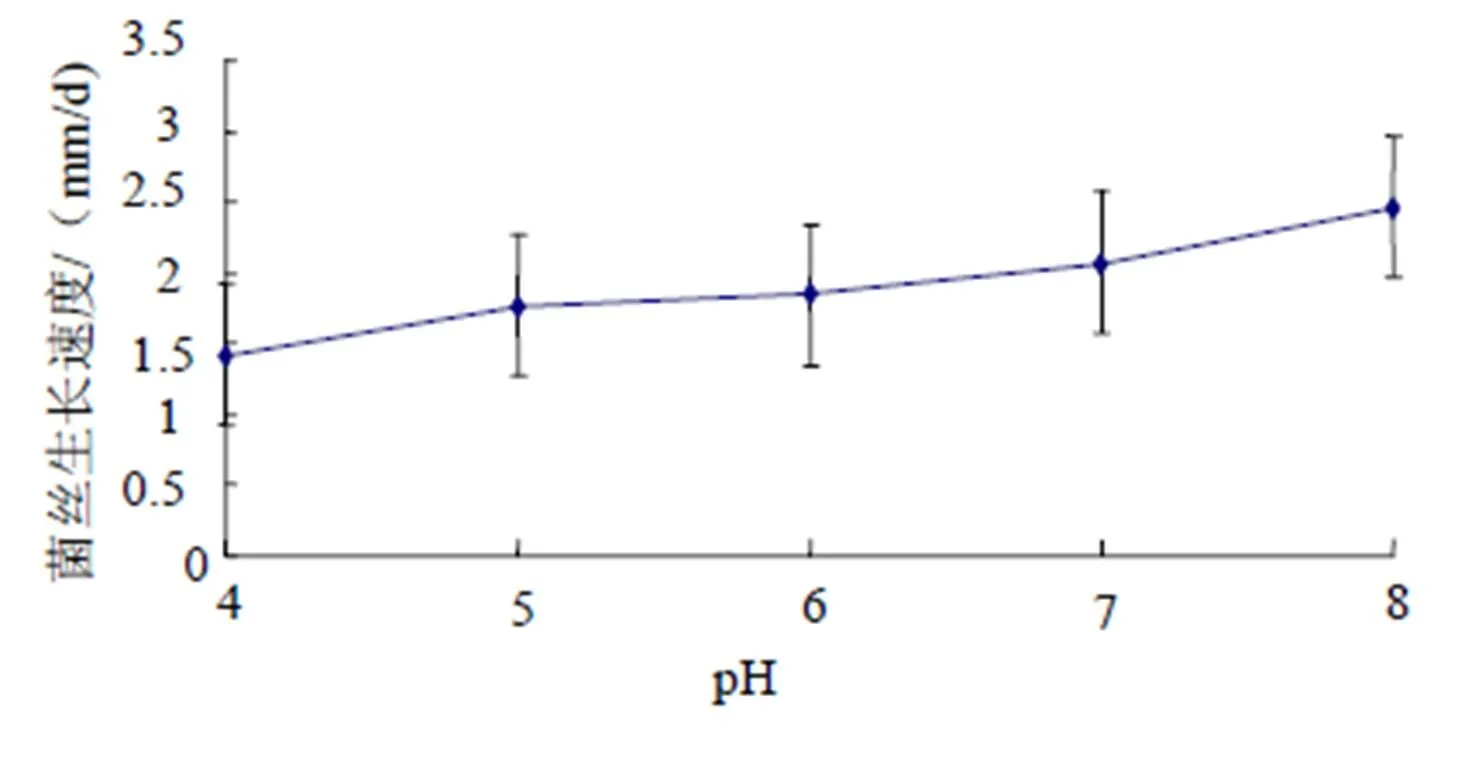
图12 不同pH培养基FQ-01菌的生长速度
蜡蚧霉属隶属于子囊菌门(Ascomycota),肉座菌目(Hypocreales),虫草菌科(Cordycipitaceae)。国内对该属的分类研究报道较少,仅见有名录,未见详细的分类描述及鉴定。谢占玲等对青海湖耐盐真菌调查时曾分离到[6],苘娜娜等从浙江省蚕区的病蚕或病蛹中也曾分离到,和[7]。
真菌能形成化学稳定性高、化学结构及色调多样的色素。例如能合成和分泌各种醌类、酸类、酮类以及一些含氮化合物色素[8]。目前,已获得高产色素的主要真菌类群有红曲霉、青霉、拟青霉和虫草[9]中的一些种。其中,一些不产毒素的青霉,如产紫青霉(Fleroff)等研究报道较多[10, 11]。Gunasekaran & Poorniammal报道了一个产蒽醌类红色素的青霉新菌株[12],此菌产生的色素可用于食品和化妆品,通过优化培养条件,红色素的产量可提高7倍。本研究鉴定的产红色素的丝枝蜡蚧霉菌株,可为天然红色素在食品和化妆品等领域的应用提供新资源。
[1] 苏春丽. 中国栽培灵芝菌株的遗传多样性研究及分子鉴定[D]. 南京农业大学, 2006.
[2] White T J, Bruns T, Tee S, et al. Application and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A]. In: Innis M A, Gelfand D H, Sninsky J J, et al. PCR Protocols: A Guid to Methods and Applification San Diego[C]. Academic Press Inc, 1990:315-322.
[3] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[4] HL巴尼特, BB亨特. 半知菌属图解[M]. 北京: 科学出版社, 1977.
[5] 董旋, 曾桂萍, 陈万浩, 等. 一株产红色素的丝枝蜡蚧霉新菌株[J]. 山地农业生物学报, 2016, 35(3): 91-94.
[6] 谢占玲, 王欢, 赵朋, 等. 分离自青海湖可培养耐盐真菌的多样性研究[J]. 菌物学报, 2012, 31(2): 187-195.
[7] 苘娜娜, 马焕燕, 鲁华云, 等. 不同分子类型家蚕病原性白僵菌的分离及致病性试验[J]. 中国蚕叶, 2015, 36(3)z: 32-37.
[8] PASTER RMA, RODRIGUSE-FILHOE, SOUZA AQL, et al. Diversity of polyketides produced by Penicillium species isolated from Media azedarach and Murraya- paniculata[J]. Quim Nova, 2007, 30(8): 1867-1871.
[9] 韩燕峰, 梁建东, 梁宗琦, 等. 培养基成份对双梭孢虫草色素形成的影响[J]. 贵州农业科学, 2011, 39(11): 95-98.
[10] 张馨, 曹红, 李春, 等. 产紫青霉菌的发酵条件及色素稳定性、安全性的研究[J]. 中国食品添加剂, 2016, 68(2): 68-74.
[11] 刘维, 阮璐雅, 管成林, 等. 一株铁皮石斛内生真菌H1B1产红色素稳定性的研究[J]. 中国食品添加剂, 2016, 68(1): 71-75.
[12] GUNASEKARANS,POORNIAMMAL r. Optimization of fermentation conditions for red pigment production fromPenicillium sp. under submerged cultivation[J]. African Journal of Biotechnology, 2008, 7(12): 1894-1898.
Isolation and identification of a funguspathogen ofand its growth conditions
Qiu Xibin1, 2
(1. Fujian Inspection and Research Institute for Product Quality, National Center for Quality Supervision and Inspection for Processed Food, Fuzhou 350002, China; 2. Fujian Agriculture and Forestry University, College of Food Science, Fuzhou 350002, China)
A kind of fungus pathogen producing red pigment was found on fruit body surface of. The pathogen was identified by morphological and molecular classification as. The experimental results showed that the mycelial growth speed was the fastest when the pH was 8.0 at 28 ℃. The optimal carbon source and nitrogen source for the strain was 8% lactose and 6% yeast extract powder.
; identifition; molecular characterization; growing conditions
S646
B
2095-0934(2018)04-240-05
