Dis-SPE-UPLC-MS/MS测定卷烟主流烟气中4种TSNAs
2018-09-05陶晓秋韶济民张海燕
熊 巍,陶晓秋,韶济民,张海燕
Dis-SPE-UPLC-MS/MS测定卷烟主流烟气中4种TSNAs
熊 巍,陶晓秋*,韶济民,张海燕
(四川省烟草质量监督检测站,成都 610041)
烟草特有N-亚硝胺(TSNAs)是卷烟烟气中重要的致癌成分,为准确测定卷烟主流烟气中的TSNAs释放量,建立了UPLC-MS/MS同时测定卷烟主流烟气中4种TSNAs的检测方法。采用剑桥滤片捕集卷烟主流烟气,经醋酸铵水溶液提取,N-丙基乙二胺(PSA)净化后UPLC-MS/MS测定。结果显示,TSNAs的工作曲线在1~110 ng/mL之间线性关系良好(2>0.99),检出限(LOD,以/=3计)0.008~0.016 ng/mL;回收率82.5%~94.8%,精密度4.9%~9.8%。该方法与标准方法进行比对效果良好,相关系数的范围为0.9991~0.9995。该方法准确可靠、选择性好,适合于烤烟型卷烟主流烟气中TSNAs释放量的检测。
高效液相色谱-串联质谱;主流烟气;烟草特有亚硝胺;烤烟
烟草特有亚硝胺(Tobacco-Specific Nitrosamines,TSNAs)是一类仅存在于烟草及烟气中的致癌或潜在致癌物质[1]。最为常见的TSNAs有4种[2-3],分别为:4-(甲基亚硝胺基)-1-(3-吡啶基)-1-丁酮[4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone, NNK]、亚硝基新烟草碱(N-nitrosoanatabine, NAT)、亚硝基降烟碱(N-nitrosonornicotine, NNN)和(N-nitrosoanabasine, NAB)。由于TSNAs具有致癌性,吸入TSNAs可能会对吸烟者产生健康风险。而准确测定烟气中TSNAs的释放量有助于更好地评定烟气中TSNAs对吸烟者的健康风险。
烟草及卷烟烟气中的TSNAs测定一直是烟草化学分析领域的研究热点,前期有较多报道采用GC-TEA和色谱质谱法测定烟草和卷烟烟气中的TSNAs[4]。目前,报道较多的TSNAs检测方法主要基于HPLC-MS/MS法[5-8]。
TSNAs的提取过程因方法不同而不同,主要包括水相柠檬酸缓冲液萃取法[9-10]、碱性水相萃取法[11]、超临界萃取法[12]、固相微萃取法[13]和水相乙酸铵缓冲液萃取法[14]。萃取液中TSNAs的净化方法主要有液液萃取、固相萃取和分子印迹固相萃取[2,8]。而醋酸水溶液萃取滤片中的TSNAs后直接进LC-MS/MS检测是目前主流的检测方式[7],本研究也建立了相应的RRLC-MS/MS测定中式卷烟主流烟气中TSNAs的检测方法[15],并应用此方法评价了不同抽吸模式下主流烟气中TSNAs的释放量。建立的方法虽然能够准确测定大部分卷烟中TSNAs,但是对于中式烤烟型卷烟中含量较低的NAB的测定存在较大的困难,主要源于烟气的基质非常复杂,不通过净化过程会使得NAB的基质干扰大,且会掩盖目标峰。
基于此,本文选取了分离度更好的UPLC,针对中式烤烟型卷烟,建立了UPLC-MS/MS同时测定卷烟主流烟气中4种TSNAs,与传统的LC-MS/MS方法相比,选取了分散固相萃取(Dis-SPE)方法快速处理样品,节省溶剂和时间的同时,显著降低了中式烤烟型卷烟烟气的基质干扰,提高方法检测的准确度。
1 材料与方法
1.1 仪器与试剂
甲酸、乙酸铵(HPLC级,浓度49%~51%,德国Sigma公司);乙腈、甲醇(色谱纯,美国ThermoFisher公司);(NNN、NNK、NAT、NAB、NNN-d4、NNK-d4、NAT-d4和NAB-d4(纯度98.5%)购自加拿大Toronto Research Chemicals公司;N–丙基乙二胺(PSA)吸附剂(美国Agilent公司);水为超纯水;2种烤烟型卷烟和2种混合型卷烟由国家烟草质量监督检验中心提供。
伯瓦特转盘型吸烟机(200A,德国伯瓦特公司);超高效液相色谱–串联质谱仪(Xevo TQ,美国Waters公司);TSNAs涡旋振荡器(VtexMixer 230VeU,美国Labnet公司);高速离心机(Sigma 3K15,德国Sigma公司);电子分析天平(AE200,感量:0.0001 g,瑞士Mettler Toledo公司);超纯水仪(Cascada ANMK2,美国Pall公司);有机相针式滤器(0.22 μm,上海安谱科学仪器有限公司);单孔道移液枪(20~200 μL,德国Eppendorf公司)、电动分液器(配1 mL、5 mL枪头,德国Eppendorf公司)。
1.2 标准工作液的配制
储备液及工作液的配制:用甲醇准确配制单一TSNAs标准储备液,配制的浓度分别为NNN:1 mg/mL,NNK:2.35 mg/mL,NAT:1 mg/mL和NAB:0.5 mg/mL,单一标准储备液储存于棕色储液瓶中,−20 ℃保存。准确移取各单一标准储备液于同一25 mL棕色容量瓶,用甲醇定容混合后得混合TSNAs标准工作溶液(TSNAs浓度:1 µg/mL)。
氘代内标储备液配制:用甲醇配制单一TSNAs-d4内标储备液,配制浓度分别为NNN-d4:1 mg/mL,NAT-d4:1 mg/mL,NAB-d4:1 mg/mL和NNK-d4:2.5 mg/mL,储存于棕色储液瓶中,−20 ℃保存。准确移取一定量的各内标储备液于同一25 mL棕色容量瓶,用甲醇定容配成混合氘代内标工作溶液(TSNAs-d4:1 µg/mL)。
1.3 LC-MS/MS条件
质谱条件:离子源,电喷雾电离源(ESI);扫描方式,正离子扫描;检测方式,多反应监测模式(MRM);电喷雾电压(IS),3.0 kV;雾化气流量,800 L/Hr;锥孔气(cone)流量,50 L/Hr;离子源温度,500 ℃;碰撞气,氩气,0.15 mL/min;驻留时间,30 ms。监测离子对及其相应的碰撞能量(CE)见表1。
色谱条件:色谱柱,Waters ACQUITY UPLC BEH C18(2.1 mm×200 mm,1.7 μm);流动相A,0.1%(体积分数)甲酸水溶液;流动相B,甲醇;流速0.6 mL/min;柱温35 ℃;进样量5 µL。洗脱梯度:0~0.5 min,80% A;0.5~1.0 min,80% A~10% A;1.0~2.9 min,10% A;2.9~3.5 min,10% A~80% A;3.51~5.0 min,80% A。

表 1 多反应监测模式监测4种烟草特有亚硝胺及其氘代内标的部分质谱参数
注:*表示定量离子对。Note: *, quantification ion pairs.
1.4 样品处理与分析
按照GB/T 16447—2004平衡烟支[16],ISO标准抽吸模式(ISO 3308:2000/GB/T 19609—2004)捕集主流烟气粒相物[17],每个滤片抽吸5支烟。取捕集过卷烟主流烟气的滤片,放入50 mL具塞离心管,加入15 mL 100 mmol/L醋酸铵萃取液,并加入150 μL 1 μg/mL混合氘代内标,在2000 r/min的条件下涡旋振荡5 min,取1 mL上清液于2 mL旋盖离心管中,加入25 mg PSA,在2000 r/min的条件下涡旋振荡2 min,在6000 r/min的条件下离心4 min。上清液过0.22 μm有机相滤膜,取5 μL滤液引入LC-MS/MS分离分析。
2 结果与讨论
2.1 LC-MS/MS条件
前期我们已建立过LC-MS/MS法测定卷烟主流烟气中的4种TSNAs,根据前期的研究显示TSNAs中带有电负性较强的氮原子,宜选用正离子模式[8]。氘代内标的使用可以部分抵消基质效应对TSNAs的干扰,主要源于同位素内标与分析物是同一成分,在同一保留时间出峰,从而能够与分析物保持较好的基质抑制或促进作用,从而部分抵消基质效应对分析带来的干扰。从这个原理也可以看出,同位素内标的使用没有从本质上降低样品基质对分析物的干扰,如要从根本上减少复杂基质带来的干扰还需要进行样品净化(表1)。
前期的研究中我们选取了不同的流动相体系对TSNAs的分离过程进行了相关优化,加入乙酸确实可以显著提高电喷雾过程中TSNAs的离子化效率,但是在后期的研究中发现流动相中乙酸的加入容易与烟气基质中的部分碱性成分生成盐,从而干扰检测过程。在本实验中我们选取了甲酸,主要基于甲酸能够为TSNAs离子化提供质子,提高其离子化效率的同时不太容易生成难溶的盐类(图1)。

图 1 标准溶液中4种亚硝胺(20 ng/mL)及其内标混合溶液(10 ng/mL)的多反应监测色谱图
2.2 前处理条件的优化
2.2.1 不同前处理方法的比较 选取一种烤烟型卷烟样品,捕集卷烟主流烟气后,分别采用回旋振荡法、涡旋振荡法和超声萃取法来提取卷烟主流烟气中的TSNAs。结果显示:回旋振荡法的振荡频率较低,提取溶液的使用量相对较大,对未没入萃取液中的样品提取困难。超声萃取法的萃取效率较高,但萃取过程会导致水温上升,在100%的超声效率下,水温会从22 ℃上升至39 ℃,这可能会导致分析物在水溶液中降解,尤其会降低氘代内标的质谱响应。涡旋振荡法的萃取效率高,萃取过程充分,萃取所需的时间短。
2.2.2 Dis-SPE净化条件优化 若不选取净化过程,直接进样分析,对于TSNAs含量低的烤烟型卷烟,尤其是NAB的检测准确度差。这是因为烤烟中NAB含量在5 ng/cig以下,且烤烟烟气中基质非常复杂,从而使得NAB在出峰位置基质干扰严重。如果选取普通的固相萃取或液液萃取方式,萃取过程较为繁琐,溶剂的消耗量大,萃取时间较长。如果选取基质分散固相萃取,能够在较短的时间内达到净化样品的结果,无需消耗有机溶剂。
亚硝胺为极性化合物,更易溶于水或者极性溶剂,应该选取反相吸附剂来吸附杂质。市售预填试剂包中含有硫酸镁,在质谱检测过程中可能会造成离子抑制作用。进一步比较了PSA、C18、GCB和PSA+C18的萃取效果,结果显示单独使用PSA作为萃取剂净化效果更好,回收率更高(图2)。
2.3 线性关系和检出限
准确移取10、20、50、100、200,500和1000 µL二级标准溶液(NNN、NAB、NAT为1.0 µg/mL,NNK为1.1 µg/mL)于7个10 mL容量瓶中,再在每个容量瓶中加入100 µL内标混合液(1.0 µg/mL),最后用0.1 mol/L的乙酸铵水溶液定容、摇匀,得一系列标准溶液。表2示出,TSNAs的线性范围是1.0~100 ng/mL,此方法中各TSNA的相关系数(值)在0.9991到0.9995,NNN、NNK、NAT和NAB的检测限分别是0.008、0.016、0.011和0.010 ng/mL。
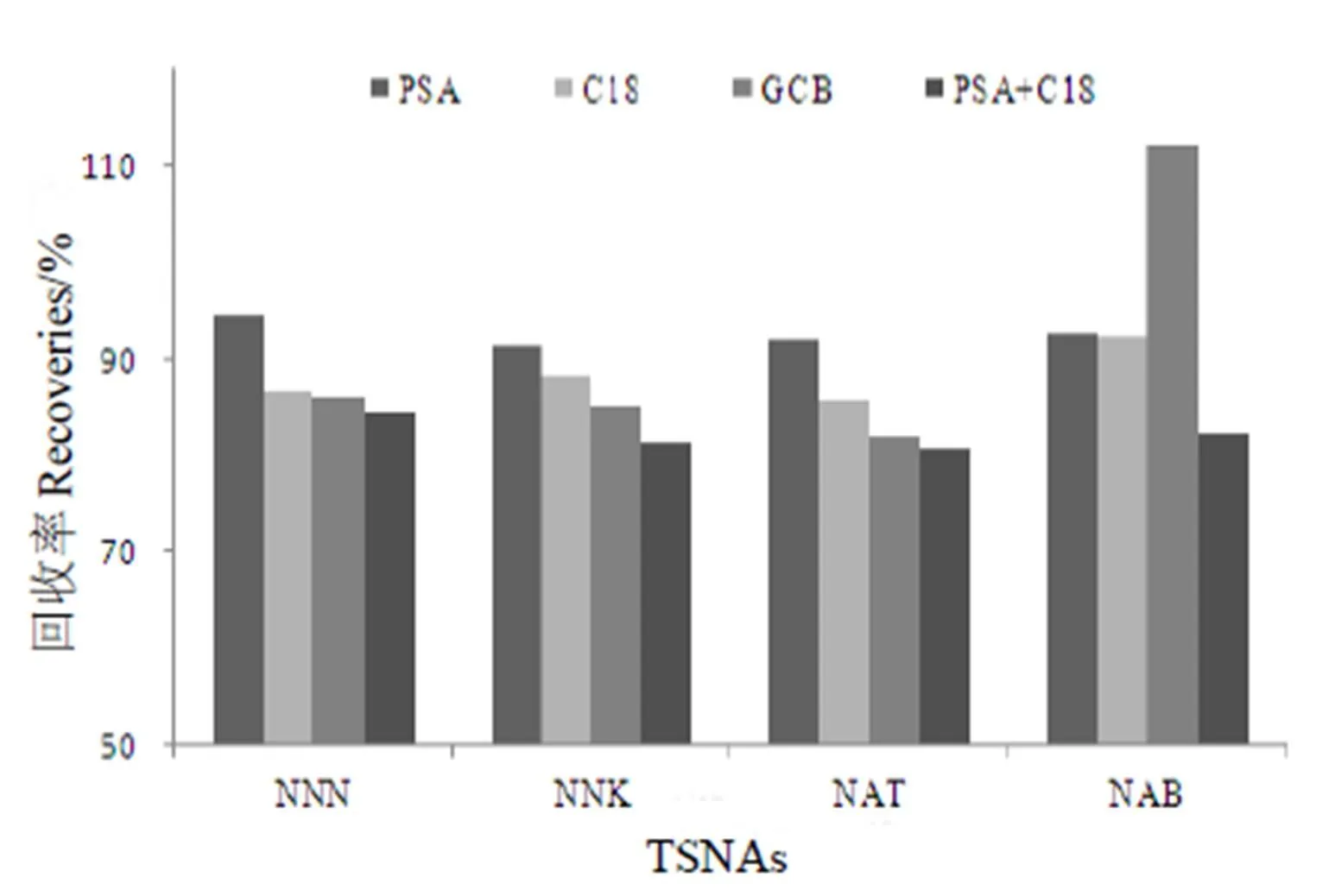
图2 不同萃取剂处理得到的4种亚硝胺的回收率
2.4 回收率和精密度
在主流烟气样品萃取过程中添加一定量的TSNAs标准溶液,然后提取、测定,计算回收率。本实验选用高、中、低3种不同浓度的加标回收实验来考察方法的准确度,表3表明,除了较低含量的NAB在加入量为2.0 ng时的回收率为82.5%之外,其他点的回收率都在90%~95%,对同一样品平行测定5次,4种化合物回收率的相对标准偏差RSD范围为4.9%~9.8%。
2.5 本方法与传统振荡萃取方法的比较
传统的LC-MS/MS测定主流烟气的TSNAs主要是选取回旋振荡或者超声萃取30 min,我们选取了4个样品,2个烤烟型样品,2个混合型样品,盒标焦油量范围为3~11 mg,分别用传统的振荡萃取方法和涡旋振荡基质分散固相萃取方法进行比对,每个样品测定4个平行,回归分析显示(表4),两种方法的NNN,NNK,NAB和NAT相关系数分别为0.983,0.930,0.835和0.996,4个指标都显著相关(<0.001)。两种方法的相关性分析的结果见表5。振荡萃取-测定LC-MS/MS测定1号烤烟型卷烟主流烟气中TSNAs的选择离子流色谱图如图1所示,同一样品中采用本方法处理测定主流烟气的TSNAs的选择离子流色谱图如图3所示,从图中可以看出,本实验由于加入简单的净化步骤后,目标分析物的响应增强,干扰物明显降低。
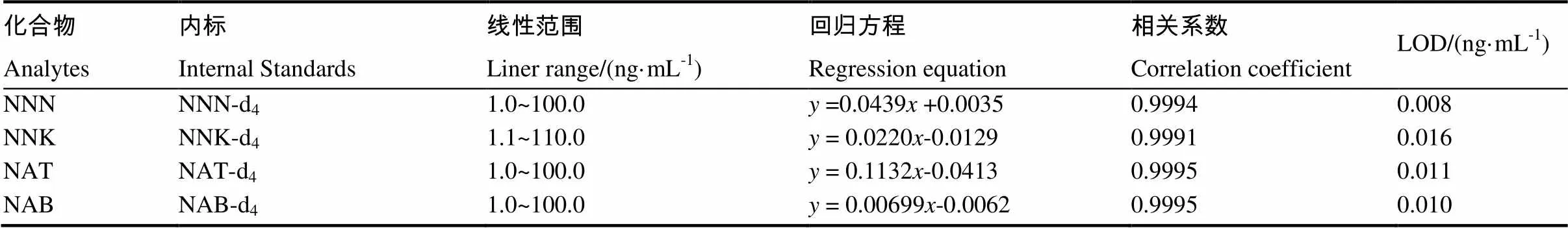
表 2 TSNAs的回归方程、相关系数和检出限
注::分析物与内标峰面积的比值;:浓度, ng/mL。Note:, the ratio of peak areas between those of analytes and surrogate;, mass concentration, ng/mL.

表3 TSNAs在剑桥滤片上的回收率
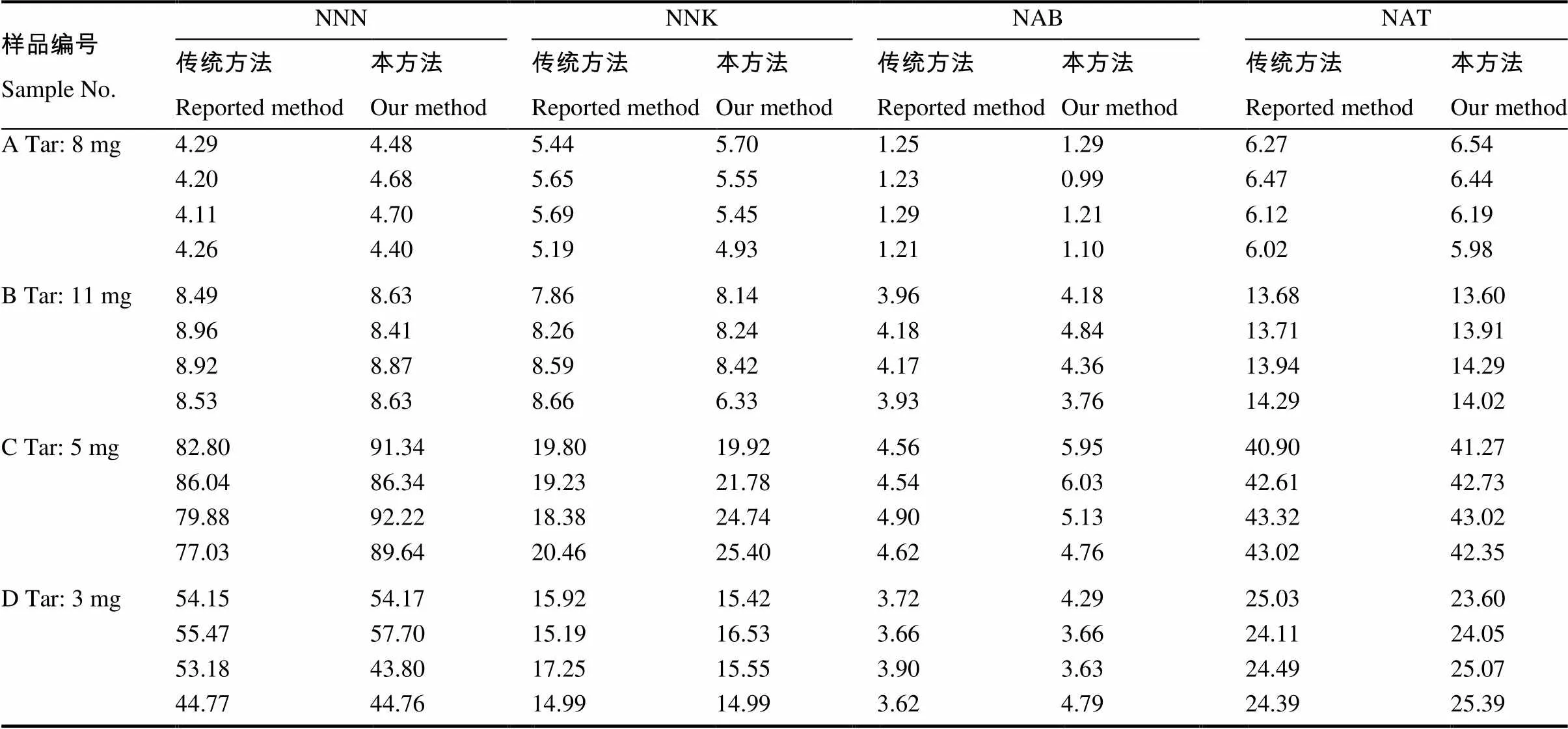
表4 本方法与传统LC-MS/MS方法检测结果比较 ng/支
注:A、B为烤烟型卷烟,C、D为混合型卷烟。Note: Sample A and B are Virginia type cigarettes and sample C and D are blend cigarettes.

表5 本实验方法和振荡萃取-LC-MS/MS方法测定数据的回归分析
3 结 论
在烟气等复杂体系TSNAs的LC/MS/MS测定中,基质效应对电喷雾离子源的喷雾效率和均匀性影响严重,已经成为瓶颈问题之一。为解决这一问题,本文选取了Dis-SPE的方法净化烟气样品,减少基质干扰,并选取一一对应的氘代内标来进一步抵消基质效应。建立的检测方法能够快速、准确地测定卷烟主流烟气中4种TSNAs。该方法选取Dis-SPE的方法净化烟气萃取液,在不过多增加前处理步骤的前提下有效的净化复杂的烟气基质,能够实现烟气中4种TSNAs的准确测定,适合于烤烟型卷烟中低含量的TSNAs的分析。
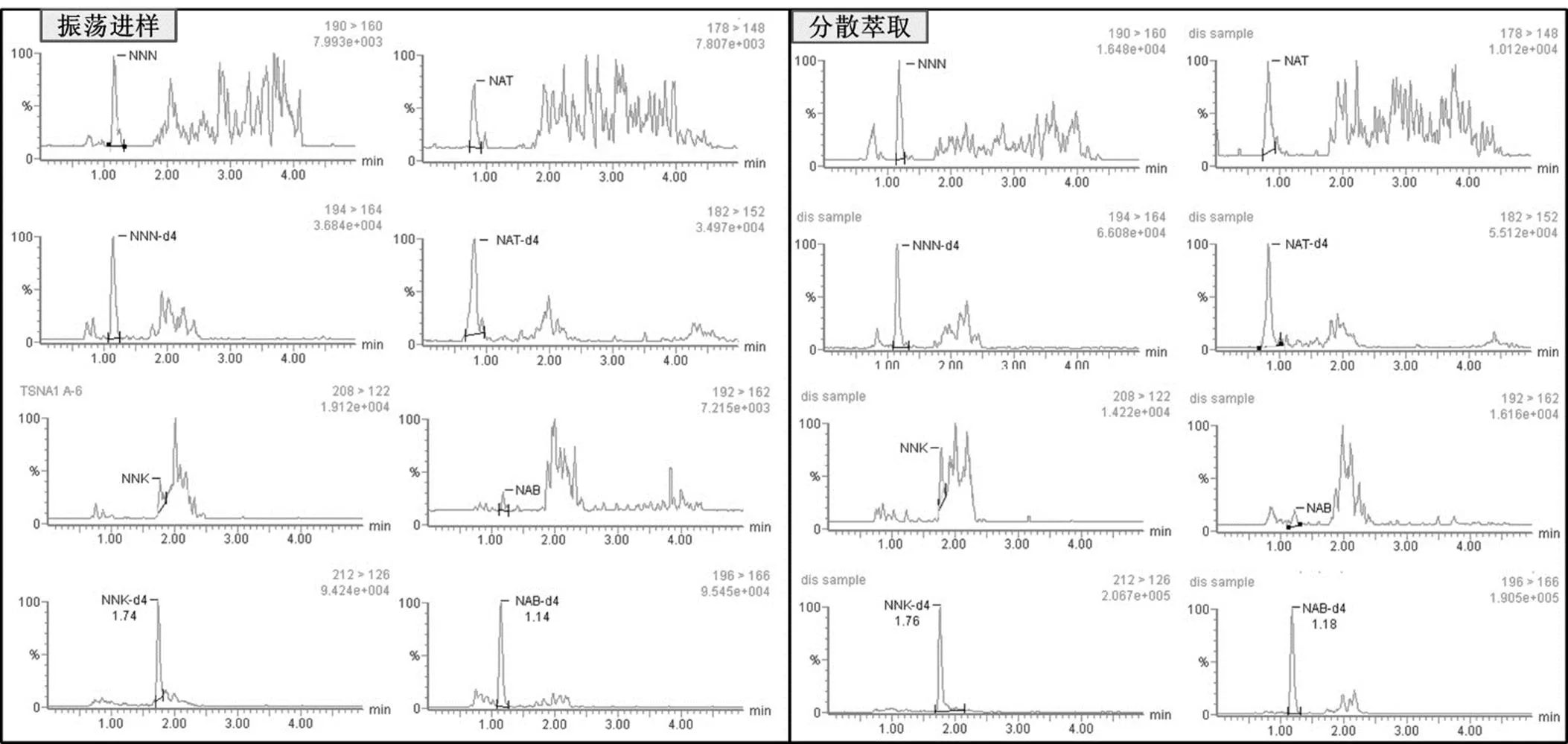
图 3 同一烤烟样品振荡萃取和分散固相萃取后TSNAs及其氘代内标的多反应监测色谱图
[1] International Agency for Research on Cancer. Smokeless tobacco and some tobacco-specific N-Nitrosamines, monographs on the evaluation of carcinogenic risks to humans[J]. World Health Organization International Agency for Research on Cancer, 2007, 427. http://dosei.who.int/uhtbin/cgisirsi/LoP3zdh6lY/153220041/5/0.
[2] 熊巍,侯宏卫,唐纲岭,等. 烟草特有N-亚硝胺检测方法研究进展[J]. 环境与健康杂志,2013,30(8):749-752.
XIONG W, HOU H W, TANG G L, et al. Analysis of tobacco-specific nitrosamines in cigarettes smoke: a review of recent studies[J]. Journal of Environment & Health, 2013, 30(8): 749-752.
[3] 李宗平,覃光炯,陈茂胜,等. 不同栽培方式对白肋烟烟碱转化率及TSNA含量的影响[J]. 中国烟草科学,2015,36(6):62-67.
LI Z P, QIN G j, CHEN M S, et al. Influence of different cultivation methods on nicotine conversion and TSNA content of burley tobacco[J]. Chinese Tobacco Science,2015,36(6):62-67.
[4] 顾文博,周宛虹,陆怡峰,等. 气相色谱-三重四极杆串联质谱法测定卷烟烟气中的烟草特有亚硝胺[J]. 烟草科技,2013(10):40-43,48.
GU W B, ZHOU W H, LU Y F, et al. Determination of tobacco-specific nitrosamines in mainstream cigarette smoke by gas chromatography-triple quadrupole tandem mass spectrometry[J].Tobacco Science & Technology,2013(10): 40-43, 48.
[5] 毛友安,钟科军,魏万之,等. LC/MS/MS法同时测定卷烟主流烟气中4种TSNAs[J]. 化学研究与应用,2005,17(4):571-573.
MAO Y A, Zhong K J, WEI W Z, et al, Simultaneous determination of four tobacco-specific nitrosamines in cigarette mainstream smoke by LC/MS/MS[J]. Chem Res Appl, 2005, 17(4): 571-573.
[6] 万文亚,周宛虹,张怡春,等. LC-MS-MS法测定卷烟侧流烟气中的亚硝胺[J]. 分析试验室,2012,31(4):69-72.
WANG W Y, ZHOU W H, ZHANG Y C, et al. Determination of tobacco-specific nitrosamines in cigarette side stream smoke by LC-MS-MS [J]. Chinese Journal of Analysis Laboratory,2012,31(4):69-72.
[7] 陈霞,金立锋,刘萍萍,等. UPLC-MS/MS法同时测定烟叶中的TSNAs[J]. 烟草科技,2016(3):62-67.
CHEN X, JIN L F, LIU P P, et al. Simultaneous determination of four tobacco-specific N-nitrosamines by liquid chromatography-tandem mass spectrometry[J]. Tobacco Science & Technology, 2016, 49(3): 62-67.
[8] 朱文静,杨俊,刘百战,等. UPLC-MS/MS对卷烟烟气中4种烟草特有亚硝胺的快速测定[J]. 分析测试学报,2010,29(1):26-30.
ZHU W J, YANG J, LIU B Z, et al. Rapid determination of 4 tobacco-specific N-nitrosamines by Ultra Performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2010, 29(1): 26-30.
[9] ADAMS J D, BRUNNEMANN K D, HOFFMANN D. Chemical studies on tobacco smoke: LXXV. Rapid method for the analysis of tobacco-specific N-nitrosamines by gas-liquid chromatography with a thermal energy analyser[J]. Journal of Chromatography A, 1983, 256(2): 347-351.
[10] 赵明月,谢复炜,王昇,等. 毛细管气相色谱法测定烟草中的亚硝胺[J]. 中国烟草学报,2000,6(3):1-6.
ZHAO M Y, XIE F W, WANG S, et al. Determination of N-Nitrosamines in tobacco by capillary gas chromatography [J]. Acta Tabacaria Sinica, 2000, 6(3): 1-6.
[11] SPIEGELHALDER B, KUBACKI S J, FISCHER S. A method for the determination of tobacco-specific nitrosamines(TSNA), nitrate and nitrite in tobacco leaves and processed tobacco[J]. Beiträge Zur Tabakforschung, 1989, 14(3): 135-144.
[12] SONG S, ASHLEY D L. Supercritical fluid extraction and gas chromatography/mass spectrometry for the analysis of tobacco-specific nitrosamines in cigarettes[J]. Analytical Chemistry, 1999, 71(7): 1303-1308.
[13] SHAH K A, HALQUIST M S, KARNES H T. A modified method for the determination of tobacco specific nitrosamine 4-(methylnitrosamino)-1-(3-pyridyl) -1-butanol in human urine by solid phase extraction using a molecularly imprinted polymer and liquid chromatography tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877(14-15): 1575-1582.
[14] WAGNER K A, FINKEL N H, FOSSETT J E, et al. Development of a quantitative method for the analysis of tobacco-specific nitrosamines in mainstream cigarette smoke using isotope dilution liquid chromatography/ electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 2005, 77(4): 1001-1006.
[15] XIONG W, HOU H, JIANG X, et al. Simultaneous determination of four tobacco-specific N-nitrosamines in mainstream smoke for Chinese Virginia cigarettes by liquid chromatography–tandem mass spectrometry and validation under ISO and “Canadian intense” machine smoking regimes[J]. Analytica Chimica Acta, 2010, 674(1): 71-78.
[16] 中国烟草标准化研究中心. 烟草及烟草制品调节和测试的大气环境GB/T 16447—2004[S]. 北京:中国标准出版社,2004.
China Tobacco Standardization Research Center. Tobacco and tobacco products-atmosphere for conditioning and testing GB/T 16447—2004[S]. Beijing: Standards Press of China, 2004.
[17] 国家烟草质量监督检验中心. 卷烟用常规分析用吸烟机测定总粒相物和焦油GB/T 19609—2004[S]. 北京:中国标准出版社,2005.
China National Tobacco Quality Supervision & Test Center. Cigarette-Determination of total and nicotine-free dry particulate matter using a routine analytical smoking machine GB/T 19609—2004[S]. Bei jing: Standards Press of China, 2005.
Determination of Four Tobacco-specific N-nitrosamines in Tobacco Mainstream Smoke by Dispersive Solid Phase Extraction-UPLC-MS/MS
XIONG Wei, TAO Xiaoqiu*, SHAO Jimin, ZHANG Haiyan
(Sichuan Tobacco Quality Supervision and Testing Station, Chengdu 640041, China)
Tobacco-specific nitrosamines (TSNAs) are very important carcinogens in tobacco and cigarette smoke. In order to develop a robust analytical method to determine low levels of TSNAs in cigarette smoke, a dispersive solid phase extraction-UPLC-MS/MS method was used to simultaneously determine four TSNAs in mainstream cigarette smoke. Mainstream smoke was collected on a cambridge filter pad, further extracted with ammonium acetate aqueous solution, then cleaned up by primary secondary amine (PSA), and subsequently analyzed with UPLC-MS/MS. The proposed method displayed limit of detections between 0.008 and 0.016 ng/mL and good linearity over the range from 1 to 110 ng/mL, with a2>0.99. Recovery varied from 82.5% to 94.8% for Chinese Virginia cigarettes. Mean precisions ranged from 4.9%-9.8%. The proposed method, which provides higher sensitivity and specificity, is suitable for quantitatively analyzing TSNAs yield in Chinese Virginia cigarettes.
liquid chromatography-tandem mass spectrometry; tobacco-specific N-nitrosamines; mainstream cigarette smoke; virginia cigarettes
TS41+1
1007-5119(2018)04-0087-07
10.13496/j.issn.1007-5119.2018.04.012
四川省烟草专卖局(公司)科技计划项目“基于QuEChERS技术的卷烟烟气成分高通量检测方法研究”(SCYC201709)
熊 巍(1985-),男,工程师,博士,主要从事烟草、土壤化学分析工作。E-mail:xiongwei199@aliyun.com
2018-03-20
2018-06-13
,E-mail:txq@sctobacco.com.cn
