激活型人源化抗人CD137单克隆抗体的研制与生物学活性鉴定
2018-09-05王华菁徐依云杨焕凤
何 妍,王华菁,陆 婷,徐依云,黄 勇,杨焕凤
CD137(CD137/TNFRSF9)可能是第一个被确定为免疫治疗靶标的TNFRSF成员[1-2]。 CD137由调节性T细胞(Treg)和几种先天免疫细胞群体组成型表达[3], CD137抗体通过三聚体连接人肿瘤坏死因子受体相关因子1(TRAF1)和人肿瘤坏死因子受体相关因子2(TRAF2),调节免疫细胞功能通路NF-κB的活化[4],能诱导干扰素-γ(IFN-γ)和白介素2的增殖和产生,并通过上调抗细胞凋亡途径(包括Bcl-xL)来增强细胞存活,CD137通过刺激抗体依赖性细胞介导的细胞毒性(ADCC)增强NK细胞的增殖。CD137对肿瘤反应性T细胞存在优先表达及增加T细胞募集到肿瘤部位的能力,可以保护T细胞免受活化诱导的细胞死亡反应(activiation-induced cell death,AICD),同时增强T细胞的毒活性[5],然而,目前已研发的CD137抗体对于CD137蛋白的特异性识别结合能力有限,对NF-κB信号通路的激活能力有限,促进PBMC细胞增殖有限,或诱导免疫细胞分泌细胞因子的能力有限,因此亟待开发新的人源化CD137抗体以用于新药研发。
1 材料与方法
1.1试剂与材料
1.1.1试剂 PCR buffer、dNTP、rTaqDNA聚合酶、DL 2000和DL 15000 DNA Marker、限制性核酸内切酶均购自日本TaKaRa公司;DNA片段回收试剂盒和质粒小提试剂盒,蛋白Marker均购自北京天根公司;Gibson Asse、bly Master Mix购自美国NEB公司;完全弗氏佐剂、不完全弗氏佐剂、Accuspin管均购自美国Sigma公司;脱脂奶粉、PE-Mouse anti-hCD137抗体购自美国BD公司;Lipofectamine 2000转染试剂、RPMI 1640和DMEM 培养基、GIBCO胎牛血清(FBS)均购自美国Thermo Fisher Scientific公司;HRP标记山羊抗小鼠IgG、goat anti-mouse-647均购自美国Abcam 公司; Protein A 纯化柱购自美国GE公司。
1.1.2菌种与质粒 真核表达载体PCDNA3.4由该治疗性疫苗研究中心实验室保存;大肠杆菌DH5α感受态及大肠杆菌BL21购自北京天根公司。
1.1.3细胞与病毒 小鼠骨髓瘤细胞SP2/0购自中国科学院典型培养物保藏委员会细胞库,人胚胎肾细胞293F为治疗性疫苗研究中心实验室保存。PBMC细胞来自于志愿者,标本获取与使用方法得到上海长征医院医学伦理委员会的批准。
1.1.4实验动物与组织来源 SPF级6~8周龄Balb/c、F1小鼠,购自上海西普尔-必凯实验动物有限公司,该实验对动物的处置均符合动物伦理学标准。由复旦大学实验动物中心协助饲养。
1.2方法
1.2.1蛋白真核表达质粒的构建与鉴定 通过DNAstar软件比较人CD137胞外段的亲水性与免疫原性,选取CD137第86~186个氨基酸所在的胞外段作为免疫靶向片段,并设计成在重组肽段羧基端(c端)融合有一个His标签的形式。随后,将以上所对应的基因片段5′端添加HindIII酶切位点、3′端添加Xbal酶切位点后交由上海桑尼生物公司合成,通过酶切位点HindIII和Xbal将该基因片段插入pCDNA3.4载体中,构建CD137真核表达质粒pCDN3.4,转化大肠杆菌DH5α感受态,通过HindIII/Xbal双酶切和PCR鉴定(上游引物p1:5′-CCCAAGCTTATGGGAAACAGCTGTTAC-3′;下游引物p2:5′-GCTCTAGATCAATGGTGATGGTGATGATGCTGCGGAGAGTGT-3′)筛选阳性克隆后由上海桑尼生物公司测序。
1.2.2重组蛋白的表达与纯化 运用脂质体转染法将构建成功的pCDNA3.4/hCD137-his 重组载体转染 293F细胞。 取对数生长期 293F 细胞,于37 ℃、120 r/min的CO2细胞摇床中培养,培养密度为1.0×105/ml,细胞生长密度达到倍数增殖时,进行转染;将脂质体-载体混合液加入细胞,扩大培养7 d后收集上清液进行纯化,其对照为转染pDNA3.4-GFP空载体的293F细胞(293/mock)。
1.2.3鼠抗人CD137单克隆抗体制备 将纯化的重组蛋白人CD137与等体积的弗氏佐剂混合乳化均匀(初免使用完全弗氏佐剂,加强免疫使用不完全弗氏佐剂),随后对3只Balb/c雌鼠经皮下多点注射免疫,免疫剂量为100 μg/只,体积为300 μl/只,共免疫3次,时间间隔为2周。初免后每2周从小鼠尾静脉采血,在第3次免疫完成后进行一次腹腔冲击免疫,免疫剂量为50 μg/只,3 d后取该小鼠脾细胞与SP2/0细胞做融合实验;HAT法筛选10 d后换HT培养基。在第14天时吸取杂14交瘤细胞培养上清液进行人CD137包被的ELISA检测,对检测结果为阳性的亚克隆采用有限稀释法进行至少2次以上的克隆化,直到筛选出稳定分泌单克隆抗体的融合细胞株。
1.2.4表位鉴定 为了确定CD137蛋白抗体的表位结合区,在公开的犬CD137蛋白序列(Ref. Seq. XM 845243)上对人CD137蛋白(4-1BB蛋白)的胞外结构域进行一系列突变。具体的突变位点参见表1,将突变后的序列构建到pHAGE-CMV-MCS-IRES-ZsGreen病毒包装载体上,并感染293FT细胞通过流式分选培养制成稳定表达细胞株,将细胞株结合纯化的抗体,无突变的CD137转基因细胞株做为阳性对照,通过流式检测法中阳性比例确定表位。

表1 CD137人至犬序列突变体表
1.2.5人源化抗体的制备 使用TRIzoL(购自上海生工生物)提取杂交瘤细胞株的总RNA,用逆转录试剂盒将mRNA逆转录成cDNA,以cDNA为模板做PCR,使用Ig-Primer Sets试剂盒分别克隆抗体重链和轻链可变区序列;将克隆得到的抗体重链和轻链可变区序列测序。将PCR产物克隆入pCDNA3.4载体进一步扩增表达。构建嵌合抗体,将上述测序正确的质粒构建成真核表达载体 pcDNA3.4(+)(VHCH)和 (VLCL)。将重、轻链表达载体后共同瞬时转染293F细胞表达抗体蛋白。在37 ℃、5%CO2的摇床中培养7 d后收集上清液,用琼脂糖凝胶protein A层析填料纯化上清液中的嵌合抗体。
人源化过程根据以下原则进行:在比对鼠源抗体与胚系模板的基础上,完全保留CDR区的氨基酸序列,参考已有文献报道的关键性骨架区残基,以及已上市/临床的基于IGKV4-1*01的人源化抗体确定人源化序列,对骨架区的关键鼠氨基酸进行选择性保留,产生初步人源化序列,之后再根据突变对亲和力的影响逐渐减少骨架区鼠氨基酸数。共有四个突变体,c6F5为人鼠嵌合抗体,c6F5-IgG2为鼠可变区构建在人的IgG2骨架上,c6F5-HR1为可变区保留一个鼠源氨基酸,发现表达量下降后将影响的氨基酸序列回复突变为hu6F5 A/V back人源化抗体。
全基因合成人源化抗体hu6F5重链可变区和轻链可变区,将抗体重链可变区和轻链可变区分别插入pcDNA3.4(+)-sshkappa和pcDNA3.4(+)-sshIgG2表达载体,将重、轻链表达载体后共同瞬时转染293F细胞表达抗体蛋白。在37 ℃、5%CO2的摇床中培养7 d后收集上清液,用琼脂糖凝胶protein A层析填料纯化上清液中的人源化抗体hu6F5。
1.2.6抗体体外功能鉴定
1.2.6.1NF-κB信号通路检测 制备表达人CD137以及稳定整合的NF-κB萤光素酶报道基因的293T细胞。收获细胞,洗涤及重悬浮于DMEM完全培养基,细胞密度为6×105个/ml。将50 μl细胞铺板于白色96孔平板的每个测定孔中。在存在2.5:1比率的交联抗体Fab'山羊抗人IgG Fc的条件下,分别加入human IgG2(同型对照)以及各抗体。加入抗体后将平板在37 ℃温育5 h。加入75 μl的Bright-Glo Luciferase试剂,使用酶标仪测量萤光素酶活性的量。
1.2.6.2人源化CD137抗体诱导细胞因子表达 用不同浓度人源化CD137抗体、抗CD3-e克隆UCHTl以及UTOMILUMAB(作为阳性对照)、cG33-IgG2(作为阴性对照)刺激外周血单个核细胞(PBMC)。离心后检测培养上清液。通过ELISA法检测上清液中的细胞因子。受试样品和标准品加入到抗细胞因子包被的96孔板中。在室温放置2 h后,在PBS-T中洗板3次,先与工作检测抗体保温,然后加入底物。450 nm处检测吸光度,基于标准曲线计算浓度。
1.2.7抗体亲和力鉴定
1.2.7.1BLI检测抗体亲和力 结合人 CD137的某些抗体的结合动力学使用 Fortebio octet 384仪器通过生物膜干涉(BLI)技术测量。包含氨基酸24-186的重组人CD137/his标签蛋白由本研究室制备。将蛋白质溶解于含PBS、0.1%牛血清白蛋白(BSA)及0.02%Tween 20的缓冲液中。抗体通过与AMQ传感器固定,在PBS、0.1%BSA及0.02% Tween 20中将抗体浓度稀释为50 nmol/L,将重组蛋白人CD137在1.56~100 nmol/L浓度范围以1 500 r/min结合10 min,随后以相同转速在PBS、0.1% BSA及0.02% Tween 20中进行10 min解离。结合的复合物通过甘氨酸脉冲再生。使用octet Data Analysis 9.0软件进行数据分析。传感图拟合为简便的1 ∶1 Langmuir 结合模型。抗体示出与重组人CD137的可逆结合。
1.2.7.2FACS检测抗体亲和力 3倍稀释不同人源化抗体,加入到CD137-293细胞中,再用Alexa Fluor®647-GOAT Anti-Human Ab染色后上流式细胞仪检测荧光。当抗原为一定数量,逐渐增加抗体浓度,抗体抗原结合达到饱和,然后求出抗原饱和50%时结合的抗体浓度。其倒数即为亲和常数,画出饱和曲线,EC50即为亲和常数。

2 结果
2.1真核表达质粒的构建与鉴定将pCDNA3.4真核表达载体和合成的人CD137胞外段基因片段都进行HindIII/Xbal双酶切处理,分别回收后在T4连接酶作用下进行连接,并转化至大肠杆菌DH5α感受态中构建重组质粒。提取质粒,挑取经HindIII/xbal双酶切和PCR方式鉴定均可获得约558 bp片段的阳性克隆(图1A),由上海桑尼生物公司测序。经鉴定,真核表达重组质粒pCDNA3.4-CD137构建成功。
2.2重组蛋白的表达纯化与鉴定以293F细胞和293F/mock为对照,用 ELISA 方法检测其上清液中hCD137蛋白的表达。结果显示,293F、293F/mock上清液中hCD137的表达均为阴性,293F/hCD137-His 基因转染细胞上清液hCD137表达水平较高,表达的目的蛋白能够以分泌型形式存在。SDS-PAGE结果见图1B。

图1 CD137 表达载体、重组蛋白及CD137单抗6F5的鉴定A: h-CD137基因的克隆和pCDNA3.4重组载体的酶切验证;B: h-CD137-his融合蛋白的蛋白纯化及Western blot验证;C: h-CD137单抗6F5的蛋白纯化
2.3鼠抗人CD137抗体的表位测定将突变后的序列构建到pHAGE-CMV-MCS-IRES-ZsGreen病毒包装载体上,并感染293FT细胞通过流式分选培养制成稳定表达细胞株,将细胞株结合6F5纯化抗体,无突变的CD137转基因细胞株做为阳性对照,通过流式检测法中阳性比例确定表位,结果见表2。表位在a.a.30~100之间。

表2 抗体6F5表位图
2.4人源化抗人CD137抗体的信号通路检测使用Bright-Glo Luciferase 检测试剂盒检测加入抗体后反应5 h的CD137转基因细胞株内荧光素酶的表达情况,读值见图2。由图可见6F5能够激活NFκB信号通路,并产生荧光素酶来使底物产生荧光值,该值与阴性值相比差异有显著差异(P<0.01)。

图2 NF-κB信号通路的检测1:m6F5;2:c6F5;3:c6F5-IgG2;4:c6F5-HR1;5:hu6F5-A/V back;6:UTOMILUMAB;7:Cg33-IgG2 ;与Cg33-IgG2组相比:**P<0.01
2.5抗体对PBMC细胞激活功能的鉴定用不同浓度人源化后不同突变hCD137抗体和抗 CD3-e克隆UCHTl刺激 PBMC, 使用试剂盒检测培养上清液中的IL-2(图3A)、IFN-γ含量(图3B)。结果显示 hCD137 抗体能显著提高细胞因子的分泌,与正常PBMC培养上清液中细胞因子含量相比差异有显著性。
2.6抗体亲和力分析分别使用BLI和FACS的方法检测人源化后不同突变抗体的亲和力。生物膜层光学干涉技术 (BiolayerInterferometry,BLI) 是通过固化CD137单抗6F5,结合CD137蛋白(结合浓度依次为100、50、25、12.5、6.25、3.12、1.56 nmol/L),检测6F5抗体及其他不同人源化抗体与CD137蛋白的亲和力(图4A)。结果显示人源化抗体亲和力未因氨基酸突变而下降(表3)。
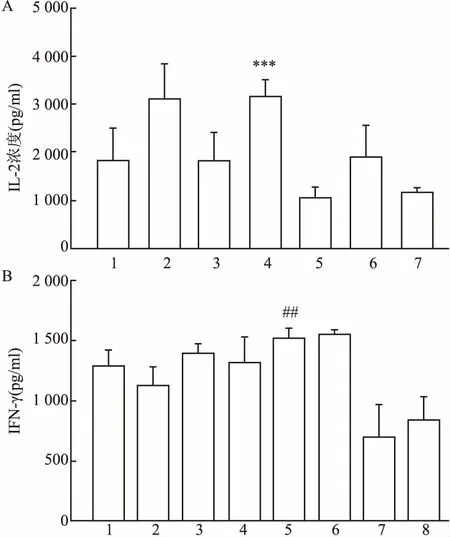
图3 人源化抗人CD137对PBMC的影响A:PBMC与SEA及CD137抗体共培养4 d后的IL-2含量;B:PBMC与CD3抗体及CD137抗体共培养4 d后的IFN-γ含量;与Cg33-IgG2 组相比:***P<0.001; 与PBMC组相比:##P<0.01;1:m6F5;2:c6F5;3:c6F5-IgG2;4:c6F5-HR1;5:hu6F5-A/V back;6:UTOMILUMAB;7:Cg33-IgG2 ;8. PBMC
不同抗原抗体反应呈现的平均荧光强度直接定量评价抗体亲和力大小。hCD137-293T应用于分析抗体亲和力,抗体的EC50进行分析。各抗体的LogEC50显示人源化抗体的亲和力未下降,同BLI数据相同(图4B)。
3 讨论
肿瘤微环境富含CD137,因为其在该位置由效应子和调节性T淋巴细胞表达[6]。更重要的是,必须将CD137激动剂靶向或局部递送至肿瘤,以暴露最大化并限制系统毒性(例如在肝和骨髓中)。事实上,大多数表达的CD137仅存在于肿瘤微环境中[7]。但是这些信号机制由TNFR家族和其他表面受体系统的其他成员共享[8],因此可能会有脱靶副作用。总的来说,基于CD137的免疫治疗可能为临床和转化发展提供了许多机会,因此得到有功能性的CD137人源化抗体成为迫切需要。目前得到的人源化抗体已经证明了体外功能试验及亲和力。该人源化抗体的表位和现有CD137抗体表位不同,可能会降低药物毒性。

表3 各抗体KD值
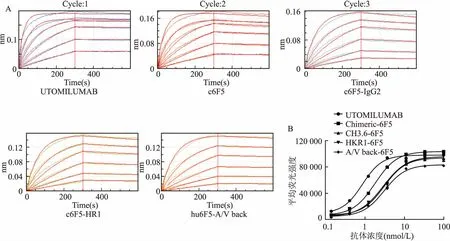
图4 抗体亲和力定量分析结果A:BLI测定不同CD137单抗的亲和力;B:FACS测定不同CD137抗体亲和力
下一步研究方向是证实该人源化抗体在体内实验上抗肿瘤效果,建立抗体药物体内外药效学评价标准,并且可能开展联合用药评价体内外药效学。
