基于物料循环的绿色有机化学实验教学方案
2018-09-04范文杰吴绍维刁晓倩赵嘉禄谭大志
范文杰, 吴绍维, 刁晓倩, 赵嘉禄, 谭大志
(1. 大连海洋大学 理学院, 辽宁 大连 116023; 2.大连理工大学 基础化学实验中心, 辽宁 大连 116023)
实验室在教学过程中不可避免会产生一些废弃物质。以前人们并不关心这些物质的去向,通常交给专业公司处置[1-3]。有机化学实验中,实验产物也作为有机废物处理,十分可惜。随着人们节能环保意识的不断增强,许多教育工作者将绿色化学的理念应用到实验教学中,通过设计和改进实验以减少废弃物的产生[4-6]。基于物料循环原理设计了新的有机化学实验教学方案,培养学生的创新能力和环境保护意识的同时,不仅提高了反应原料的利用效率,而且还减少了实验室产生的废液对环境的影响。
1 实验设计和反应原理
1.1 实验设计背景
传统的有机化学实验遵循从简单到复杂、从单一到综合的循序渐进的科学训练方式,有利于学生知识的增长与思维的发展[7]。涉及蒸馏操作的有机化学实验项目和基本操作方法分别为:丙酮和甲苯的分离,学习普通蒸馏(直型冷凝管)和分馏基本操作;环已醇制备环已烯,主要进行分馏操作[8-9];乙酸和异戊醇制备乙酸异戊酯,涉及分水回流和蒸馏(空气冷凝管)操作;乙酸乙酯制备乙酰乙酸乙酯,掌握真空蒸馏操作方法和实验原理[10-11]。
实验中制备的产物纯度不够,其他教学实验又很少用到,所以这些实验产品都作为有机废液处置。另外,我校有机化学实验的学时从60学时减少到36学时,需要对原有的实验教学方案进行改动,尽可能在有限的学时内保留较多的有机化学基本操作。在新的实验教学方案设计过程中,将绿色化学的理念应用到实验教学中,使实验产物得到循环利用,减少了废弃物排放。
绿色化学又称为环境友好化学,是指在制造和应用化学产品时有效利用(最好可再生)原料,消除废物和避免使用有毒的或危险的试剂,其根本目的是节约资源和保护环境[12]。基于物料循环设计有机化学实验教学方案,其特点是将实验中的产物作为下一个实验项目中的原料,经过数次实验后转化为起始物,构成一个完整的闭环流动系统,有效地提高化学试剂的利用效率,减少废弃物的排放。根据反应起始物和产物之间的关系,以异戊醇和乙酸异戊酯为主线设计循环实验,将多个实验教学内容串连在一起。
1.2 实验设计原理
实验设计原理如图1所示。乙酸与异戊醇在酸催化下制备乙酸异戊酯。该反应是典型的可逆反应,为了提高产率,采用分水回流的方法将生成的水从反应体系中分离出去,反应式如公式(1)所示。乙酸异戊酯的沸点比较高(142 ℃),用减压蒸馏的方法进一步纯化。产物乙酸异戊酯与乙醇在酸或碱作用下进行酯交换反应,生成异戊醇和乙酸乙酯,反应式如公式(2)所示。其中乙酸乙酯和乙醇共沸,采用分馏的方法可以将生成乙酸乙酯蒸出,促使反应向右侧移动。分馏出的混合溶液用氯化钙处置,以除去其中的乙醇。异戊醇的沸点比较高(131 ℃),蒸馏时需要用空气冷凝管进行冷却。实验方案涉及到分水回流、分馏、普通蒸馏、减压蒸馏等不同的实验操作方法。

图1 循环实验示意图

2 实验操作步骤
2.1 乙酸异戊酯的制备
在50 mL圆底烧瓶中加入12.7 mL(0.117 mol)异戊醇和7.2 mL(0.126 mol)乙酸,几粒沸石和3~4滴浓硫酸,混合摇匀。如图2所示,搭建分水回流反应装置,在分水器中预先加水至液面低于支管口0.5 cm,并记录液面位置,加热回流。反应过程中,水和乙酸异戊酯、异戊酯、乙酸形成共沸物,冷却后进入分水器中,有机物浮在上层,不断冷凝的液体使上层有机物质回流到反应烧瓶继续参与反应。生成的水进入下层,使反应向正向进行(见公式1),因而理论上乙酸和异戊酯可全部转化。当分水器中水面上升至支管口时,及时把水从分水器旋塞处放出,使水面又降低至原来的位置,如此不断放出生成的水至水面不再上升,记录分出的水量。根据分出的水量可以粗略地估计酯化反应完成的程度。
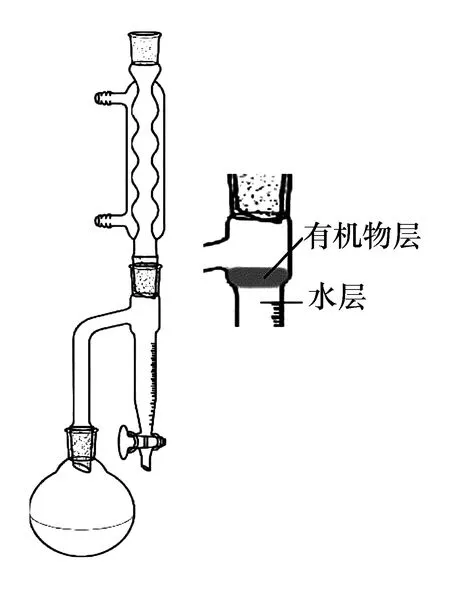
图2 分水回流反应装置
将分水器中的酯层和圆底烧瓶中的物质一起倒入分液漏斗中,依次用水,碳酸钠溶液(ω=0.1)和饱和食盐水洗涤至中性。再将有机层转移至干燥锥形瓶中,加入无水硫酸镁干燥,过滤除去干燥剂。粗产品乙酸异戊酯转移至圆底烧瓶中,加入沸石。搭建减压蒸馏反应装置,调解系统反应压力,进行减压蒸馏实验操作。收集产物乙酸异戊酯的质量可达到8 g,如低于5 g应酌情扣分。为进行下阶段的实验,给学生补充乙酸异酯至13 g。
2.2 乙酸异戊酯的酯交换反应
取乙酸异戊酯15 mL(0.1 mol)、无水乙醇10 mL(0.18 mol)加入到50 mL圆底烧瓶中,再加入5滴浓硫酸(约0.5 mL)和沸石,振荡摇匀。如图3所示搭建分馏装置,逐步提高反应温度,控制馏出液体速度为1 滴/2~3s,分馏温度不超过80 ℃。实验利用共沸混合物除去酯交换反应中生成的乙酸乙酯[13],使反应向正向进行(见公式2),乙酸乙酯和乙醇形成共沸物的沸点为71.8 ℃,乙酸乙酯含量为53.9 %(mol)。

图3 分馏装置
2.2.1 乙酸乙酯的纯化
分馏出物质转移至分液漏斗中,用氯化钙溶液洗涤。将有机层转移至干燥锥形瓶中,再加入无水氯化钙干燥。氯化钙和乙醇形成配合物CaCl2·4C2H5OH,能够同时除去乙酸乙酯中残留的水和乙醇。干燥过滤后的乙酸乙酯转移至圆底烧瓶中,加入沸石。搭建普通蒸馏装置,用水冷凝管冷却,加热蒸馏,收集76~80 ℃馏分,得到产物乙酸乙酯。经过氯化钙处理后的乙酸乙酯的纯度很好,可以用于从茶叶中提取咖啡因等教学实验,因此蒸馏纯化的步骤也可以不做。
2.2.2 异戊醇的纯化
圆底烧瓶中的物质转移到分液漏斗中,依次用碳酸钠溶液(ω=0.1)和饱和食盐水洗涤至中性。同样把有机层转移到干燥锥形瓶中,用无水碳酸钠干燥,过滤,将滤液转移至圆底烧瓶中,加入沸石。搭建普通蒸馏装置,用空气冷凝管冷却,加热蒸馏,收集128~132 ℃馏分,得到产物异戊醇。
实验产品的纯度用气相色谱检测。异戊醇经过纯化后可以重复使用;乙酸乙酯是实验室常用的试剂,可用于其他教学实验;实验废水中含有的有机物为容易降解的乙酸和醇类,对环境污染小,可直接排放。
3 教学效果
基于物料循环原理重新设计了新的教学方案,涵盖了原先实验体系的教学内容。采用新的教学方案,可以分成2次完成实验,用10~12学时完成以前20学时安排的教学内容,达到实验课程改革的要求。这种多步骤实验对学生基本操作要求更加严格,第一阶段的实验产品需要达到一定品质和数量,才能继续进行。因此学生须认真完成每一步操作,才能获得理想的实验结果,改变了过去随意、粗心、不重视结果的实验态度,培养了学生严谨、求实的科学作风。教师则根据学生制备产品的纯度和质量,以及补充乙酸异戊酯的用量,再结合学生具体的实验情况,给予他们更合理的评价。
新的实验教学方案在物料合成中分别选择了分水回流和分馏的方法,而在纯化试剂的时候又采用了减压蒸馏和普通蒸馏(水冷凝和空气冷凝)。学生通过不同实验方法的比较,更好地理解了化合物性质与实验方法选择、操作步骤优化的对应关系。教师在教学安排上可以适度增加自主实验内容,当学生完成第一步实验后,在后续的操作中鼓励学生选用KOH或其他醋酸盐作为催化剂代替浓硫酸,用不同的方法纯化乙酸乙酯和异戊醇等。新的实验方案还培养了学生绿色环保的理念,使学生初步理解产品生命周期的概念,从实验设计时就消除废液对环境的影响[4]。
从经济效益上分析,采用该实验方案可以减少环已醇制备等实验的试剂采购和有机废液处置费用,并且提高了化学试剂的利用效率,消除了有机废液排放,降低了教学运行费用。
