盐酸左氧氟沙星眼用纳米粒温敏凝胶的制备及体外释放考察
2018-09-04吴宏霞石冬梅唐淑榕李光文沈龙华
吴宏霞,林 媚,石冬梅,唐淑榕,李光文,沈龙华
盐酸左氧氟沙星(levofloxacin hydrochloride,LVFX)是第三代喹诺酮类药物氧氟沙星的左旋同分异构体,其抗菌活性强、抗菌谱广、副作用少,与其他抗菌药很少交叉耐药,且在房水中的浓度高于其他喹诺酮类药物,是目前公认的疗效显著的眼科抗菌药,广泛用于治疗角膜炎、结膜炎、角膜溃疡、眼睑炎、睑腺炎、泪囊炎等眼部疾患及手术前后的预防[1-3]。与大多数眼用液体制剂类似,由于结膜囊内泪液的分泌和冲洗,LVFX普通滴眼液使用后药效维持时间短,仅有不足5%的药量到达眼内组织[4],需频繁给药,患者依从性差。
温敏凝胶(thermosensitive in-situ gels,TISG)是一类对温度敏感的智能凝胶,以泊洛沙姆(poloxamer)为基质的TISG在常温下为溶液,便于患者给药,滴入眼穹隆后形成凝胶,体系黏度瞬间增大,防止药液流失,延长药物眼部滞留时间[5]。
为提高眼用制剂的生物利用度,本研究制备了LVFX壳聚糖纳米粒(LVFX-NPs),并采用中心复合设计(central composite design,CCD)-响应曲面法 (response surface methodology,RSM)筛 选TISG基质泊洛沙姆407和泊洛沙姆188的最佳比例,制成眼部给药后立刻胶凝的滴眼液(LVFXNPs-TISG),结合纳米粒的缓慢释放与原位凝胶延长滞留的优势,进一步增加药物的眼部生物利用度,同时考察其体外释药行为,为体内研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂 LVFX(批号:10012016A,福州飞净生物科技有限公司);壳聚糖(CS,脱乙酰度≥95%,黏度100~200mpa·s,批号K1520258,阿拉丁试剂上海有限公司);泊洛沙姆407和188(批号分别为WPAK588B及WPAK527B,德国BASF公司);人工泪液(自制,氯化钠6.42g,碳酸氢钠1.42g,二水氯化钙0.11g,氯化钾1.11g,加入纯化水定容至1L);乙腈为色谱纯,其他试剂为分析纯。
1.1.2 仪器 透射电子显微镜(HT7700,日立高新技术公司);激光粒度仪(Z3000,美国PSS公司);高速冷冻离心机(Neofuge 15R,香港力康发展有限公司);高效液相色谱仪(LC-15C,日本岛津);电子天平(AL204,梅特勒-托利多仪器上海有限公司);冷冻干燥机(LGJ-10C型,北京四环科学仪器厂);磁力搅拌器(79-1,北京中兴伟业仪器有限公司);恒温振荡器(SHA-B,常州国华仪器有限公司);pH计(PHS-3E,上海仪电科学仪器股份公司);Millipore超滤离心管(3000Da,德国默克集团)。
1.2 方法
1.2.1 LVFX-NPs-TISG 的制备 称取适量 CS溶于0.5%醋酸水溶液20mL中,制得澄清的CS高分子水溶液(1.8g/L)。将处方量的LVFX加入CS溶液,磁力搅拌下以1mol/L的NaOH溶液缓慢滴加,调节 pH 值至5.1,将 TPP 水溶液(1mg/mL)以每分钟3滴的速度均匀滴入持续搅拌的溶液中(600r/min),滴加结束后继续搅拌60min,过0.8μm 微孔滤膜,得 LVFX-NPs,稀释10倍后以2%磷钨酸染色,透射电镜下观察形态,激光粒度仪测定其粒径。将此胶体溶液置于15mL超滤管,4℃下离心(7 000r/min)45min,滤液用来测定包封率,同时收集超滤管内胶体,冷冻干燥得载药纳米粒粉末,并称定总质量以计算载药量。
按处方量取纯化水于10mL西林瓶中,将载药纳米粒粉末撒入水中溶胀,加入处方量的泊洛沙姆407和188,4℃冰箱静置,得澄明载药LVFX-NPs-TISG。以LVFX代替载药纳米粒粉末,同法制备得LVFX普通凝胶(LVFX-TISG)。
1.2.2 纳米粒包封率和载药量的测定 采用反相高效液相色谱法检测LVFX的含量。色谱柱:InertSustain C 18(150mm×4.6mm;5μm);流动相:磷酸溶液(三乙胺调pH=3)-乙腈(85∶15);检测波长:293nm;流速:1.0mL/min;柱温:35℃;进样量:20μL。
将上述离子凝胶法制备的LVFX-NPs胶体溶液超滤离心后的滤液,以高效液相色谱法测定LVFX的含量,同时根据投药量和冷冻干燥后纳米粒粉末的质量,按以下公式计算纳米粒的包封率和载药量。

1.2.3 胶凝温度的测定 采用温度计目测法测定胶凝温度[6]。将精度为0.1℃的温度计插入装有5g LVFX-NPs-TISG滴眼液的西林瓶中,温度计的水银球完全没入溶液中。将西林瓶置于恒温水浴锅中缓慢升温(0.1℃/min),每升高0.1℃,取出西林瓶一次,迅速倾斜45°~60°,观察滴眼液是否流动。当试管内液体不发生流动、形成凝胶时的温度记为胶凝温度T1(无泪液胶凝温度)。另往LVFX-NPs-TISG滴眼液中加入人工泪液混匀(滴眼液∶人工泪液=40∶7)[7],测得的胶凝温度为T2(含泪液胶凝温度)。每个样品平行测定3次,结果取平均值。
1.2.4 LVFX-NPs-TISG的处方优化
1.2.4.1 实验设计 由文献[8]可知,在泊洛沙姆407凝胶基质中加入泊洛沙姆188,可提高处方的胶凝温度。为了获得室温下呈液态、滴入眼穹隆被泪液稀释后立刻胶凝化的基质,以泊洛沙姆407的浓度(X1:18%~26%)和泊洛沙姆188的浓度(X2:0~6%)为考察因素,根据中心复合设计-效应曲面原理安排各因素水平的代码值和操作值,采用二因素五水平设计实验(表1)。

表1 星点设计的因素和水平Tab 1 Factors and levels in central composite design
1.2.4.2 模型拟合及最优选择 采用通用数值分析软件MATLAB,以T1和T2为评价指标,分别对各因素进行二次多项式回归,回归方程的通用表达为:

随后根据星点设计和优化设计理论,建立基于所生成效应面回归方程的优化数学模型。该模型选择设计变量=[X1,X2]T,其中 X1为表征泊洛沙姆407浓度的因素(%),X2为表征泊洛沙姆188浓度的因素(%)。确定目标函数minf)=|T1-T2|,其中T1和T2分别用前述2个评价指标的二次多项式回归方程代入,该目标函数是希望实现经泪液稀释后胶凝温度T2与未经稀释的胶凝温度T1差值最小,以保证滴眼液在储存时呈现液态,滴入眼球表面则迅速胶凝化。模型的约束条件包括25≤T1≤30和30≤T2≤35,表征胶凝温度的控温范围。通过对该数学模型的求解即可得出最优化处方设计。
1.2.5 药物体外释放行为考察 采用文献[9]的方法,精密称取LVFX-NPs-TISG 2.0g于5mL低型烧杯中,34℃下充分胶凝后置于溶出杯底部,加入温度为(34±0.5)℃的人工泪液200mL,转速为100r/min,于第0.5,1,2,3,4,6,8,12,24h各取样1mL,并补充1mL等温泪液。样品经超滤管离心过滤后,取滤液进样测定浓度并计算累积释药百分率Q,同法测定LVFX-TISG的累积百分率。
2 结 果
2.1 LVFX-NPs的形态、粒径、包封率及载药量纳米粒形态圆整,分布均匀,平均粒径为(60.7±5.1)nm,多分散指数为(0.18±0.03),Zeta电 位 为 (32 ± 1.5)mV。 药 物 包 封 率 为(62.5±1.8)%,载药量为(10.43±0.30)%(图1)。
2.2 模型拟合 根据表1安排实验,结果见表2。分析数据后,关于T1和T2的计算结果分别如表3,4所示。
T1的二次多项式回归数学模型为:
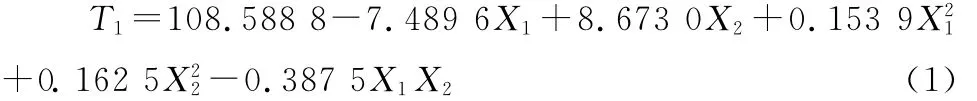
模型的复相关系数r=0.997 2,结合P值检验结果,该模型具有较高的可信度。
根据P检验的情况,T2的回归模型中,b4项的P值达到0.339 8,该项的可信度低,予以删除后重新拟合,结果如表5所示。
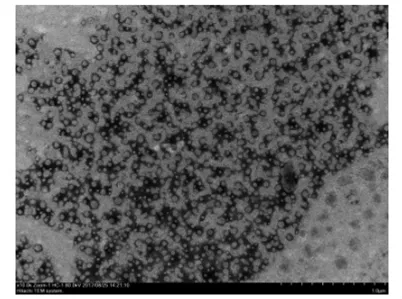
图1 LVFX-NPs透射电镜图Fig 1 Transmission electron microscope image of LVFX-NPs

表2 星点设计实验安排及实验结果Tab 2 Central composite design for the variation with experimental results

表3 T1的二次多项式回归结果Tab 3 Results of two polynomial regression of T1
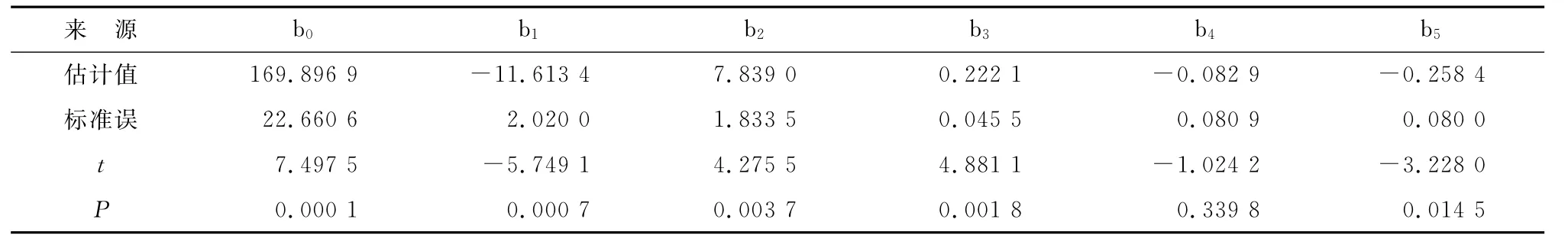
表4 T2的二次多项式回归结果Tab 4 Results of two polynomial regression of T2
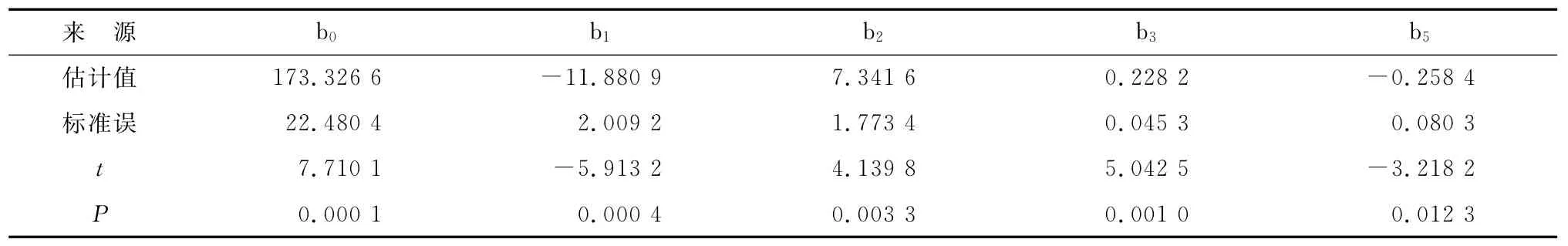
表5 删减后关于T2的二次多项式回归结果Tab 5 Two polynomial regression of T2after deletion
T2的二次多项式回归数学模型为:

模型的复相关系数r=0.993 6,结合表5的检验结果,该模型具有较高的可信度。
根据二次多项式方程,分别绘制各指标的三维效应面和二维等高线图(图2),研究不同浓度泊洛沙姆407和泊洛沙姆188在无泪液及有泪液稀释的情况下对胶凝温度的影响,通过等高线图重叠,选取室温下(25℃)呈液体状态、便于滴入眼睛、在眼球表面温度(34℃)下能立刻发生相转变凝结成固态、便于粘附于角膜和结膜囊表面的处方的区域(图3)。

图2 LVFX-NPs-TISG的胶凝温度对泊洛沙姆407和188的效应面与等高线图Fig 2 The response surface and contour map of poloxamer 407and 188on the gelation temperature of LVFX-NPs-TISG
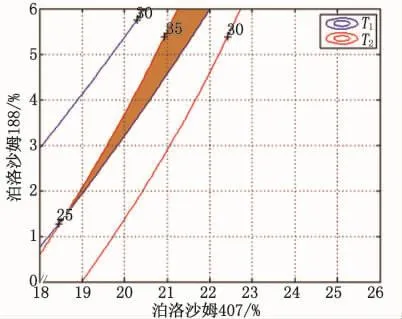
图3 二维等高线叠加图(等高线交集区域为优化区域)Fig 3 Two-dimensional contour map(the intersection area of contour lines is the optimal region)
根据图3,选择实验设计中的可行处方设计,即在等高线叠加图中选择满足25≤T1≤30和30≤T2≤35的点,如表6中处方1~4所示。
2.3 最佳处方设计 在MATLAB软件中选用内点惩罚函数法进行非线性规划求解,可得最佳处方设计 方 案 为 X1=22.014 2、X2=6.000 0,此 时|T1-T2|=7.288 3,即表6中优化为圆整后的最佳处方。
2.4 处方的验证 4个直观观察挑选的处方及优化设计的最优处方在未经处理和经模拟泪液稀释后,胶凝温度实测值与预测值偏差均<5%,表明所拟合方程预测性较好。
2.5 体外释药结果 以药物累积释放率Q对时间t作图,分别得到LVFX-TISG的经时释放曲线(图4)。LVFX-TISG溶蚀快,大约5h完全溶蚀(此时累积释放率为94.7%)。以前面5h的累积释放率对时间回归,得回归方程:

LVFX-NPs-TISG 24h释放总量达到71.9%。

表6 验证处方的预测值与实测值Tab 6 Comparison of predicted values and measured values

图4 LVFX-NPs-TISG的体外释放曲线Fig 4 In vitro release profiles of LVFX-NPs-TISG
3 讨 论
CS是自然界存在的唯一碱性多糖,其结构中的氨基与角膜中带负电荷的阴离子糖蛋白结合或反应形成药物储库,具有优良的黏膜粘附性[10]。预实验中发现,加入LVFX-NPs后,处方胶凝温度整体下降0.2~2℃,即CS可增强泊洛沙姆的胶凝能力,增强缓释效果,与文献报道一致[11-12]。
本研究将载药纳米粒分散在TISG中,理想的眼用TISG应在使用前为液体,滴入眼穹隆立即形成凝胶。因此,本实验采用载药纳米粒TISG经模拟泪液稀释前后的胶凝温度T1及T2为处方评价指标,研究不同浓度泊洛沙姆407和泊洛沙姆188在无泪液及有泪液稀释的情况下对胶凝温度的影响,通过中心复合设计-响应曲面法对胶凝温度受泊洛沙姆型号和浓度的影响进行试验、建模和数据分析,建立基于所生成效应面回归方程的优化数学模型,运用图形技术将胶凝温度与泊洛沙姆的关系显示出来,可供实验者凭借直观的观察来选择优化条件[13]。本研究则通过对优化模型的求解获得最佳处方设计,结果显示,优化的处方实测值与模型预测值偏差小,表明拟合的数学模型在因素优化过程中是可行的。所用方法具有实验次数少,结果直观,实验精度高,结果重现性好等优点。
测定纳米粒TISG体外释放度时,需兼顾TISG的性质和纳米制剂的释放特点。TISG的体外释放通常采用正向动态透析袋法、Franz扩散池法和无膜法[14-15]。透析法操作简便,取样后无需过滤分离,也可直接用于纳米制剂的体外释放测定。但释放后的药物需要通过透析膜缓慢与外界介质交换,药物未处于完全的漏槽状态[10],与实际眼部给药时药物的释放有一定差异。扩散池法释药面积固定,温敏原位凝胶在凝胶状时存在剪切稀释特性,随着眼睛眨动,会在眼球表面进行重新分布,故给药后渗透速率和渗透总量将高于扩散池法[16]。无膜法在TISG体外释放中使用最广泛,其优点是可模拟凝胶骨架在角膜前缓慢溶蚀的过程,但该法不能体现实际给药时特殊的角膜结构及凝胶在角膜表面的覆盖。此外,无膜法溶蚀速度较快,纳米粒释放缓慢,照搬此法不符合药物的实际释放规律。本研究采用溶出仪释放度法和无膜法结合,既能模拟凝胶在角膜前的溶蚀过程,也能反映溶蚀后药物从纳米粒中缓慢释放的特点。
LVFX-TISG从TISG中的释放遵循零级动力学规律,这是因为凝胶基质在溶出杯中溶蚀呈现零级动力学过程,药物从TISG中的释放速度由溶蚀速度控制。LVFX-NPs-TISG 24h 释放总量 达71.9%,具有明显的缓释效果而无突释效应,这缘于常温下液态的纳米粒TISG升温到眼表温度后转为半固体凝胶态,凝胶是按照零级动力学逐步溶蚀的,故而纳米粒中的药物在温敏原位凝胶中的释放也更均匀平稳。
近年来,眼用原位凝胶发展迅速,国外有Timoptic XE已经上市,国内也有多个产品处于临床研究阶段[11],但是将原位凝胶运用于纳米粒载体系统的研究仍在初步阶段。该给药系统结合纳米粒缓释和原位凝胶延长滞留时间的优势,又保留了液体制剂给药方便、精确的优点,减少给药次数与药物全身副作用,增加缓释效果与生物利用度,有望成为眼部传递系统的新剂型,具有良好的应用前景。
