Exendin-4对t-BHP诱导的SV40细胞氧化应激的影响
2018-09-04王林曦刘小莺刘晓红刘礼斌
陈 粲,王林曦,刘小莺,刘晓红,陈 洲,刘礼斌
糖尿病肾病是终末期肾脏病的主要原因之一[1],其发病机制与多种因素特别是氧化应激相关[2-3]。肾小球系膜细胞是肾脏的固有细胞之一,其氧化应激增加将导致肾小球硬化加重。胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)是一种由肠道L细胞分泌的肽类激素,分布于多种器官中,而Exendin-4是北美希拉毒蜥唾液中分泌的天然GLP-1类似物。研究表明,肾脏组织中存在GLP-1受体,而Exendin-4可作用于肾脏,减轻氧化应激,从而延缓肾小球硬化的进展[4]。第三丁基过氧化氢(T-butyl hydroperoxide,t-BHP)能分解产生氧自由基,长期被应用于建立细胞氧化应激损伤模型。本实验构建t-BHP诱导下小鼠肾小球系膜细胞氧化应激损伤模型,观察Exendin-4对其影响,并探讨其机制。
1 材料与方法
1.1 材料 小鼠肾小球系膜细胞(SV40MES 13,中国科学院上海生物研究所);Exendin-4(批号:#065M4752)及t-BHP(批号:#BCBN5378V)(美国Sigma公司);CCK-8试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽还原酶(glutathione reductase,GR)试剂盒、Caspase-3试剂盒(杭州碧云天生物技术研究所);β-actin一抗(武汉博士德公司);Bax及Bcl-2多克隆一抗(美国Cell Signaling公司)。
1.2 方法
1.2.1 细胞培养 细胞株生长于含5%胎牛血清(fetal bovine serum,FBS)的低糖 DMEM 培养液中(D-葡萄糖浓度5.5mmol/L),置于37 ℃、体积分数为0.05的CO2恒温培养箱中培育,每2~3天予0.25%胰酶消化传代,待生长至80%~90%融合状态时接种于培养板,培养24h后进行下一步实验。
1.2.2 分组 参考预实验结果,不同浓度(0,25,50,100,200μmol/L)的t-BHP可剂量依赖性引起SV40的存活率降低,当t-BHP浓度>50μmol/L时,细胞存活率显著低于对照组(P<0.05),不同浓度(10,25,50,100nmol/L)Exendin-4预处理可改善细胞存活率,并呈剂量依赖性,当Exendin-4浓度>50nmol/L时,细胞存活率显著高于t-BHP单独处理组(P<0.05)。根据此结果,最终选择50及100μmol/L的t-BHP 和 50nmol/L 的 Exendin-4进行实验。实验分组:(1)对照组,予含有5%FBS、糖浓度为5.5mmol/L的DMEM 培养液培养。(2)不同浓度t-BHP干预组(T50或T100组),分别予 50 及 100 μmol/L 的 t-BHP 干 预 4h。(3)Exendin-4预 处 理 组 (ET50 及 ET100 组 ),50nmol/L Exendin-4 预处理 2h 后,再予 50 或100μmol/L的t-BHP干预4h。
1.2.3 CCK-8实验检测细胞存活率 将细胞制成5×103mL-1密度的细胞悬液,每孔100μL接种于96孔板中,37℃、体积分数为0.05的CO2培养箱中培养24h,按实验分组分别进行干预,每组设置8个复孔。干预结束后,每孔加入10μL CCK-8溶液,放入培养箱中4h,酶标仪单波450nm波长测定吸光度,计算细胞存活率。

1.2.4 细胞内SOD,GR及Caspase-3活性检测将细胞以5×105mL-1密度接种于6孔板,37℃、体积分数为0.05的CO2培养箱中培养24h,按实验分组分别进行干预,干预结束后收集细胞,检测细胞内SOD,GR及 Caspase-3的活性:(1)SOD,用4℃或冰浴预冷的PBS洗涤2遍,沉淀用预冷的PBS冰浴进行匀浆,匀浆液4℃离心,取上清作为待测样品,每组设置3个复孔,按试剂盒说明书进行操作,酶标仪单波450nm波长测定光密度,计算细胞内SOD活力。(2)GR,PBS洗涤2次,按每200万个细胞加入100μL裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15min,4℃下16 000r/min离心15min,取上清作为待测样品,每组设置3个复孔,按试剂盒说明书操作,酶标仪单波412nm波长测定光密度,计算细胞内 GR活力。(3)Caspase-3,前期操作步骤同GR检测,按试剂盒说明书操作,酶标仪单波405nm波长测定光密度,计算细胞内Caspase-3活性。
1.2.5 Western-blot检测 Bax及 Bcl-2蛋白表达将细胞以5×105mL-1密度接种于6孔板,37℃、体积分数为0.05的CO2培养箱中培养24h,分为对照组、100μmol/L t-BHP 单 独 处 理 组、Exendin-4+100μmol/L t-BHP组,干预结束后用细胞裂解缓冲液裂解细胞,4℃下14 000r/min离心15min,取上清液,BCA工作液检测蛋白浓度,并用RIPA将各孔蛋白配平至等体积、等浓度,加入等体积5×上样缓冲液混匀,98℃变性5min。各组取40μg蛋白,在10%SDS-PAGE凝胶中电泳分离,使用半干电转法转移到PVDF膜上,5%脱脂牛奶室温封闭1h,孵育相应一抗(1∶1 000)稀释,4℃冰箱过夜,加入相应二抗(1∶2 000),室温摇育1h,ECL化学发光液显色,X射线底片曝光。
2 结 果
2.1 Exendin-4对t-BHP作用下SV40细胞存活率及 SOD,GR,Caspase-3 活性的影响 50 及100μmol/L的t-BHP处理后,细胞存活率分别为(86.99±3.37)%及(72.63±7.92)%,细胞内SOD活性分别为(0.22±0.02)及(0.20±0.02)U/mg prot,细胞 内 GR 活 性 分 别为 (23.75±0.79)及(20.52±0.86)U/mg prot,均较对照组显著降低(P<0.01);细 胞 内 Caspase-3 活 性 分 别 为(35.62±0.55)及(40.49±0.98)U/mg prot,较对照组升高(P<0.01)。使用Exendin-4预处理2h后,各组细胞存活率较t-BHP单独处理组显著升高,ET50组和ET100组细胞存活率分别为(97.63±5.40)%及(93.63±5.54)%,SOD活性分别为(0.33±0.02)及(0.30±0.02)U/mg prot,GR活性分别为(27.77±1.16)及(26.27±1.09)U/mg prot,均较t-BHP单独处理组显著升高(P<0.05),与对照组比较差别无统计学意义(P>0.05)。Caspase-3活性分别为(26.56±0.71)及(28.10±1.13)U/mg prot,较t-BHP单独处理组显著降低(P<0.01),与对照组比较差别无统计学意义(P>0.05)(图1)。
2.2 Exendin-4对t-BHP作用下SV40细胞中Bax及Bcl-2蛋白表达水平的影响 t-BHP单独处理组Bax/β-actin比值较对照组上升23.1%(P<0.01),Bcl-2/β-actin比值较对照组下降31.3%(P<0.01)。使用 Exendin-4 预 处 理 后,Bax/β-actin比 值 较t-BHP单 独 处 理 组 下 降15.6% (P <0.05),Bcl-2/β-actin比值较t-BHP单独处理组上升27.0%(P<0.01),与 对 照 组 比 较 差 别 无 统 计 学 意 义(P>0.05)(表1,图2)。

表1 各组Bax及Bcl-2蛋白表达水平Tab 1 Expressions of Bax and Bcl-2among different groups
3 讨 论
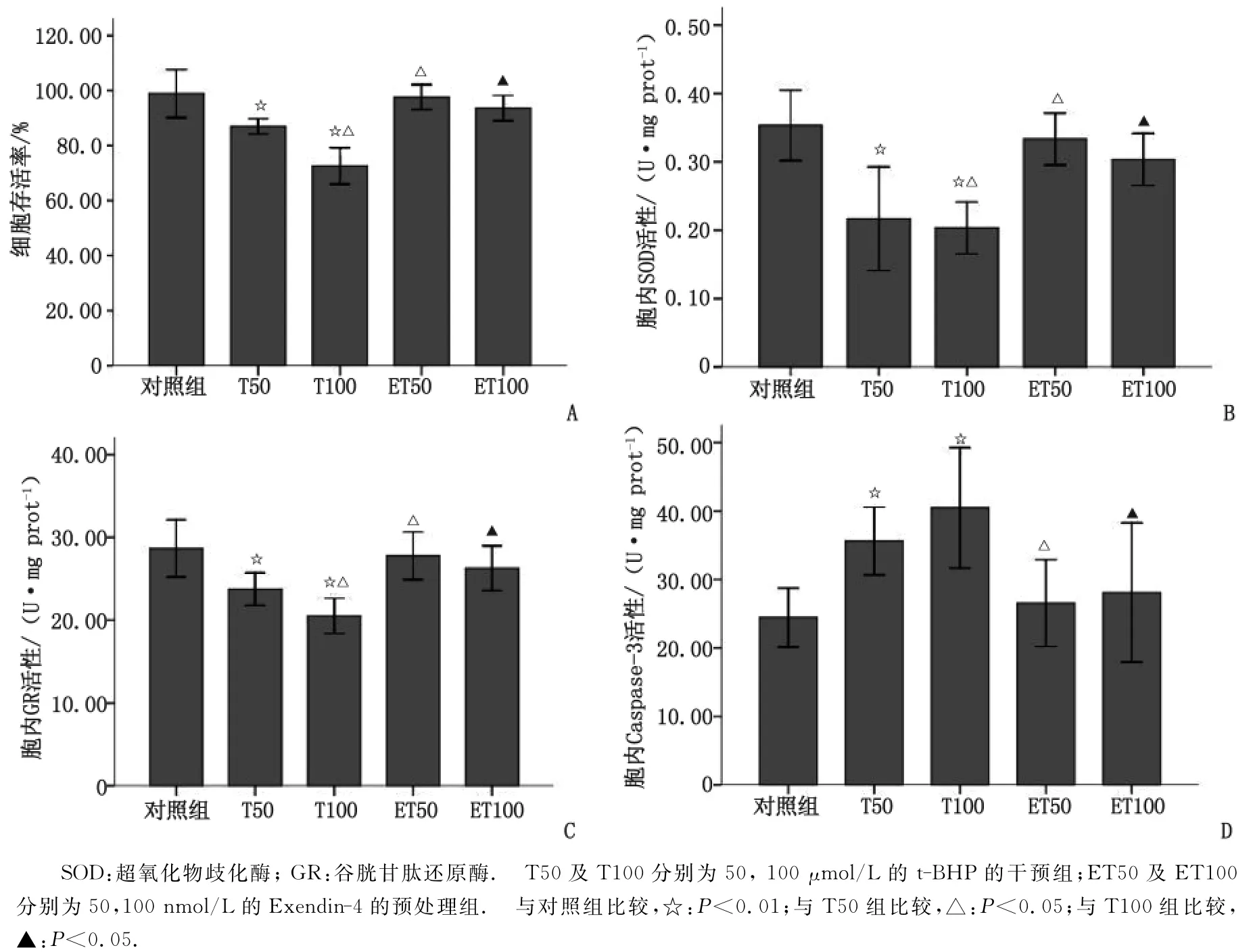
图1 Exendin-4对t-BHP作用下SV40细胞存活率及SOD,GR,Caspase-3活性的影响Fig 1 Effect of Exendin-4on viability,SOD activity,glutathione reductase activity and Caspase-3activity in SV40 cells treated with t-BHP

图2 Western-blot检测Exendin-4对t-BHP作用下SV40细胞中Bax及Bcl-2蛋白表达水平的影响Fig 2 Effect of Exendin-4on expression of Bax and Bcl-2protein in SV40cells treated with t-BHP by Western-blot
氧化应激是机体在受到有害刺激时,产生大量活性氧(reactive oxygen species,ROS),导致机体内抗氧化功能障碍,从而造成组织细胞损伤[5]。病理状态下,线粒体功能障碍,通过蛋白激酶C、多元醇、晚期糖基化终产物等途径引起ROS产生过量[6],最终导致肾小球硬化。肾小球系膜细胞是肾脏固有细胞之一,对肾脏具有支持和保护作用。研究表明,氧化应激状态下,肾小球系膜细胞中的还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶被激活,产生大量ROS,诱发细胞凋亡,导致肾脏纤维化[7]。SOD能在肾脏内催化超氧化物阴离子发生歧化作用,生成过氧化氢和氧气,从而清除自由基,GR使机体内的氧化型谷胱甘肽还原为保护性的还原型谷胱甘肽,二者均是机体内重要的抗氧化酶,能间接反映机体的氧化应激水平。肾脏氧化应激增强,同时各种抗氧化酶活性降低,使机体清除自由基的能力减弱,导致肾小球硬化,最终造成慢性肾脏损伤[8]。
Caspase家族是在细胞凋亡过程中起关键作用的蛋白酶家族,其中Caspase-3是细胞凋亡途径中最为重要的终末剪切酶,在凋亡早期被激活,并参与多种细胞的凋亡。研究表明,ROS可以激活Caspase级联反应导致细胞凋亡[9],动物实验也证实,由氧化应激引起凋亡的肾脏细胞中Caspase-3表达增加[10-11],机制可能与细胞色素C介导的线粒体通路以及Fas/FasL通路有关。促凋亡基因Bax和抗凋亡基因Bcl-2也参与了肾脏细胞凋亡过程。
GLP-1是由肠道L细胞分泌的肠促胰岛素[12],GLP-1受体分布于机体内胰腺、心脏等多种器官中,GLP-1通过与受体结合发挥对机体的保护作用[13]。研究发现,肾脏中也存在 GLP-1受体,与GLP-1结合后可以抑制肾脏组织中ROS的生成[4]。但由于GLP-1半衰期较短,且在体内易被二肽激肽酶4(dipeptidyl peptidase 4,DPP-4)分解,在临床上应用有限。Exendin-4是GLP-1受体激动剂,可以通过激活GLP-1受体产生作用,半衰期较长且不被DPP-4降解。国外已有动物实验证明,Exendin-4能降低大鼠肾脏组织中的氧化应激水平,减轻肾小球系膜增生[14]。Park等也证明,Exendin-4能改善肾小球滤过率,抑制肾脏细胞凋亡[15]。
t-BHP是目前被广泛应用的建立体外氧化应激细胞模型的化学物质。本实验中使用t-BHP模拟肾小球系膜细胞氧化应激模型,单独处理4h之后,CCK-8法检测的细胞存活率较对照组降低,细胞内SOD及GR活性降低,Caspase-3活性以及促凋亡基因Bax表达上升,说明t-BHP将诱导系膜细胞内氧化应激,使细胞抗氧化能力下降,进而激活Caspase-3,导致细胞凋亡。给予 Exendin-4预处理2h后,检测细胞存活率及细胞内SOD及GR活性以及抗凋亡基因bcl-2的表达,均较t-BHP单独处理组升高,Caspase-3活性降低。t-BHP单独处理组中,100μmol/L组与50μmol/L组相比,细胞存活率以及抗氧化酶活性均降低,说明t-BHP诱导SV40细胞凋亡可能存在浓度依赖性,有待进一步实验证实。而加用Exendin-4预处理后,2组中的各种指标与对照组比较差别无统计学意义,说明Exendin-4可以提高系膜细胞抗氧化能力至接近正常水平,加强抗氧化作用,抑制Caspase系统激活,降低机体氧化应激水平,从而减少细胞凋亡。因此,Exendin-4可以通过抑制氧化应激,延缓肾脏病变的发生发展,可以作为改善肾脏损伤的药物在临床上推广应用。
