Src激酶抑制剂PP2对人舌鳞状细胞癌Tca8113细胞迁移和侵袭能力的影响
2018-09-04邹湘渝聂敏海
曾 琴,刘 萍,邹湘渝,聂敏海
(1.西南医科大学附属口腔医院牙周黏膜科,四川 泸州 646000;2.西南医科大学口颌面修复重建和再生实验室,四川 泸州 646000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,而舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)又是OSCC中最常见的类型,其主要特点为进展迅速、浸润范围广、预后差[1]。影响TSCC预后最重要的因素是原位侵袭和远处转移。因此,抑制肿瘤的侵袭和转移是TSCC防治的关键。Src基因是最早发现的有内在酪氨酸激酶活性的人类癌基因。Src激酶是一种不需要受体和膜相关信号转导的蛋白激酶,对肿瘤细胞的分化、增殖和侵袭均有调控作用,其异常活化与肿瘤的高转移性和预后不良关系密切[2]。本研究旨在探讨Src蛋白激酶抑制剂PP2对TSCC Tca8113细胞侵袭和迁移能力的影响。
1 材料与方法
1.1细胞来源人TSCC Tca8113细胞株由西南医科大学口颌面修复重建和再生实验室提供。
1.2主要试剂与仪器Src激酶抑制剂PP2购自Selleck中国上海蓝木化工有限公司,磷酸缓冲盐溶液(phosphate buffer saline,PBS)、二甲基亚砜(dimethyl sulphoxide,DMSO)、胎牛血清购自北京索莱宝生物科技有限公司,改良型PRMI-1640培养液、胰蛋白酶消化液购自北京赛默飞世尔生物化学制品有限公司,Matrigel基质胶、FACSverse流式细胞仪购自美国BD公司,Transwell 小室购自美国Corning 公司,Thermo Multiskan Go型全自动酶标仪购自Thermo中国科技公司,MCO-15AC型 CO2细胞培养箱购自日本三洋公司,KDC-1044型低速离心机购自安徽中科中佳仪器有限公司。
1.3实验方法
1.3.1细胞培养将Tca8113细胞置于含体积分数10%胎牛血清和质量分数1%青链霉素RPMI-1640培养液中,于含体积分数5%CO2、37 ℃饱和湿度条件下培养,1~2 d换液1次,观察细胞的生长情况,取对数生长期细胞进行实验。
1.3.2PP2溶液配置Src激酶抑制剂PP2溶于DMSO中,将其配制成浓度为1 mmol·L-1的溶液,使用时以不含血清的培养液稀释,获得1、5、10、20 μmol·L-1的工作液。
1.3.3划痕实验检测Tca8113细胞的迁移能力取对数生长期细胞,调整其密度为5×108L-1,接种于6孔板,每孔2 mL,置于含体积分数5%CO2、37 ℃ 培养箱中培养,待细胞贴壁并生长融合至约90%时,以200 μL微量移液枪枪头垂直于细胞表面均匀划痕,PBS洗涤去除脱落细胞。将细胞分为0、1、5、10、20 μmol·L-1PP2组,分别加入含0、1、5、10、20 μmol·L-1PP2的体积分数1%胎牛血清培养液,每组设2个复孔;将6孔板置入37 ℃含体积分数5%CO2培养箱中培养。于培养24 h时,用倒置显微镜拍照,计算细胞迁移率。细胞迁移率=(原划痕宽度-现划痕宽度)/原划痕宽度×100%。
1.3.4Transwell迁移实验检测Tca8113细胞的迁移能力取对数生长期细胞,PBS洗涤3次,消化、收集细胞,调整其密度为 5×108L-1的单细胞悬液,将细胞分为0、1、5、10、20 μmol·L-1PP2组,Transwell小室上室内加入含0、1、5、10、20 μmol·L-1PP2的无血清单细胞悬液200 μL,下室加入600 μL培养液,将24孔板置于37 ℃含体积分数5%CO2培养箱中孵育24 h后,分别取出 Transwell 小室,PBS清洗,甲醛固定 30 min,清洗,自然晾干,体积分数0.1%结晶紫染色 20 min,PBS清洗,以棉签小心擦除滤膜上面的细胞,200倍光学显微镜下计数,计算穿膜细胞数。实验重复3次,取均值。
1.3.5Transwell小室法检测Tca8113细胞的侵袭能力Transwell小室的滤膜孔径为8 μm,基质胶 4 ℃ 过夜冻融,将Matrigel基质胶用不含血清的RPMI-1640培养液按18的比例稀释,取100 μL铺在transwell小室的上室中,均匀铺满小室底部的聚碳酯膜上,并置于37 ℃含体积分数5% CO2培养箱中孵育2 h后,水化基底膜15 min。取对数生长期细胞,PBS洗涤3次,消化、收集细胞,得到密度为 5×108L-1的单细胞悬液,并将细胞分为0、1、5、10、20 μmol·L-1PP2组。Transwell小室上室内分别加入含0、1、5、10、20 μmol·L-1PP2的无血清单细胞悬液200 μL,下室加入600 μL培养液,将24孔板置于37 ℃体积分数5%CO2培养箱中孵育24 h后,分别取出Transwell小室,PBS清洗,甲醛固定30 min,清洗,自然晾干,用体积分数0.1%结晶紫染色 20 min,PBS清洗,以棉签小心擦除滤膜上面的细胞,200倍光学显微镜下计数,计算细胞侵袭个数。实验重复3次,取均值。
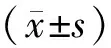
2 结果
2.1PP2对人TSCCTca8113细胞迁移能力的影响结果见表1。PP2作用24 h时,0、1、5、10、20 μmol·L-1PP2组细胞迁移率组间两两比较差异均有统计学意义(P<0.05),且随PP2浓度的增加细胞迁移率逐渐降低;PP2作用Tca8113细胞 24 h 后,0、1、5、10、20 μmol·L-1PP2组穿膜细胞数组间两两比较差异均有统计学意义(P<0.05),且随着PP2浓度的增加穿膜细胞数逐渐减少;见图1。

A:0 μmol·L-1PP2组;B:1 μmol·L-1PP2组;C:5 μmol·L-1PP2组;D:10 μmol·L-1PP2组;E:20 μmol·L-1PP2组。
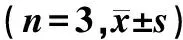
表1 各组Tca8113细胞迁移能力的比较
注:与0 μmol·L-1PP2组比较aP<0.05;与1 μmol·L-1PP2组比较bP<0.05;与5 μmol·L-1PP2组比较cP<0.05;与10 μmol·L-1PP2组比较dP<0.05。
2.2PP2对人TSCCTca8113细胞体外侵袭能力的影响0、1、5、10、20 μmol·L-1PP2组细胞侵袭个数分别为240.4±19.0、188.5±16.1、148.3±30.9、113.0±9.0、41.6±14.4。0、1、5、10、20 μmol·L-1PP2组细胞侵袭个数组间两两比较差异均有统计学意义(P<0.05),且随PP2浓度的增加细胞侵袭个数逐渐减少。
3 讨论
口腔颌面部恶性肿瘤中约90%为OSCC,其中约70%为TSCC[3]。TSCC的高侵袭性和高转移性导致其病死率和复发率较高,每年确诊的TSCC病例中约50%死亡,患者5 a生存率仍然很低[4],侵袭和远处转移是造成其死亡最重要的因素。而实现浸润和转移的主要原因是恶性肿瘤细胞的黏附能力降低使其迁移能力增强[5-6]。
目前,TSCC的治疗方法主要采用手术治疗为主,辅以放射、化学治疗的综合性序列治疗。这些传统的治疗方法对患者创伤大,并发症多,易复发和转移。目前为止,尚未找到治疗TSCC的新靶点来替代传统治疗。
Src激酶为非受体酪氨酸蛋白激酶,目前发现的家族成员有11个,分别为Brk、Blk、Frk、Fyn、Fgr、Hck、Lyn、Lck、Src、c-Src和 Yes[7],Src蛋白是原癌基因 c-Src的主要产物,也是目前研究最多的成员之一。有研究表明,c-Src和SFKs参与了前列腺癌、结肠癌、卵巢癌、肺癌等恶性肿瘤的发生、发展[ 8-9]。Src参与多种信号通路,可能对肿瘤细胞的增殖、分化、黏附及侵袭有调控作用,其高表达或表达异常与肿瘤的高转移性和预后不良密切相关[10],抑制Src激酶的活性可抑制多种恶性肿瘤细胞的增殖、侵袭和转移。PP2是一种广泛使用的阻断非受体型酪氨酸激酶Src活性的复合物[11],也是Src激酶的选择性抑制剂。杜军等[12]研究发现,在乳腺癌细胞中,PP2可使肿瘤细胞的运动和黏附能力减弱,可能是由于肌动蛋白细胞骨架解聚,细胞极性消失导致的。CHIANG等[13]研究发现,Src激酶抑制剂PP2可抑制膀胱癌细胞的体外侵袭能力,且有浓度依赖性;PP2对膀胱癌细胞的侵袭作用可能是由蛋白激酶B信号通路介导的,蛋白激酶B活性的降低导致膀胱癌细胞体外侵袭能力减弱。但关于PP2对口腔鳞状细胞癌的作用研究鲜有报道。因此,本研究通过Src激酶抑制剂PP2干预TSCC Tca8113细胞,检测其侵袭和迁移能力的变化,以期为寻找抗肿瘤治疗的新靶点提供理论依据。
本研究结果显示,PP2对Tca8113细胞的侵袭能力有抑制作用,且随浓度的增加抑制效果越明显。Transwell迁移实验结果显示,在一定浓度范围内,随着PP2干预浓度升高,细胞迁移率逐渐降低,该结果与划痕实验结果相一致,由此可推测Src激酶抑制剂PP2能明显抑制人TSCC Tca8113细胞的迁移能力。
综上所述,Src激酶抑制剂PP2对TSCC Tca8113细胞的侵袭和迁移能力有抑制作用,但PP2 具体通过什么信号通路来减弱肿瘤细胞的侵袭和迁移能力目前尚不清楚。吴向晖等[14]研究发现,miR-320 可通过靶向 Rab11 调控宫颈癌SiHa细胞的增殖、侵袭及迁移,PP2是否也是通过miR-320 的调控来抑制TSCC Tca8113细胞的侵袭和迁移,有待进一步研究。
