固相萃取/18O标记高氯酸根稀释高效液相色谱-三重四极杆质谱法测定茶叶中高氯酸盐
2018-09-03姚清华柯秋璇林永辉颜孙安
姚清华, 柯秋璇, 李 捷, 林 虬, 林永辉, 颜孙安
(1.农业部农产品质量安全风险评估实验室(福州),福建福州 350003;2.福建省农业科学院农业质量标准与检测技术研究所,福建福州 350003;3.福建出入境检验检疫局技术中心,福建福州 350001)
我国是茶叶生产、消费和出口大国。近期,欧盟将干燥茶叶中高氯酸盐的参考限量定为0.75 mg/kg,因此,茶叶中高氯酸盐含量引起社会广泛关注[1]。高氯酸盐具高溶解度和低吸附性,导致其易溶于水,可通过水环境系统扩散,经植物吸收富集后,通过食物链进入人体,是一种持久性的化学污染物。由于高氯酸盐与碘结构相似,可妨碍甲状腺对碘的吸收,导致甲状腺激素T3、T4合成量减少。甲状腺激素减少可对儿童的生长发育产生不良影响,尤其是对胎儿和婴儿的大脑发育有负面影响[1 - 2]。
目前,高氯酸盐的检测方法主要有离子色谱法[3]、离子色谱-质谱联用法[2,4 - 7]、液相色谱-串联质谱法[8 - 9]等。本文采用液相色谱-串联质谱法,结合同位素18O标记高氯酸根作为内标,可有效消除前处理过程带来的影响,减少测量干扰,有效解决茶叶复杂基质对高氯酸盐测定的影响。该方法分别经红茶、绿茶、乌龙茶3种茶叶,以及多份实际样品检测分析验证,具有经济实惠、稳定性好、灵敏度高等优点。
1 实验部分
1.1 仪器及试剂
LC-20AD液相色谱-AB 4000三重四极杆质谱仪(日本,岛津公司);SYNERY UV超纯水器(美国,密理博公司);IKA-MS3漩涡振荡器(德国,IKA公司);TDL-40B离心机(上海安亭科学仪器厂);50 mL聚丙烯离心管(德国,Greiner公司);C18固相萃取小柱(3 mL/500mg,美国Superlco公司),经甲醇、水活化后备用。
高氯酸钠标准溶液(美国O2Si公司)。高氯酸钠18O4内标(标准品,CIL公司);甲酸(色谱纯,Merck公司);乙酸铵(分析纯,Fisher公司);甲醇、乙腈(分析纯,国药集团化学试剂有限公司)。实验用的试剂和标准溶液存储容器均用30%HNO3预处理。实验用水为超纯水。
1.2 实验方法
1.2.1标准溶液配制准确吸取高氯酸钠标准溶液,置于容量瓶中,用超纯水定容,浓度为100 mg/L 4 ℃ 保存备用。标准工作溶液:吸取适量标准储备溶液,用水配制成系列浓度的标准工作溶液,浓度依次为0、1.0、2.0、5.0、10.0、20.0 ng/mL,现用现配。0.2%甲酸和5 mmol/L乙酸铵溶液:称取0.315 g乙酸铵,用水溶解,加入2 mL甲酸,移入1 L容量瓶中,加水至刻度,摇匀备用。
1.2.2样品提取与净化称取1 g(精确至0.01 g)茶叶样品至50 mL离心管中,加入0.1 mL 1.0 mg/L的内标溶液,加入20 mL提取溶剂(500 mL超纯水和500 mL甲醇混合溶液),振荡提取30 min。以5 000 r/min离心5 min。吸取1 mL上清液经C18固相萃取小柱净化,收集流出液,经0.22 μm尼龙滤膜过滤后,待进样分析。
1.2.3液相色谱-三重四极杆质谱条件色谱条件:Phenomenex Luna Hillic色谱柱(100×2 mm,3 μm)。流动相:A为5 mmol乙酸铵水溶液(含0.2%甲酸);B为甲醇,梯度洗脱:初始为5%A,保持1.5 min,在0.5 min内,线性变换为40%A,保持3 min;在1 min内,线性变换为5%A,保持1 min;全程共6 min。流速始终保持0.4 mL/min。进样量:5 μL;柱温:40 ℃。质谱条件:电喷雾电离,负离子模式(ESI-);多反应监测(MRM)模式检测;气帘气压力(CUR):25.0 kPa;雾化气压力(GS1):50.0 kPa;辅助加热气压力(GS1):50.0 kPa;碰撞气压力(CAD):Medium;电喷雾电压(IS):-1 000 V;离子源温度(TEM):550 ℃;监测离子对、碰撞能量、去簇电压、采集时间和保留时间见表1。

表1 高氯酸盐的质谱分析参数
2 结果与讨论
2.1 样品前处理方法的选择
2.1.1提取溶剂的优化实验分别采用水、乙酸、乙腈、甲醇对茶叶中高氯酸盐进行提取。实验结果表明,采用50%甲醇溶液提取时效果最好,3种茶叶中高氯酸盐回收率稳定(102.5%~105.3%),相对标准偏差(RSD)小(1.2%~2.8%)。其它的提取溶剂存在回收率不稳定或本底干扰明显的现象。因此选取甲醇/水为最佳提取剂。同时,为避免前处理使用的水存在的本底污染,在实验前应对实验用水进行验证。
2.1.2净化柱的选择本实验对比了C18固相萃取柱、石墨碳黑柱和HLB柱对3种茶叶中高氯酸盐提取液的净化效果。C18固相萃取可有效去除提取液中的茶叶色素和大分子类干扰物质,效果明显优于石墨碳黑柱和HLB柱,且回收试验理想,具有操作时间短,预处理过程简单、费用低、重现性好等优点。因此,本实验选择C18固相萃取柱为净化柱。
2.2 色谱与质谱条件的优化
实验以5 mmol/L乙酸铵水溶液(含0.2%甲酸)-甲醇为流动相,梯度洗脱,对准分子离子峰进行二级质谱分析,分析碎片离子信息,以响应值高、基线噪音值低的离子对m/z98.9/83.0,100.9/85.0(定性离子对),选择信号最强的m/z98.9/83.0作为定量离子对。结果表明,采用甲醇替代乙腈为流动相,可以去除水中高氯酸盐的本底影响。
根据高氯酸盐的结构特征,选择电喷雾(ESI)离子源,在负离子模式下高氯酸丢失1个氧原子,故以m/z98.9/83.0作为高氯酸盐的定量离子对。同时,对气帘气压力、雾化气压力、辅助加热气压力、碰撞气压力、电喷雾电压等参数进行了优化,获得了分子离子m/z98.9与特征碎片离子m/z83.0的最佳灵敏度。高氯酸标准溶液及茶叶样品的总离子流色谱图如图1所示。
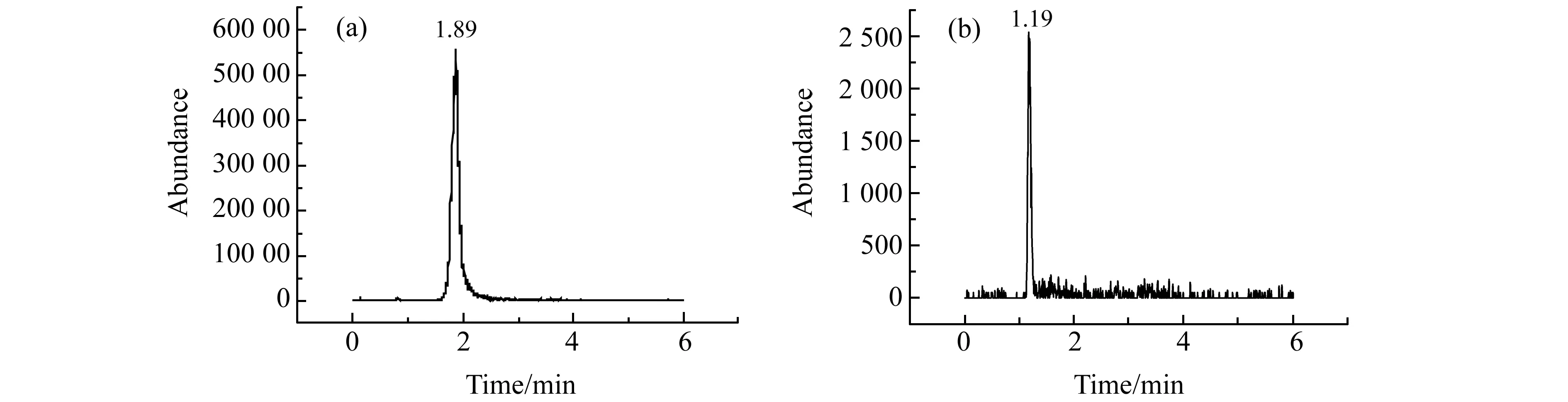
图1 高氯酸盐标准溶液(a)及茶叶样品(b)的HPLC-MS/MS总离子流(TIC)图Fig.1 TIC of perchlorate standard(a) and tea sample(b)
2.3 方法的评价
2.3.1方法的线性范围将不同浓度的高氯酸盐标准溶液进行HPLC-MS/MS分析,以峰面积(y)与对应高氯酸盐质量浓度(x,ng/mL)绘制标准曲线。高氯酸盐在1.0~20.0 ng/mL范围内线性关系良好,高氯酸盐与峰面积呈良好的线性关系:y=0.287x,相关系数r=0.9999。
2.3.2方法准确度和精密度分别向3种茶叶样品中添加20、100、200 ng/mL 3个不同质量浓度的高氯酸盐标准溶液,按优化后的方法重复测定6次。扣除茶叶本底后,样品中高氯酸盐的含量、加标回收率及精密度(RSD)如表2示。
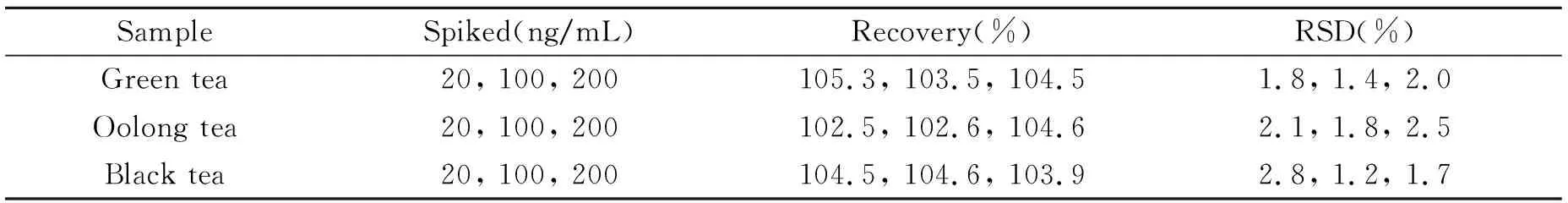
表2 茶叶样品中高氯酸盐含量、加标回收率及精密度(n=6)
2.3.3方法检测限和定量限在优化条件下,分别按信噪比(S/N)>10和信噪比(S/N)=3计算,高氯酸盐的定量限为0.02 mg/kg,高氯酸盐在茶叶中的检测限为0.006 mg/kg。本方法的定量限远低于欧盟规定的高氯酸盐在茶叶中的参考残留限量值0.75 mg/kg,能够满足我国茶叶中高氯酸盐的检测要求。
2.4 方法的应用
将该方法用于60份绿茶、60份红茶和109份乌龙茶的测定,人员及实验室间比对结果表明,该方法重现性好,稳定、可靠。
3 结论
本文以同位素18O标记高氯酸根作为内标,建立了固相萃取-高效液相色谱/串联质谱法测定茶叶中高氯酸盐含量的方法。该方法简单、快速、灵敏,有效解决了茶叶基质较复杂的问题,具有良好的净化富集效果和较高的回收率。
