基于微流控芯片的荧光定量PCR法快速检测乙肝病毒核酸
2018-09-03王可可朱灿灿
王可可, 杨 柯, 赵 俊, 朱灿灿, 朱 灵*, 刘 勇
(1.中国科学院合肥物质科学研究院应用技术研究所,安徽省生物医学光学仪器工程技术研究中心,安徽省医用光学诊疗技术与装备工程实验室,安徽合肥 230031;2.中国科学技术大学,安徽合肥 230026)
血液病毒感染是一个严峻的全球性问题,而血站在确保输血安全这一过程中扮演着非常重要的角色。常规的血液病毒筛查方法,如酶联免疫分析(ELISA)方法,其检测灵敏度低且病毒检测的“窗口期”较长[1]。为此,人们发展了核酸扩增检测(NAT)方法,与传统的免疫学筛查方式相比,NAT具有高度的灵敏性和特异性,可大幅降低病毒检测“窗口期”,有效弥补了ELISA方法中病毒变异、免疫静默等原因造成的漏检[2],现已被广泛应用于血站血液核酸病毒的筛查[3]。
目前省级中心血站的NAT检测设备,如罗氏Cobas s201系统、诺华(chiron)TIGRIS全自动核酸检测分析系统、上海浩源ChiTaSBSS1200核酸血液筛查系统,他们共同特点是主要由混样仪、核酸提取仪和荧光定量聚合酶链式反应(Polymerase Chain Reaction,PCR)仪等组成,价格昂贵,且存在检测步骤繁琐、检测成本高等问题,不利于推广应用。特别是难以满足即时诊断(POCT)方面的需求,因此,研发一种自动化、低成本且适宜于中小型血站使用的新型核酸分析设备十分重要。
微流控芯片技术经过多年的发展已成为一种理想低成本检测平台[4],在生命科学领域,尤其是在核酸检测方面得到了广泛的应用[5]。与此同时,随着3D打印技术的发展,使得微流控芯片上实现结构的灵活设计与快速制备成为可能[6]。本研究采用3D打印和聚二甲基硅氧烷(PDMS)注塑模技术,制作了一种集成芯片气动阀和“树型”结构为一体的微流控芯片,对芯片进行了热力学仿真,并结合实验室自主开发的微流控荧光定量PCR分析系统,实现了血液中HBV病毒的快速检测。
1 实验部分
1.1 仪器及试剂
Objet 30Pro 3D打印机(美国,Stratify公司);PDC-32G等离子清洗机(美国,Harrick公司);自制实时荧光定量PCR扩增分析仪,其荧光检测系统检测波长为510 nm,温控精度为0.1 ℃[7];KW-4A型台式匀胶机(中国)。
聚二甲基硅氧烷(PDMS,Sluggard 184,美国DowCorning公司);乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)(1型)核酸检测试剂盒(PCR-荧光法,上海浩源生物科技有限公司);无水乙醇(分析纯,国药集团化学试剂公司);硅油(美国Sigma公司);血液样本由安徽省血液中心提供。
HBV、HCV、HIV特异性引物和Taqman探针的设计:针对HBV、HCV、HIV基因序列的保守区域,设计扩增这3种病毒特异性引物和Taqman水解探针,用于对应基因片段的扩增,引物和探针均由生工生物工程(上海)股份有限公司合成,其序列见表1。
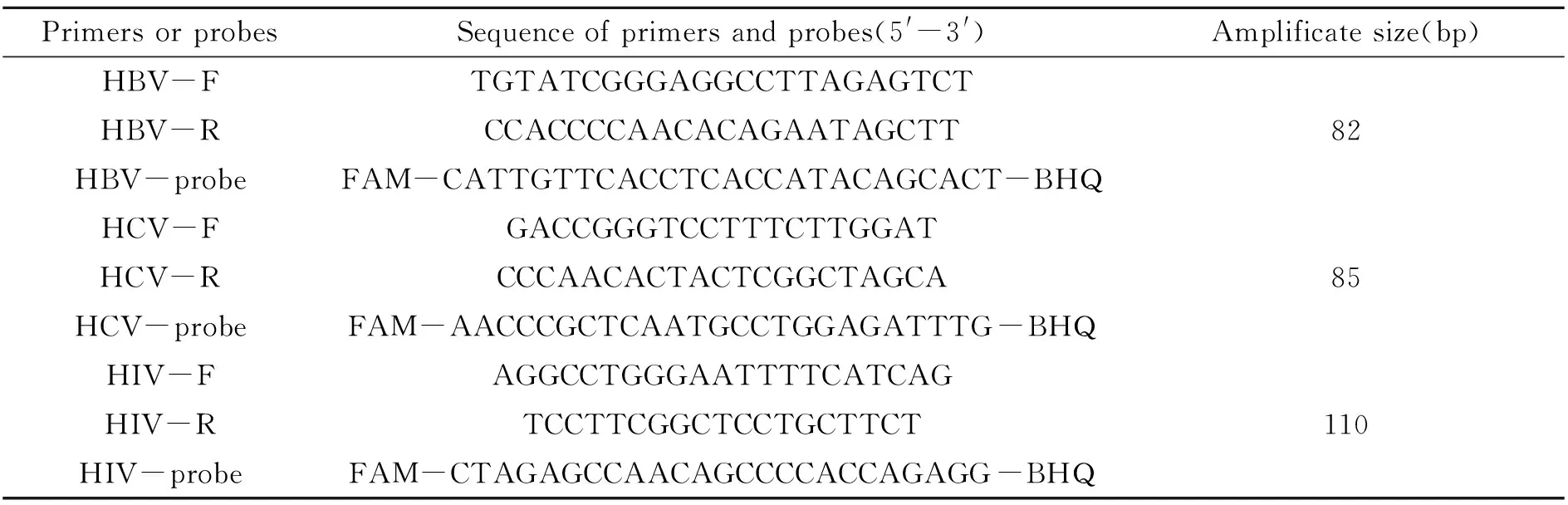
表1 HBV、HCV、HIV实时荧光定量PCR/RT-PCR引物和探针
1.2 芯片设计
芯片借鉴经典的“三明治结构”设计[8],分为四层。如图1(A)中所示:上层为芯片的气路控制层;第二层为PDMS薄膜用于微阀的封闭和开启;第三层为芯片的液路层;底层则为玻璃基底。芯片整体功能如图1(B)所示,分布有主通道、分支通道、反应腔和废液腔;芯片大小32×38×4 mm,其中主通道长30 mm,高0.5 mm,负责样品的进样;分支通道负责分流试剂到反应腔;每个反应腔体积约为15 μL,两端均设有微阀和排气孔,用来控制反应腔试剂进样和密封;废液腔则用来储存多余的废液。针对血站血液筛查检测对象及流程,在芯片上设置六个独立的反应腔1~6分别作为HBV、HCV、HIV三种病毒的阴性和阳性对照腔,其余反应腔分为3组分别作为三种病毒检测实验的复孔。

图1 (A)微流控芯片结构示意图;(B)微流控芯片功能示意图Fig.1 (A)Structure schematic of microfluidic chip;(B)Features schematic of microfluidic chip
1.3 芯片制备
使用Soildworks软件设计微流控芯片所需模具结构,使用3D打印机打印芯片模具[9],设置打印精度为16 μm。微流控芯片制备采用注塑法。PDMS前聚体和促凝剂以10∶1比例均匀混合后置于真空抽气泵中除去气泡备用。将PDMS倒入芯片模具并置于100 ℃恒温烘箱中烘烤固化2 h,以制备微流控芯片上下基片;同时缓慢倾倒约1 mL PDMS在4英寸的硅基片中央,置于匀胶机中,设置初始转速为500 r/min,保持时间18 s,随后升高转速至700 r/min,保持55 s,最后将硅片放入烘箱中烘烤10 min以制备微流控芯片薄膜。从模具上取出PDMS上下芯片和PDMS薄膜,并用氧等离子清洗机处理45 s,使芯片永久键合。
前期实验发现反应腔体内进行PCR反应时通常会产生气泡,造成不同反应腔体之间反应液串样或反应液从排气孔处泄露。为提高实验成功率,推荐在实验开始前注入去离子水预先浸润芯片1 h[10]。
1.4 芯片热力学仿真
PCR过程有3个不同的温度阶段,而反应容器良好的导热性和温度均匀性是微流控芯片上能否成功进行PCR的关键。因此,本研究针对所设计芯片进行热力学仿真,探究芯片在特定温度下的导热性能和温度均匀性。将芯片的Solidworks源文件转换为SLDPRT格式并导入到Comsol仿真软件的几何模型之中,对芯片加载不同材料并设置导热的边界条件和求解域,其中芯片材质分别设置为PDMS(厚度3.7 mm)和玻璃(厚度0.3 mm),并基于PCR过程的3个温度阶段设置芯片底面温度曲线,仿真特定温度下设计微流控芯片的导热性和温度均匀性,其中温度设置如图2(A)曲线所示,芯片材料设定如图2(B)和图2(C)所示。

图2 (A)仿真时施加的温度场曲线;(B)芯片几何模型中的PDMS材质部分;(C)芯片几何模型中的Glass材质部分Fig.2 (A)The temperature field curve applied in the simulation;(B)PDMS material components in the chip geometry model;(C)Glass material components in the chip geometry model
1.5 PCR实验设置
将对照组反应试剂加入到1~6号独立反应腔,并进行封闭。然后,将HBV、HCV、HIV实时荧光定量PCR/RT-PCR引物和探针分别预埋到反应腔7和8、9与10、11和12中,打开每个反应腔两端的微阀,将从血液样品中提取出的核酸溶液与PCR扩增试剂混匀后,从加样孔注入到主通道内,反应液会在芯片的亲水性和压力作用下依次填充反应腔,关闭微阀,封闭反应腔排气孔,再注入硅油充盈主通道以隔离反应腔。进样完成后,将芯片置于自行研制的实时荧光定量PCR扩增仪内,于热层上均匀涂抹导热硅脂以增强芯片温度均匀性。设置PCR扩增反应参数,程序为:37 ℃,2 min,1个循环;50 ℃,5 min,1个循环;42 ℃,35 min,1个循环;94 ℃,10 min,1个循环;随即扩增45个循环(94 ℃,10 s;55 ℃,15 s;65 ℃,45 s)。整个扩增实验中CCD相机于每个循环内65 ℃ 结束时完成芯片荧光信号的采集,并实时分析处理数据绘制扩增曲线。
2 结果与讨论
2.1 热力学仿真
对PCR过程中不同温度阶段(94 ℃、55 ℃、65 ℃)的芯片进行了热仿真分析,三个温度阶段内芯片的温度均匀性和导热性能良好。图3(A)所示是94 ℃条件下芯片整体温度仿真结果,12个反应腔无温度差异,性能高度一致,芯片温度均匀性良好;图3(B)是此条件下芯片的等温面,等温面的形成与芯片的高度密切相关,反应腔所在高度可保证最大的温度传递性能,使得反应腔温度与芯片基底温度保持同步。但此时芯片反应腔最高温度只有366.22 K比预设的温度94 ℃(367.15 K)低了0.93 ℃左右,说明芯片内部温度相较于预设温度会略有偏低,此点符合实际条件下芯片的导热情况,说明仿真结果的可靠性。在实际温控过程中,通常会在温控算法的缺省温度条件设置时通过调节PID参数,将不同温度阶段的初始温度设置偏高,使得芯片反应腔温度最大程度上与图2(A)中理想的温度曲线一致。
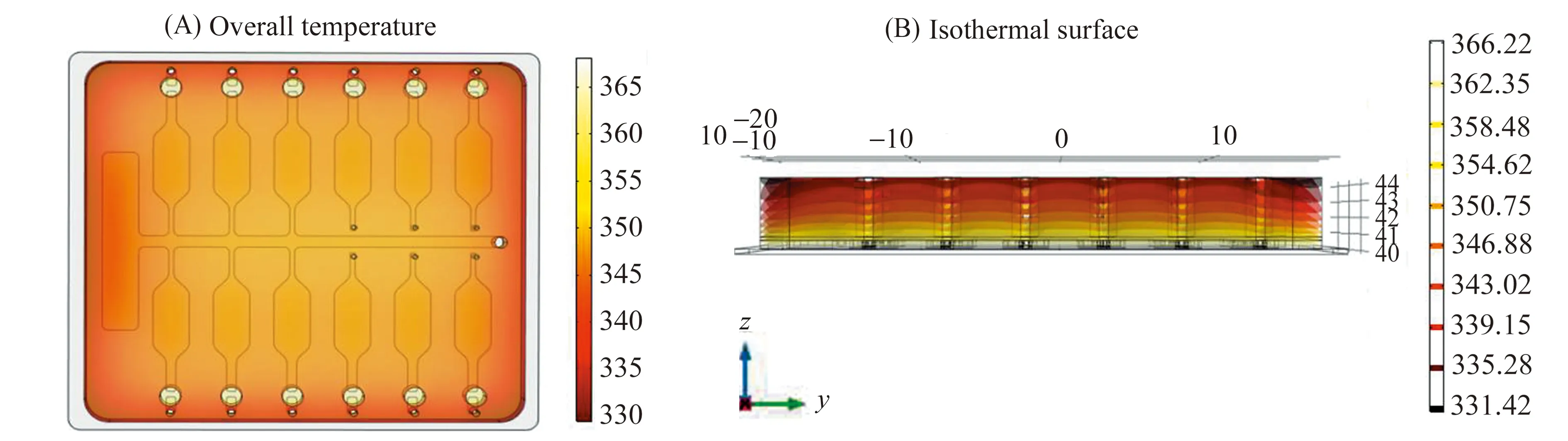
图3 微流控芯片热仿真结果Fig.3 Results of microfluidic chip thermal simulation
2.2 核酸检测
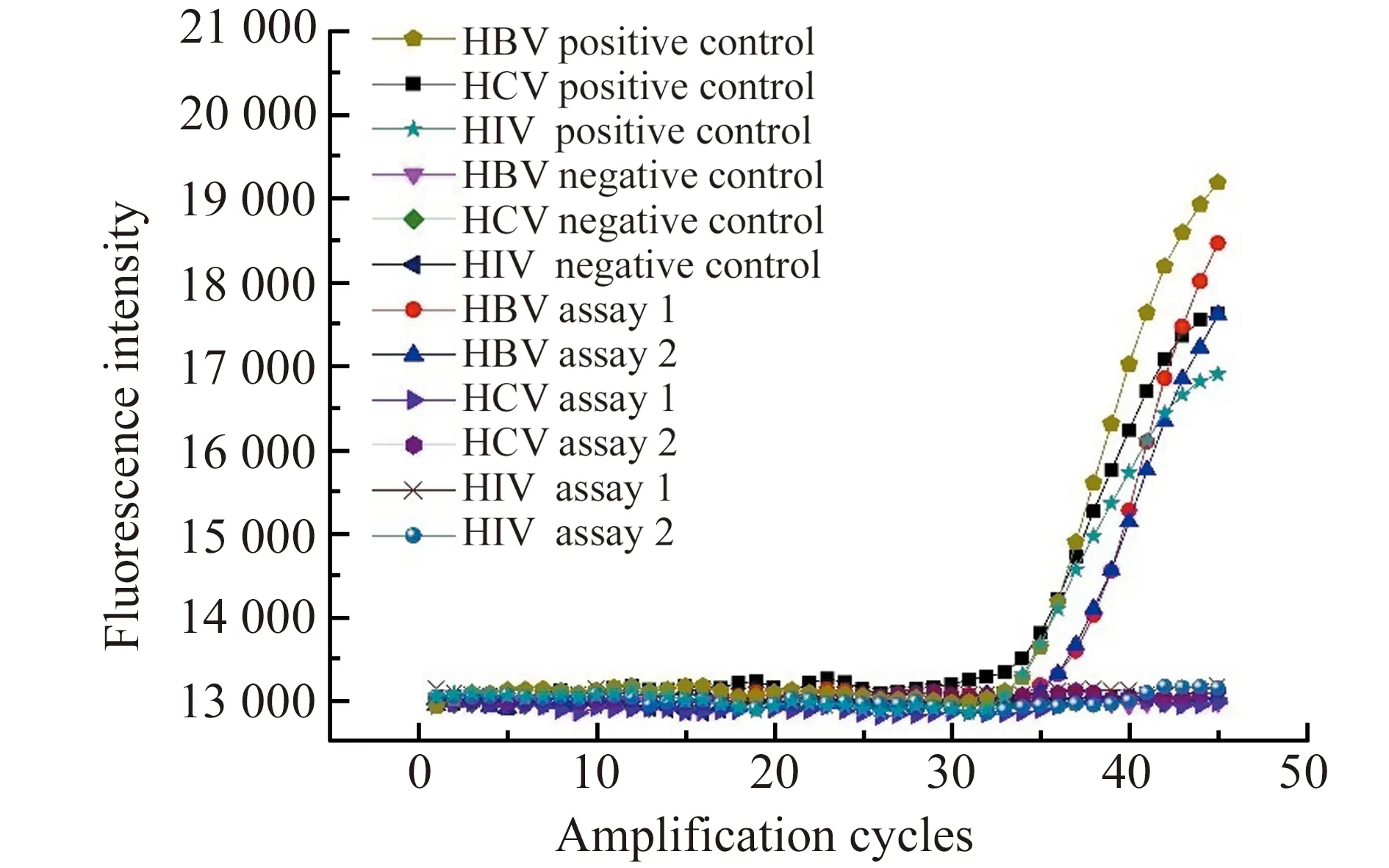
图4 扩增曲线Fig.4 Amplification curves
芯片上病毒核酸扩增结果如图4所示,可以看出腔体1、3、5中HBV、HCV、HIV三种病毒阳性对照均得到有效扩增;相对应的,腔体2、4、6中阴性对照则无扩增,说明整个测试结果满足质控要求。对于待测样本的检测结果,可以观测到HBV引物探针对应的腔体7和8中荧光信号逐渐增强;而HCV引物探针对应的腔体9和10,HIV引物探针对应的腔体11和12中荧光信号均无明显变化,表明该血液核酸样品中含有HBV DNA,通过实时计算,确定其Ct值在37左右,检测结果呈HBV弱阳性。因此,可以初步表明该型芯片可以用于血液筛查中病毒核酸的检测。
3 结论
设计的微流控芯片导热性能和温度均匀性良好,在芯片上成功检测出血液样本中的HBV。实验结果表明,血液样本荧光PCR扩增的Ct值约为37,呈HBV弱阳性。本研究受限于难以获得HCV和HIV阳性样本,因此,未能在该型芯片上完成对HCV和HIV的测试,但对这两种病毒在微流控芯片上的检测仍具有很大的参考性,并可进一步优化芯片设计,实现多种病毒核酸的并行检测,为后续微流控芯片上集成化血液核酸检测系统研究打下了基础,在血站血液病毒核酸检测和术前血液筛查等即时诊断方面有很好的应用前景。
