1,4,5,8-萘四甲酸二酰亚胺纳米荧光探针的制备及应用
2018-09-03张海容高登辉陈金娥
张海容, 高登辉, 刘 佳, 陈金娥
(山西省忻州师范学院生化分析技术研究所,山西忻州 03400)
三聚氰胺的含氮量高达66.6%,因此,将其违法掺入蛋白性饲料或食品中以提高蛋白质含量,降低生产成本[1]时有发生。我国颁布了数项三聚氰胺检测标准[2 - 4],规定了高效液相色谱法、气相色谱-质谱法、液相色谱-串联质谱法为三聚氰胺的检测方法,其定量限分别为2.0×10-3、5.0×10-5和1.0×10-5g/L。目前,三聚氰胺的检测方法主要包括质谱法[5 - 7]、高效液相色谱法[8]、中和近红外光谱[9]、聚二乙炔脂质体的相互作用[10]、离子交换色谱法[11]、酶联免疫吸附法[12]、表面增强拉曼光谱法[13]等。这些方法一般需要通过大型仪器测定,成本昂贵,不适合快速、简便分析。目前,用纳米荧光探针对三聚氰胺进行检测鲜有报道[14],但未见用1,4,5,8-萘四甲酸二酰亚胺(1,4,5,8-Naphthaleneteracarbox-diimide,NTCD)纳米荧光探针检测乳制品中三聚氰胺的报道。
本文通过真空气相沉积-分子自组装法[15 - 19]合成了NTCD纳/微米线,进一步研究其光电性质,发现NTCD纳米材料是优良的传感器转导材料,据此建立了NTCD纳米荧光探针检测奶粉中三聚氰胺的分析方法。方法处理过程简便,检出限低于国家标准的液相色谱法,适合于各类乳品、食品分析。
1 实验部分
1.1 主要仪器、试剂和材料
F-4600型荧光光度计(日本,日立公司);UV-1800紫外-可见分光光度计(日本,岛津公司);傅立叶变换红外光谱仪(日本,岛津公司);AB-204N电子分析天平(梅特勒-托利多仪器(上海)有限公司);JEOL-2000EX型透射电子显微镜(日本,电子公司);JSM-6700F型扫描电子显微镜(日本,电子公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司)。
1,4,5,8-萘四甲酸二酰亚胺(Fluka,>97%);无水乙醇(分析纯);三聚氰胺(分析纯,天津市光复精细化工研究所);实验用水为二次蒸馏水。
奶粉样品Ⅰ(批次:134141.60,古城牌婴幼儿配方奶粉,山西古城乳业有限公司,山西山阴县),奶粉样品Ⅱ(批次:4226.30、4279.17,雅士利牌婴幼儿配方奶粉,山西雅士利乳业有限责任公司,应县雅士利工业园),均购自本地团结超市。
1.2 实验方法
1.2.1纳米材料的制备在真空条件下,干态有机分子在沸点附近十分容易蒸发[15],将粉末状的原材料加热到沸点以上,固态有机分子直接升华为气体分子,由于处于真空环境,高温条件下NTCD分子不会被氧化,分子通过分子间的范德华力自组装形成结构稳定的聚集体,沉积到玻璃基质上,形成纳米结构[18],有关与基质的作用机理尚不清楚。通过控制实验操作条件(如温度、时间),有机纳米材料的制备简便易行。将装有5 mg NTCD的粉末和载玻片放入真空封口的试管后,置于马弗炉中,使用P型8步斜坡PID温度程控器设置程序加热,开始斜坡升温的温度设置为35 ℃,相对功率修正系数为1,最大相对功率70%,移相步幅上限10%,升温速度5 ℃/min,600 ℃恒温加热1 h。
1.2.2纳米材料的表征待马弗炉程序加热结束后,在玻璃管中取出载玻片,室温冷却,进行电子显微镜扫描;从载玻片上刮下纳米材料,用干燥的KBr压片,进行傅立叶变换红外光谱扫描,扫描范围是500~4 000 cm-1;刮下纳米材料后,用超声乙醇溶解,储存备用。用F-4 600型荧光光度计、狭缝宽度10/10 nm测定其荧光强度;用12.5 mm厚度石英比色皿在UV-1 800紫外-可见分光光度计扫描紫外光谱。
1.2.3不同物质对NTCD纳米材料的荧光猝灭扫描将纳米材料从玻璃片刮下,与少量乙醇混合后,超声溶解直至溶液透明,乙醇定容至100 mL,NTCD浓度为0.28 μg/mL。移取1 mL 0.28 μg/mL NTCD,置于10 mL比色管中,依次分别加入1.0×10-5mol/L的金属离子Ca2+、Mg2+、Al3+、Zn2+、Co2+、Fe3+和葡萄糖、甘氨酸、丙氨酸、苏丹Ⅲ、溶菌酶、牛血清蛋白、咖啡因、三聚氰胺、三聚氰酸、茶多酚等化合物溶液1 mL,2 mL 的pH=5.27三酸缓冲溶液,用乙醇定容至刻度,在F-4600型荧光光度计上、用1 cm荧光比色皿、狭缝宽度10/10 nm,激发和发射波长分别为λex/λem=389/498 nm测定荧光强度的变化值ΔF(ΔF=F0-F)。
1.2.4样品处理按文献方法[13]略有改进:称取0.2 g奶粉样品于比色管中,依次加入5.0 mL 1%三氯乙酸和2.0 mL乙睛,超声30 min,使蛋白质沉淀,溶液以9 000 r/min的转速离心15 min后,上清液用0.45 μm微孔滤膜过滤,收集滤液于25 mL容量瓶中,并用水定容至刻度,样品待测。
2 结果与分析
2.1 纳米材料扫描电镜和透射电镜图
由图1、图2对比可知,扫描电镜(SEM)显示NTCD原料呈块状结构,纳米材料主要形成带状结构,直径约在80~200 nm左右,长度大约为5~10 μm。纳米材料的透射电镜图见图3。

图1 NTCD原料扫描电镜(SEM)图Fig.1 SEM image of NTCD raw materialsConditions:thermal vacuum vapor deposition;heating temperature and time:600 ℃,1 hour.

图2 NTCD纳米材料的扫描电镜图Fig.2 SEM image of NTCD nanomaterialsConditions:thermal vacuum vapor deposition;heating temperature and time:600 ℃,1 hour.
2.2 纳米材料红外光谱
红外光谱测定显示,形成纳米结构后,NTCD中C=C键伸展和C-H弯曲振动减弱。原料及纳米材料的C=O的吸收峰均在1 652 cm-1处,形成纳米结构后,由于NTCD分子的N—H和C=O形成了分子间氢键,吸收峰变弱,强度降低。NTCD分子是平面分子,分子中游离的π电子与相邻分子π-π键叠加,氢键网络的形成使得二酰亚胺聚集,在真空条件下蒸发沉积而形成了纳米带。
2.3 荧光光谱与紫外光谱分析
测定NTCD原料溶液激发与发射荧光光谱,激发/发射波长分别为λex/λem=336/375 nm、397 nm,形成纳米结构后激发/发射波长有较大的变化,分别为λex/λem=389/498 nm,如图4所示。纳米溶液的荧光激发、发射光谱显著红移,这可能与NTCD形成纳米结构后,其分子间氢键作用、π-π重叠导致电子云活动范围增大,荧光发射增强。紫外吸收测定(图略)表明,纳米材料与原料比较,不仅紫外吸收明显增强,且最大吸收波长由原料342 nm蓝移至291 nm。纳米结构的典型特征就是量子尺寸效应,当粒子尺度下降到某一数值时,费米能级附近的电子能级由准连续变为离散能级或者能隙变宽的现象,它的直接表现就是在紫外吸收光谱中吸收蓝移。

图3 NTCD纳米材料的透射电镜(TEM)图Fig.3 TEM of NTCD nanomaterialsConditions:thermalvacuum vapor deposition;heating temperature and time:600 ℃,1 hour.
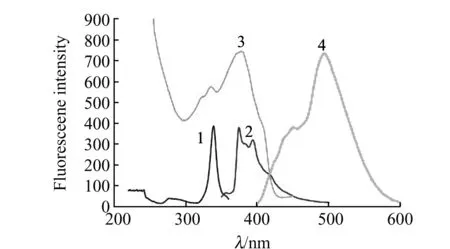
图4 NTCD 原料与纳米材料的荧光光谱图Fig.4 Fluorescence spectra of NTCD raw and nanomaterials 1,2:Fluorescence excitation and emission of NTCD raw materials;3,4:Fluorescence excitation and emission of NTCD nanomaterials;Measurement conditions:NTCD concentration of 0.28 μg/mL;pH=5.27;slits:10/10 nm;1 cm quartz cell.
2.4 NTCD纳米荧光探针的传感应用
研究NTCD纳米荧光探针对Ca2+、Mg2+、AI3+、Zn2+、Co2+、Fe3+等金属离子和葡萄糖、甘氨酸、丙氨酸、苏丹Ⅲ、溶菌酶、牛血清蛋白、咖啡因、三聚氰胺、三聚氰酸、茶多酚等化合物的识别作用,结果如图5所示。纳米探针对三聚氰胺具有极高的选择性和灵敏度,而对其它金属离子及其化合物响应较弱(F为加入不同猝灭剂的荧光强度,F0为NTCD纳米材料的荧光强度)。
2.5 pH对NTCD荧光探针的影响
取NTCD纳米材料溶液1 mL,分别定量加入1.0×10-5mol/L三聚氰胺溶液与pH为2.33、4.06、6.61、8.20、10.30的缓冲溶液2 mL,定容到10 mL。研究其荧光强度变化值ΔF(ΔF=F0-F),结果如图6所示。可见加入猝灭剂三聚氰胺,pH在酸性范围内ΔF有增大趋势且较稳定,故选用pH值为5.27三酸缓冲液控制体系pH。

图5 纳米荧光探针对测定对象的选择性Fig.5 Selectivity of fluorescence nanoprobe to determined target Measurement conditions:1 mL 0.28 μg/mL NTCD;pH=5.27;added volume and concentration of metal ions and others:1 mL 1.0×10-5 mol/L,respectively.λex/λem=389/498 nm,slits:10/10 nm,1 cm quartz cell.

图6 不同pH对纳米探针荧光猝灭影响Fig.6 Fluorescence quenching effect of nano probe at different pHMeasurement conditions:1 mL 0.28 μg/mL NTCD and 1 mL 1.0×10-5 mol/L melamine.λex/λem=389/498 nm,slits:10/10 nm,1 cm quartz cell.
2.6 测定时间的影响
取NTCD溶液1 mL,分别加入1.0×10-5mol/L三聚氰胺1 mL,定容至10 mL,然后分别放置0、30、60、90、120 min,研究测定时间的影响。结果表明,放置时间对ΔF影响较小,说明NTCD纳米材料随时间变化较比较稳定,本实验选择30 min为测量时间。
2.7 干扰试验
在前述实验条件下,结合2.4节实验,不同金属离子、有机物质分子对测定三聚氰胺的干扰测定。结果表明,各种共存物质允许量(倍量,相对误差为≤±5%)如下:葡萄糖、甘氨酸、丙氨酸(50);金属离子Ca2+、Mg2+、AI3+、Zn2+、Sn2+(30);Cl-、Ac-(30);Co2+(15);三聚氰酸、茶多酚(15);Fe3+(10);溶菌酶、牛血清蛋白、咖啡因(10)。
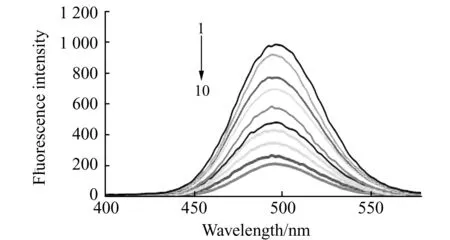
图7 三聚氰胺对NTCD纳米探针荧光猝灭光谱Fig.7 Fluorescence quenching spectra of NTCD 1→10:8.0×10-7,1.0×10-6,2.0×10-6,4.0×10-6,6.0×10-6,8.0×10-6,1.0×10-5,2.0×10-5,4.0×10-5,6.0×10-5 mol/L,respectively.
2.8 工作曲线及精密度测定
按照实验方法,加入不同浓度三聚氰胺溶液进行测定,荧光猝灭光谱见图7。结果表明,三聚氰胺浓度在8.0×10-7~4.0×10-5mol/L范围内-lgc与荧光强度变化的lgΔF呈良好的线性关系,其线性回归方程为:lgΔF=-0.087lgc+2.67,相关系数:R2=0.994,检出限为1.33×10-8mol/L(相当于1.67×10-6g/L),方法优于国家标准方法中色谱法与质谱法的检出限。按实验方法,取10份含1.0×10-6mol/L三聚氰胺溶液测定,相对标准偏差(RSD)为2.51%。
2.9 样品分析
采用前述1.2.4样品处理方法,分别对市售的两种奶粉样品按实验方法进行前处理,然后进行检测,发现两种奶粉中均含有三聚氰胺。实验测定结果及加标回收率结果如表1所示。样品回收率在96%~104.5%之间,表明该分析方法具有较好的重现性和可靠性。
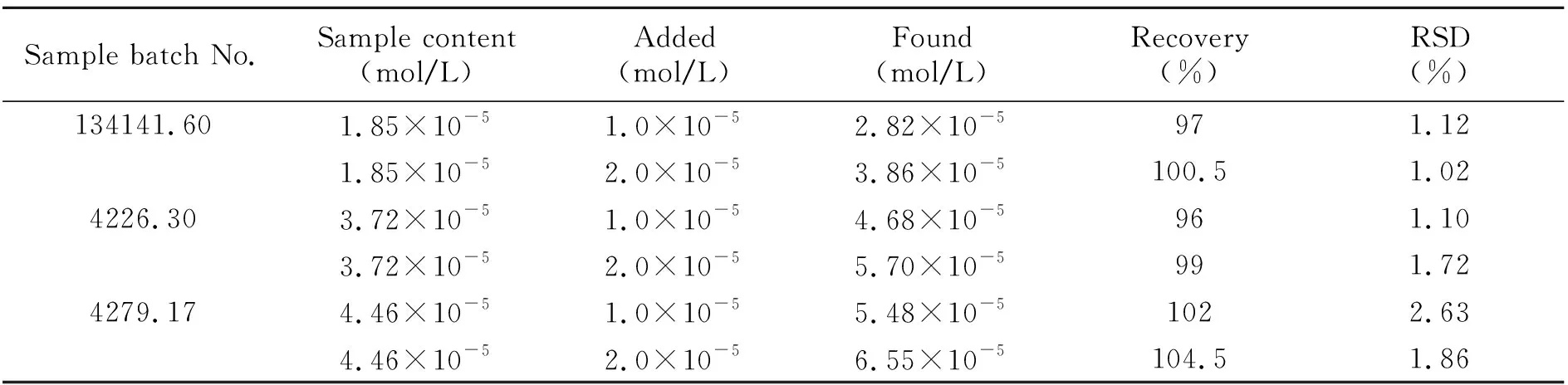
表1 样品中三聚氰胺的测定结果(n=6)
3 结论
本文建立了一种NTCD纳米材料荧光猝灭法快速测定奶粉中三聚氰胺含量的新方法。三聚氰胺在8.0×10-7~4.0×10-5mol/L的线性范围内与荧光强度变化呈良好的线性关系,检出限为1.33×10-8mol/L,RSD为2.51%。该方法简便、快速,对食品中三聚氰胺的检测具有一定的参考价值。
