基于低场核磁共振技术的小鼠体成分无损分析方法开发
2018-09-03谭明乾林竹一李晨阳王偲琦
谭明乾, 林竹一, 李晨阳, 王偲琦
(1.大连工业大学食品学院,辽宁大连 116034;2.国家海洋食品工程技术研究中心,辽宁大连 116034)
体成分包括体液、脂肪和瘦肉等含量,它可直接反映人体的健康状况。目前评估肥胖的方法有称量体重或体质指数(BMI)计算法,但不足以准确实时地反映体成分的动态变化情况[1]。因此,急需一种快速、准确可实时动态监测体成分变化的测量方法。在哺乳类实验动物中,由于小鼠饲养管理方便,易于控制,生产繁殖快,有明确的质量控制标准,因此利用小鼠为实验动物模型,开发一种小鼠体成分动态变化的快速无损检测方法,对于评价人类食品功能组分对体成分的影响具有非常重要的研究意义
目前,动物体成分的测定方法是全身化学分析法,它是衡量身体组成的金标准,但该方法耗时费力、没有重现性、需要杀死小鼠、不能动态监测[2]。测量体成分技术还有生物电阻抗法(BIA)、双能X射线吸收光谱法(DEXA)、同位素稀释法、皮肤褶皱和近红外(NIR)等[3 - 5]。上述方法存在测量结果准确性低、误差大、适用范围小、易受影响、动物死亡率大等缺点[6 - 7],因此探索一种新型小鼠体成分测定方法是我们现今所急需的。低场核磁共振(LF-NMR)具有快速无损等优点,成为现今很有发展潜力的无损分析技术,且已应用于食物成分(脂质,水分,蛋白质)的分析[8 - 9]。例如,Prestes等采用1H横向弛豫时间(T2)选择完整油籽测定改性脂肪酸的分布[10];Geng等使用LF-NMR分析干海参的复水过程[11]。此外将偏最小二乘回归分析法(PLSR)和主成分回归分析法(PCR)运用在近红外、NMR分析中,可以提取出反映数据变异的最大信息,系统全面的分析问题[12 - 14]。Rios等使用NMR结合PLSR技术成功预测岩石渗透率[15];Gaston等运用PLSR和PCR算法对蘑菇双孢蘑菇多酚氧化酶活性进行预测[16];Shao等使用PLSR结合LF-NMR预测煮甜玉米中未冻水含量[17]。目前LF-NMR结合PLSR在食品加工中进行分类和定量测量方面有很大发展[18]。然而,基于LF-NMR小鼠体成分的无损快速分析方法仍然未见报道。
本研究采用全身化学分析方法的结果作为参考值,建立基于LF-NMR技术的小鼠体液、脂肪和瘦肉含量快速预测模型。利用体液,脂肪和瘦肉质量响应于不同静态磁场下的各种射频脉冲产生不同的信号[19],通过NMR测量CPMG脉冲序列,通过PLSR和LF-NMR结合全身化学法的测定值,建立小鼠体成分预测模型来分析小鼠体液、脂肪和瘦肉含量,实现在小鼠清醒状态下对小鼠体成分的快速、无损分析(图1)。

图1 小鼠体液、脂肪和瘦肉含量的低场核磁共振检测示意图Fig.1 Scheme of body fluid,fat and lean mass in mice detected by LF-NMR
1 实验部分
1.1 仪器与实验动物
NMI20-030H-I核磁共振成像分析仪(永磁体场强0.5 T)(苏州纽迈分析仪器股份有限公司);SZF-06A粗脂肪测定仪(上海新嘉电子有限公司);PH070A型培养箱/干燥箱(上海一恒科技有限公司);KDN-103F定氮仪(上海纤检仪器有限公司);HYP-1020消化炉(上海纤检仪器有限公司);SX2-4-10马弗炉(龙口市先科仪器有限公司);AS5150A超声波清洗机(天津奥特塞恩斯仪器有限公司);AB204-N电子分析天平、ME140电子分析天平(梅特勒-托利多仪器(上海)有限公司)。
BALB/C小鼠,6~10周龄,体重18~32 g,均为雄性,清洁级(大连医科大学实验动物中心)。实验开始之前,BALB/C小鼠饲养于室温~20 ℃空调实验室内,测试前为保证实验顺利进行,对小鼠禁食、禁水2 h处理。
1.2 实验方法
1.2.1低场核磁信号采集通过由聚四氟乙烯(内径:2.3 cm,外径:3.0 cm)制成的小鼠体成分测定专用笼具,固定移动的小鼠,并保证在测试过程中小鼠可以自由呼吸。将鼠笼放置在核磁共振成像分析仪的射频线圈的中心,在32 ℃条件下采用CPMG序列,测定20只体质量不同小鼠的横向弛豫信息。测试参数:P1(s)=15,P2(s)=29,SW(kHz)=200,TW(ms)=3 000,NECH=5 000,NS=8,DL1(ms)=0.100。
1.2.2全身化学法分析小鼠体成分20只BALB/C小鼠经过低场核磁扫描后,立即通过断颈方式处死,进行全身化学法分析。首先,将小鼠在105 ℃烘箱中烘大约56 h,中间用天平检查小鼠的体重,直到烘至恒重,参照国家标准(GB 50093-2010)《食品中水分的测定》,确定体液含量。由索氏提取法测定脂肪含量,参照国家质量监督检验检疫总局(GB/T 9695.2-2008)《食品中脂肪的测定》,将烘干小鼠粉碎后的残渣用滤纸包好,放入抽提器中,向圆底烧瓶中加入60 mL石油醚,接好抽提器的冷凝水,65 ℃恒温水浴下抽提6.5 h。抽提结束后旋转蒸发除去石油醚,将圆底烧瓶置于105 ℃干燥2 h,使其彻底挥发,称量烧瓶重量,计算所抽提的小鼠脂肪含量。瘦肉含量定义为体液、蛋白质和灰分含量的总和,其中凯氏定氮法是蛋白质含量测定最常见的方法[20 - 21],参照国家卫生部标准(GB 50094-2010)《食品中灰分的测定》,采用凯氏定氮法,标定0.1 mol/L HCl,称量小鼠样品,加入0.2 g CuSO4,6 g K2SO4,再加20 mL浓H2SO4,200 ℃加热消化,再升温至420 ℃,液体呈蓝绿色且澄清透明,用半凯氏定氮仪蒸馏至中性,用HCl滴定至溶液呈淡紫色,记录其消耗量V1,空白实验HCl消耗量V2=0.02 mL。蛋白质含量(%)=(V1-V2)×0.1×0.014×6.25/m0×100%。m0为小鼠的质量,同时进行空白实验。
灰分含量参照国家标准(GB 50095-2010)《食品中蛋白质的测定》,取索氏提取脂肪后的1/2样品烘干称重,置于坩埚中在马弗炉中550 ℃灼烧8 h,冷却后称重得灰分重量,计算得到灰分含量,小鼠瘦肉含量=蛋白质含量+灰分含量+体液含量。
1.3 小鼠体成分预测模型建立及检验
利用LF-NMR测试结果与化学测试结果建立相关模型。本文选择16只小鼠用于小鼠体成分预测模型的建立,4只小鼠用于验证模型的准确性。首先建立预测模型,利用每只小鼠的所有NMR测试数据,即5 000个CPMG数据,以及化学测试指标包括体液、脂肪、瘦肉数据的结果,列在16×5 003矩阵。简而言之,化学方法测定的结果作为参考值,独立变量的矩阵是振幅强度(X),数据矩阵X的每行给出了其中一个小鼠样本的振幅强度。因变量是相应的体成分含量(Y)。采用Unscramble 9.7 数据处理软件,建立PLSR预测模型和PCR预测模型,采用Origin 8.5进行图形绘制。将建立好的PLSR和PCR预测模型分别运用于待测小鼠进行体成分预测,得到小鼠体液、脂肪和瘦肉含量的模型预测值,并与化学方法获得的小鼠体液、脂肪和瘦肉含量数据进行比较验证分析。
1.4 数据分析


2 结果与讨论
2.1 横向弛豫结果分析
NMR方法对实验动物没有X射线辐射损伤,通过测定能反映氢核状态的横向弛豫时间T2等核磁共振参数,获得待测样品的内部1H质子信息。图2为建立预测模型的16只小鼠的CPMG回波衰减曲线(图2A)和未参与建模的4只小鼠的回波衰减曲线(图2B)。小鼠所含氢质子所处不同的物理化学性质与衰减曲线的趋势密切相关,所以不同的衰减曲线与小鼠中不同的体成分组成有关,小鼠横向弛豫曲线有可能反映小鼠体成分存在的这部分差异。用肉眼观察,整个趋势看起来很相似,从图2A在100~300 ms的放大截图,可以观察到由于不同的小鼠样本体液、脂肪、瘦肉含量有所差异,CPMG回波峰的曲率和信号强度存在一定差异,但是很难区分,需要结合化学计量学方法用原始衰减数据建立预测模型用于测定小鼠样品的体液,脂肪和瘦肉含量。即利用不同体成分小鼠对仪器的响应特性不同,LF-NMR技术可以快速检测小鼠的体液,脂肪和瘦肉含量。

图2 建立预测模型的16只小鼠的回波衰减曲线(A)和用来验证的小鼠的回波衰减曲线(B)Fig.2 CPMG decay curves recorded for 16 mice to establish prediction model(A) and the other mice for testing(B)The numbers in the figures represent the serial numbers of the mice.
2.2 全身化学分析法测定小鼠体成分的结果
全身化学分析法是确定体成分含量的传统方法。表1列出了用于建立预测模型的1~16号小鼠体质量、体液、脂肪、瘦肉的全身化学分析法的测定结果以及16只小鼠体液、脂肪、瘦肉含量的最大值、最小值、平均值、标准偏差。可以看出小鼠样品的体质量在22.77 g和31.18 g之间,体液量在14.29 g和18.57 g之间,脂肪量在2.28 g和5.62 g之间,瘦肉量在16.05 g和20.99 g之间,且体质量、体液、脂肪、瘦肉含量的平均值±标准偏差分别为26.89±2.39 g、16.75±1.46 g、3.97±1.02 g和18.71±1.64 g。小鼠样品的体液含量在57.16%和66.73%之间,脂肪含量在8.76%和20.46%之间,瘦肉含量在63.66%和75.49%之间,且水分、脂肪、瘦肉含量的平均值加减标准偏差分别为62.35±2.67%、14.67±3.22%和69.65±3.04%。通过与全身化学分析法测定小鼠体成分结果进行关联,有望建立一种基于LF-NMR技术的无损快速小鼠体成分分析检测方法。
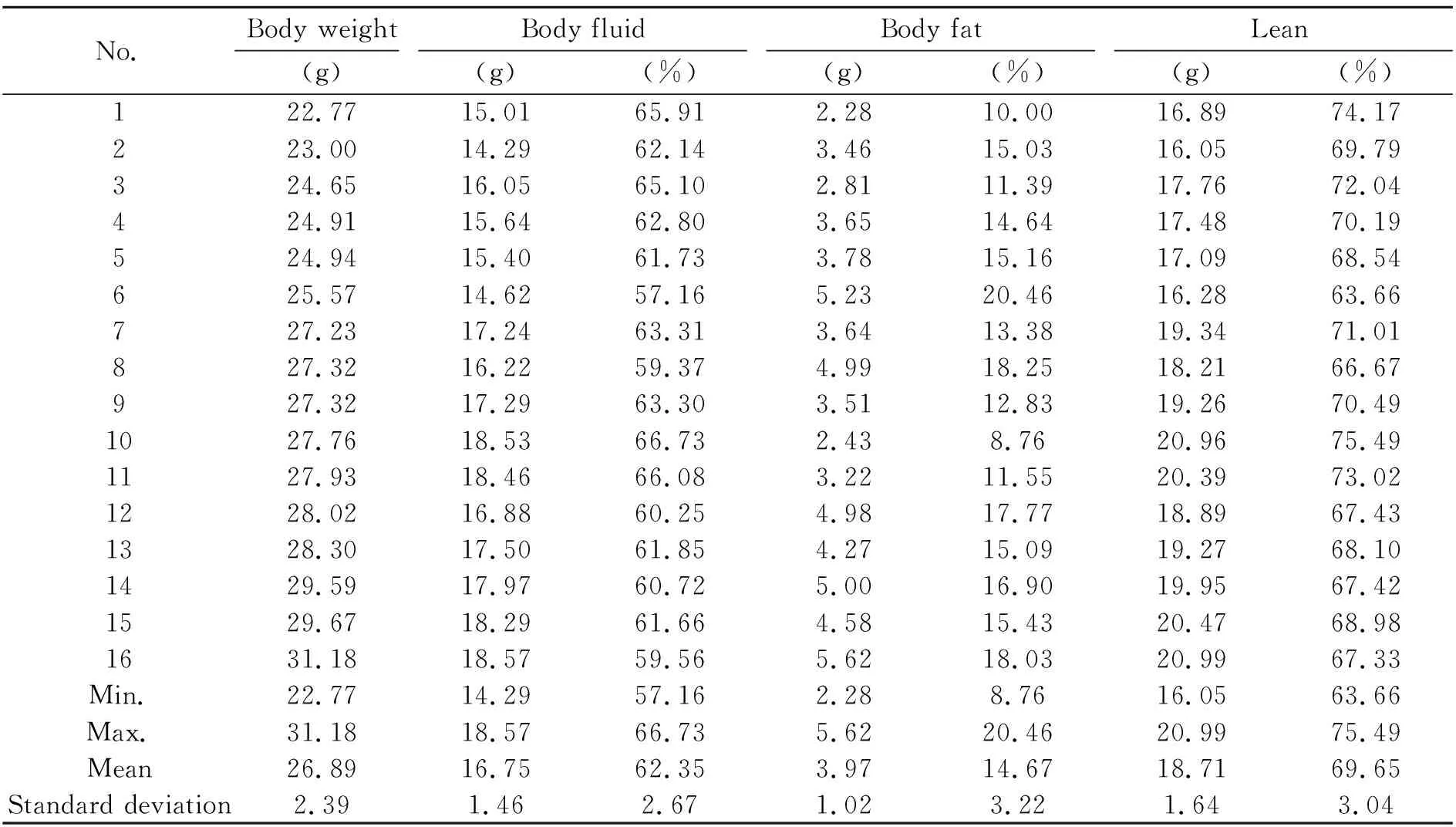
表1 全身化学法测定用于建立预测模型的16只小鼠体成分信息
2.3 模型参数评价
由图3A可以看出,PLSR方法建立预测模型,通过小鼠体液、脂肪和瘦肉含量残余方差分析得到体液、脂肪和瘦肉的最佳因子数分别为7、5和7,选择最佳因子数进而得到小鼠体液,脂肪和瘦肉的LF-NMR技术预测模型的校正集和验证集的预测值与实际值的相关图(图3B~3D)。观察小鼠的体液、脂肪和瘦肉含量的校正集和验证集的散点分布图,发现点均匀的分布在拟合线的两侧,说明预测值与实际值具有良好的相关性,PLSR模型具有良好的稳定性。经过方程回归后,我们可以得到线性方程:Y=QX+E。X轴分别为小鼠体液,脂肪和瘦肉的参考含量,Y轴是小鼠体成分含量的预测值。良好的预测模型应该具有较高的R2值和较低的RMSEC和RMSECV[24],模型的线性关系可以显示模型是否可以提供准确的量化,作为其拟合度评价的可靠指标[25],如果R2>0.90表明模型的预测效果很好,此外剩余预测偏差(RPD)值,即标准差(SD)与预测均方根误差的比值也被用于评估预测结果的准确性,若RPD>3,R2≥ 0.9表明预测结果很好。

图3 PLSR预测模型残余方差和与因子数关系(A)、体液PLSR预测模型(B)、脂肪PLSR预测模型(C)和瘦肉PLSR预测模型(D)的预测值与实际值的相关图Fig.3 Residual validation versus number of principal components(A) and the predicted and reference plots of the PLSR models for body fluid(B),body fat(C) and lean mass(D)and the actual and estimated values of the relevant figure
然而用PCR方法建立预测模型时,小鼠体液、脂肪和瘦肉含量模型的最佳因子数分别为6、6和6(图4A),发现数据点并不是均匀地分布在拟合线的两侧,说明预测值与实际值的相关性不是很佳,见图4B~4D。
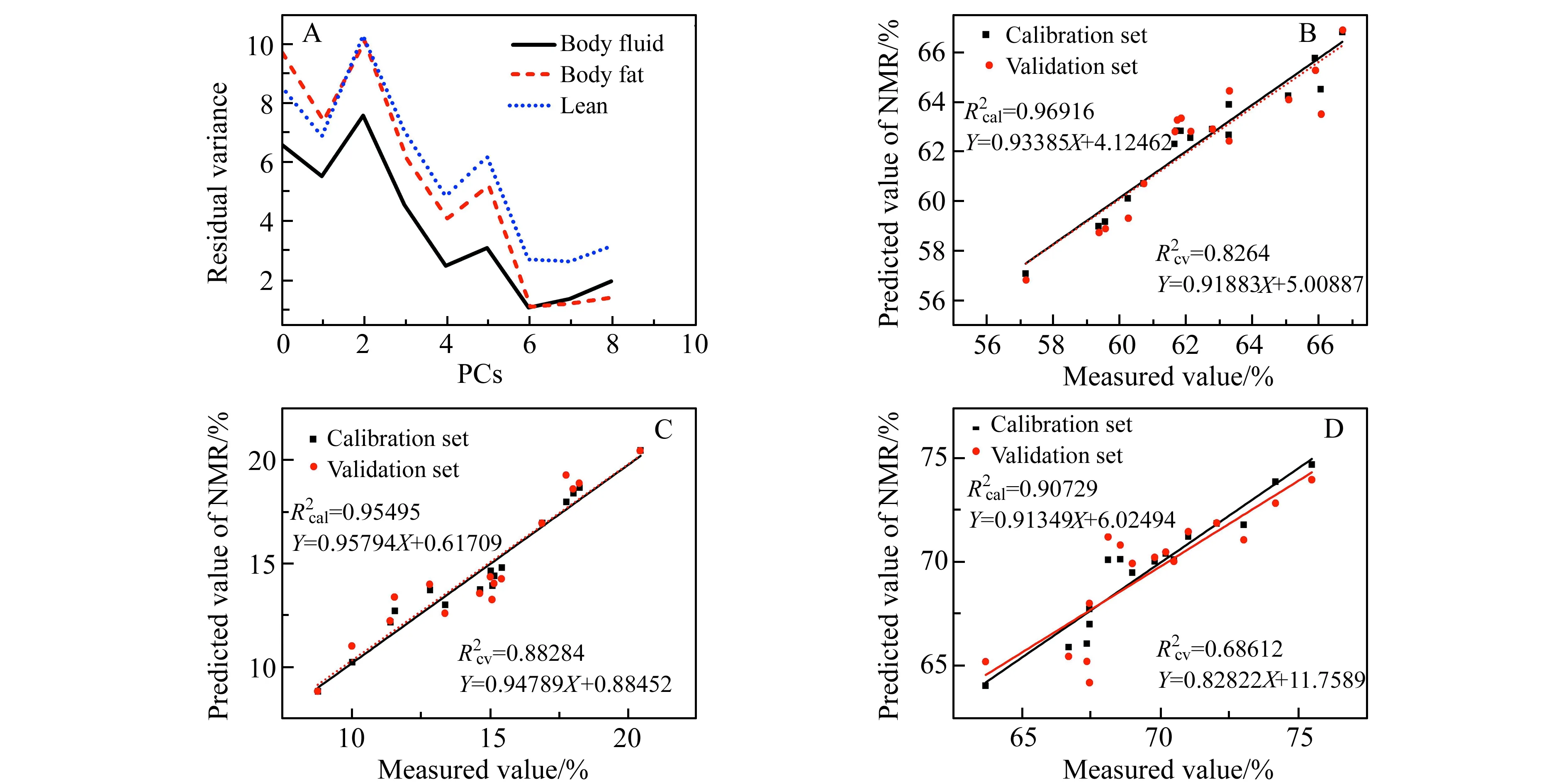
图4 PCR预测模型残余方差和与因子数关系(A)、体液PCR预测模型(B)、脂肪PCR预测模型(C)和瘦肉PCR预测模型(D)的预测值与实际值的相关图Fig.4 Residual validation versus number of principal components(PCs)(A) and the predicted and reference plots of the PCR models for body fluid(B),body fat(C) and lean mass(D)and the actual and estimated values of the relevant figure
PLSR与PCR预测模型参数均列入表2,由表2可见,PCR体液和脂肪模型的RPD大于3,但瘦肉模型的RPD小于3,说明PCR体液和脂肪的预测较准确,但瘦肉模型的预测较不合理。PCR预测模型与PLSR预测模型相比,R2较小且均方根误差较大,RPD较小。该结果表明,PLSR预测模型的准确性和稳定性高于PCR预测模型。

表2 小鼠体液、脂肪和瘦肉含量PLSR和PCR模型参数
Note:RPD,residual predictive deviation.
如上所述,使用PLSR和PCR算法建立了用于小鼠体成分含量预测的模型,包括校准方程和验证方程,这些结果清楚地表明了PLSR和PCR模型的线性回归参数。通过观察发现PLSR模型的点都均匀的分布在拟合线的两侧,说明预测值与实际值具有良好的相关性,而PCR模型的点相对分布不均,说明PLSR预测模型具有更好的稳定性。
2.4 模型应用评价
表3列出了用于验证预测模型性能的小鼠全身化学分析法测得的体成分信息以及这4只小鼠体质量、体液、脂肪和瘦肉含量的最大值、最小值、平均值和标准偏差。从表3可见小鼠样品的体质量含量在23.76 g和32.79 g之间,体液量在13.99 g和19.49 g之间,脂肪量在3.53 g和6.03 g之间,瘦肉量在15.67 g和21.61 g之间。小鼠体质量、体液、脂肪和瘦肉含量的平均值和标准偏差分别为27.72±3.79 g,16.94±2.35 g、4.51±1.10 g和18.89±2.55 g。经过换算,体液含量在58.87%和64.36%之间,脂肪含量在12.66%和19.24%之间,瘦肉含量在65.89%和71.93%之间。小鼠体液、脂肪和瘦肉含量的平均值和标准偏差分别为61.11±2.51%、16.24±3.10%和68.17±2.87%。通过以上参数分析,发现用于评价的小鼠脂肪含量差异较大。

表3 全身化学法测定用于验证预测模型的4只小鼠体成分信息
Note:RPD,residual predictive deviation.
表4列出了通过全身化学分析法和采用小鼠体成分PLSR预测模型预测得的小鼠体液、脂肪、瘦肉含量。结果说明PLSR预测模型得到的体液含量与全身化学分析法测定得到的小鼠体液含量的相对误差为0.71%和1.15%之间,PLSR预测模型得到的脂肪含量与全身化学分析法测定得到的小鼠脂肪含量的相对误差为0.31%和1.43%之间,PLSR预测模型得到的瘦肉含量与全身化学分析法测定得到的小鼠瘦肉含量的相对误差为0.14%和1.12%之间。通过4只小鼠体成分的预测值,三个PLSR模型的相对误差均低于1.5%,其中脂肪PLSR模型的相对误差较高,说明体液PLSR模型和瘦肉PLSR模型具有较高的准确性,脂肪PLSR模型的准确性较差,可能原因是小鼠体内脂肪含量低,导致预测效果较差。
表5列出了通过全身化学分析法和采用小鼠体成分PCR预测模型预测得到的小鼠体液、脂肪、瘦肉含量,结果发现小鼠体成分PCR预测模型得到的体液含量与全身化学分析法测定得到的小鼠体液、脂肪、瘦肉含量的相对误差分别为0.59%和1.14%之间,0.38%和1.36%之间,0.15%和1.46%之间。瘦肉PCR预测模型的准确性最高,其次是体液PCR预测模型,准确性最差的是脂肪PCR预测模型。PCR模型的预测结果与PLSR预测模型相似。

表4 PLSR预测模型和全身化学法得到的体液含量、脂肪含量、瘦肉含量对比
Note:SD,standard deviation;E1-4:experiment 1-4.
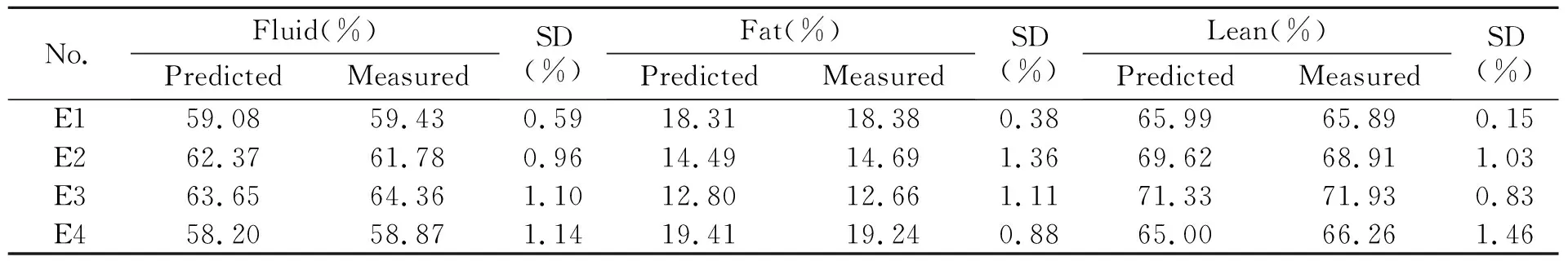
表5 PCR预测模型和全身化学法得到的体液含量对比
Note:SD,standard deviation;E1-4:experiment 1-4.
3 结论
本文建立了基于LF-NMR技术的小鼠体成分无损分析方法。通过CPMG序列获得的驰豫数据与化学计量学数据处理方法相结合,分别利用PLSR法和PCR法建立小鼠体液、脂肪、瘦肉含量的预测模型。与PCR预测模型相比,PLSR预测模型具有更高的稳定性和预测准确性,PLSR模型的性能优于PCR模型。结果显示PLSR和PCR的预测结果很相似,均表现为体液、脂肪和瘦肉的预测相对误差小于1.5%,平均相对误差均在1%以内,预测效果很好。本实验结果可以反映出LF-NMR结合PLSR和PCR方法,可以开发出用于小鼠的体液、脂肪和瘦肉含量的快速无损分析方法。
