GRR制备Pd-CeO2/Au/CNTs甲酸盐电氧化催化剂:高金属利用率及抗中毒性能*
2018-09-03王建设程相林赵建宏宋成盈王留成
王建设,马 云,程相林,赵建宏,宋成盈,王留成
(郑州大学,郑州 450001)
0 前 言
以有机小分子如甲醇[1]、乙醇[2]、甲酸[3]和甲酸盐[4]为燃料的直接液体燃料电池普遍采用以贵金属Pt、Pd为主的催化剂。减少贵金属Pt和Pd的用量能够有效降低催化剂的生产成本,有利于促进直接液体燃料电池的商业化。一般来说,降低催化剂用量可从设计合适的催化剂结构[5-6]和探索简单易行的催化剂合成方法[7-8]两个方向入手。对于催化剂结构设计来说,核-壳结构及其类似结构一直是人们争相研究的热点以及重点。此类结构不仅可大幅提高贵金属利用率,还能通过“核”金属有效调控表层贵金属的催化性能。在合成方法上,原位电沉积制备高利用率Au和Ru[9-10]体现出了电化学的优势。此外,通过欠电位沉积 Cu然后进行置换反应(galvanic replacement reaction, GRR)[11-12]也是制备高利用率催化剂时广泛采用的电化学方法。
在GRR反应中,由于Pt、Pd仅在Cu欠电位沉积的位置(例如 Au颗粒表面)完成置换反应,有效避免了Pt、Pd沉积在电导率较低的基底上(比如,作为助催化剂的金属氧化物)。而采用化学法制备Pt、Pd系催化剂时,由于Pt也会在Ni(OH)2/GNs[13]和CeO2/C[14]等这些低电导率的基底上发生沉积,因而会严重降低Pt的利用率。此外,所有的液体燃料电池都面临阳极催化剂极易发生中毒[15-16]这个共同的问题,。为有效避免催化剂中毒,研究者们做了大量的工作,包括调整催化剂构成[17]、颗粒大小[18]、晶型[19]、载体[20]、催化剂基底[21]以及尝试不同的助催化剂[22]。大量研究表明,CeO2的加入能够有效提高Pt系和Pd系液体燃料电池阳极催化剂的催化活性、稳定性,尤其是抗中毒性能[15,23]。因此,本文以甲酸盐电氧化作为研究体系,选择Pd作为阳极主催化剂,通过GRR技术在基底Au上沉积一个原子层的Pd(如图1所示)。这种结构不仅能避免CeO2的低电导率对催化剂性能发挥的负面影响,而且实现了Pd的高利用率。同时,催化剂中Pd-CeO2界面的存在可显著提高催化剂抗中毒性能。

图1 Pd/Au/CNTs和Pd/CeO2/Au/CNTs 催化剂的制备示意图Fig. 1 Preparation of Pd/Au/CNTs and Pd/CeO2/Au/CNTs through galvanic replacement reaction
1 试验方案
1.1 试剂
实验用多壁碳纳米管(CNTs)购于深圳中科时代纳米,平均直径 40~60 nm。HAuCl4·4H2O、PdCl2、Ce(NO3)3·6H2O等试剂均为分析纯。
1.2 Au/CNTs和CeO2/Au/CNTs的制备及表征
以含有一定量碳纳米管的碱性乙二醇(EG)为溶剂,通过化学还原法还原 HAuCl4·4H2O 制备Au/CNTs(20wt%)[24]。CeO2/Au/CNTs的制备方法与Au/CNTs制备方法类似:取51.2 mg Au/CNTs均匀分散于含有64.5 mg Ce(NO3)3·6H2O的100 mL水溶液中,超声至少30 min以确保分散足够均匀;随后,在磁力搅拌下向上述溶液中滴加一定浓度的NaOH溶液,调至溶液中性;进一步搅拌,1 h后将形成的混合物过滤、清洗并在100℃下真空干燥3 h,即可得到CeO2/Au/CNTs,其中Au和CeO2的质量百分比分别为13.3%和33.3%。
采用X射线衍射仪(XRD,德国布鲁克公司,D8 Advance)对Au/CNTs和CeO2/Au/CNTs中金属颗粒的结晶粒度和晶相结构进行分析,并用透射电镜(TEM,美国FEI公司,Talos F200X)对样品的微观形貌进行观察。
1.3 Pd-Au/CNTs和 Pd-CeO2/Au/CNTs催化剂的制备及表征
取4 mg Au/CNTs(CeO2/Au/CNTs)超声分散于含有0.8 mg Nafion®溶液的400 μL无水乙醇溶液中,超声约30 min得到浆料Au/CNTs(CeO2/Au/CNTs)。用移液枪移取20 μL涂于玻碳(GC)电极上,红外干燥后用水浸湿,记为Au/CNTs(CeO2/Au/CNTs)电极。
选用上海辰华电化学工作站(CHI 660b)对所制电极采用三电极体系进行表征。涂有催化剂的GC电极、铂丝电极和饱和甘汞电极(SCE)分别作为工作电极、对电极和参比电极,全文所标电势均相对于SCE电势。除特殊说明,测试均在 N2保护下进行,测试温度为25℃。
2 结果与讨论
2.1 Au/CNTs和CeO2/Au/CNTs的TEM和XRD表征
为观察加入CeO2后Au/CNTs表面的变化,对Au/CNTs和CeO2/Au/CNTs分别进行TEM分析,结果如图2a和图2b所示。可以看到,Au颗粒均匀分散在碳纳米管表面,但粒径分布明显不均。从图2b可以看出,与Au/CNTs基底上光滑的CNTs表面相比,CeO2/Au/CNTs中碳纳米管表面略显粗糙,说明CeO2已成功分散在碳纳米管表面。此外,一些 Au粒子被CeO2粒子包覆其中,也有一些Au粒子并没有被CeO2粒子完全覆盖,图2b中的插图表示一个被CeO2完全包裹的Au粒子,证实Au与CeO2粒子之间界面的形成。
图2c中,26.4°对应 C (002)的衍射峰,位于38.3°、44.3°、64.7°、77.6°的衍射峰分别对应 Au(111)、Au (200)、Au (220)和 Au (311)[25]。此外,位于 27.5°、33.0°、47.5°、56.0° 的四个新峰表明 CeO2的成功引入[14,26]。

图2 Au/CNTs与CeO2/Au/CNTs的TEM图(a)和(b)以及XRD图(c)Fig. 2 TEM image of (a) Au/CNTs and (b) CeO2/Au/CNTs; (c) XRD patterns of Au/CNTs and CeO2/Au/CNTs
2.2 Pd-CeO2/Au/CNTs和 Pd-Au/CNTs系列催化剂的电化学表征
为确定Cu欠电位沉积在Au颗粒上的两个参数——沉积电位和沉积时间,通过在不同电位下沉积相同时间和固定电位下沉积不同时间加以判断。具体做法是:在选择电位下沉积一定时间,随后通过扫描相应的Cu溶出曲线,根据溶出曲线中溶出峰的峰电位和具体电量值来判断发生欠电位沉积的具体参数[11,27]。实验中,沉积电位选择0.06 V,沉积时间为20 s。
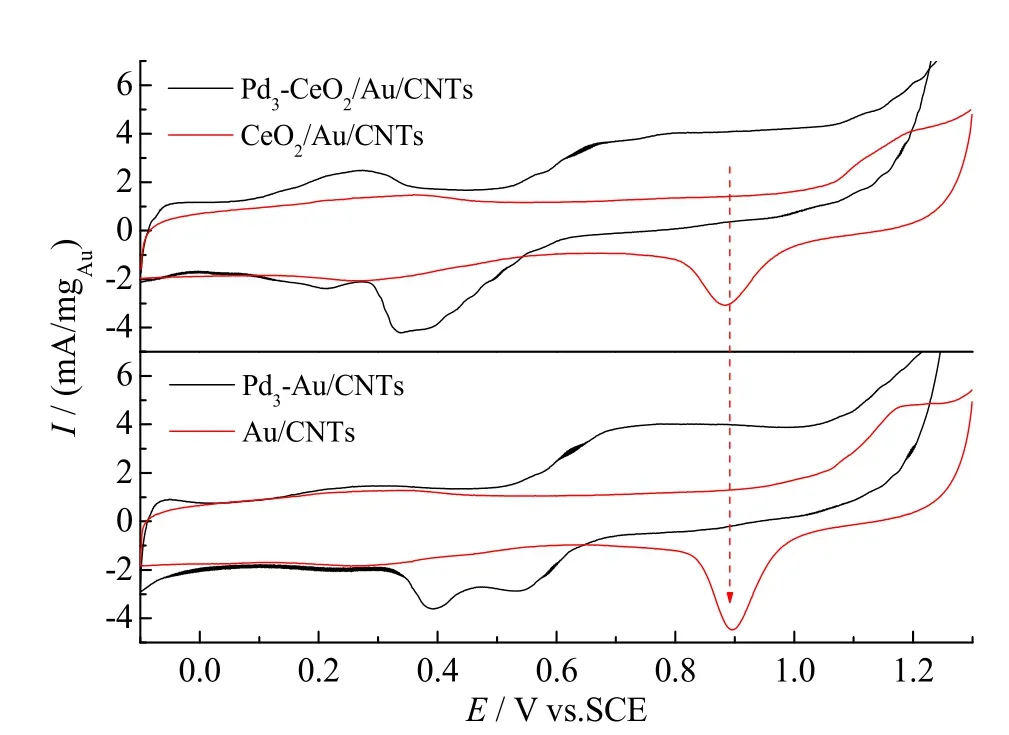
图3 Pd3-Au/CNTs、Au/CNTs、Pd3-CeO2/Au/CNTs和CeO2/Au/CNTs在0.1 M H2SO4溶液中的CV曲线Fig. 3 CVs recorded in 0.1 M H2SO4 for Pd3-Au/CNTs,Au/CNTs, Pd3-CeO2/Au/CNTs, and CeO2/Au/CNTs
在设定参数下制备中间体 Cu/Au/CNTs和Cu/CeO2/Au/CNTs,随后将制备好的中间体置于浓度为1 mM PdCl42-的0.1 M H2SO4溶液中至少15 min,保证欠电势沉积到Au颗粒上的Cu与Pd充分置换,最终在Au核表面形成一个原子层的Pd。事实上,Pd是否沉积到Au核表面以及沉积量的多少都可以通过扫描沉积前后的 CV曲线来得以证实,如图 3所示。由图可知,经过大约20圈循环伏安扫描处理后,沉积在Au上的Pd完全溶解,Au得以暴露出来。因此,可以通过扫描前后 Au峰的面积变化来计算Pd在Au上的覆盖度[9]。理论上,完成一个沉积-置换循环即可达到Pd的全覆盖,但实际中只有在完成3次沉积-置换循环后,Pd的覆盖度才达到100%,这是由于GRR是通过电腐蚀过程进行的。下图是循环3个周期后各电极对应的CV曲线。
为比较两种催化剂对甲酸盐电氧化催化性能,对其进行CV以及电流-时间曲线的测试,结果如图4所示。需要说明的是,催化剂中Pd的含量通过对应的Cu溶出曲线以及相应的化学式Cu + Pd2+=Cu2++ Pd进行计算,其中欠电位沉积得到的Cu对应的摩尔数由对LSV曲线的积分电量算出(参数取0.005 18 mmolCu/C)。
图4a和图 4b分别是催化剂 Pd3-Au/CNTs和Pd3-CeO2/Au/CNTs催化甲酸盐电氧化的CV曲线;图4c是Pd/CNTs催化甲酸盐电化学氧化的CV曲线(Pd/CNTs,原子层沉积法沉积 25个循环[7])。为比较不同催化剂稳定性的差异,同时测试对应的i-t曲线,见图4d。在甲酸根氧化电位区间选择一个合适的氧化电位作为测试电位,即 -0.6 V,在该电位下保持2 500 s,记录电流随时间的变化曲线。

图4 (a)~(c)Pd3-Au/CNTs、Pd3-CeO2/Au/CNTs 和Pd/CNTs催化剂在1 M KOH+1M HCOOK和1 M KOH溶液中的CV曲线;(d)不同催化剂在1 M KOH+1M HCOOK溶液中的i-t曲线Fig. 4 CVs recorded in 1 M KOH + 1 M HCOOK and 1 M KOH for (a) Pd3-Au/CNTs, (b) Pd3-CeO2/Au/CNTs, (c) Pd/CNTs; (d) i-t data of the catalysts measured at -0.6 V in 1 M KOH + 1 M HCOOK
从图 4a和图 4b可以看出,Pd3-Au/CNTs和Pd3-CeO2/Au/CNTs催化剂CV曲线中的正扫峰电流均小于反扫峰电流,这是由于在低电位下生成的CO类毒物吸附在催化剂上,降低了催化剂对甲酸盐的电氧化活性;反扫时,CO类物质在高电位下被率先氧化,从而降低了对催化剂的影响,使电氧化活性与正扫比较时有一定的提高。因此,可用正扫峰电流(Im,F)与反扫峰电流(Im,B)的比值Im,F/Im,B来评价催化剂的抗中毒能力,Im,F/Im,B值越大,表明催化剂的抗中毒性能越好。对比发现,Pd3-CeO2/Au/CNTs的抗中毒性能明显优于Pd3-Au/CNTs和Pd/CNTs,说明CeO2对催化剂的抗中毒性能具有提升作用。
为计算催化剂Pd3-CeO2/Au/CNTs和Pd3-Au/CNTs中贵金属Pd的利用率,根据Pd的量及其电化学活性面积(EAS)计算单位质量Pd的电化学活性面积(EASm),其中EAS根据图4中Pd氧化物的还原峰面积计算,转换系数选择283 μC/cmPd2[28],相关数值列于表1。从表中可以看出,Pd3-Au/CNTs和Pd3-CeO2/Au/CNTs的EASm值明显大于Pd/CNTs,证明GRR能够有效提高贵金属Pd的利用率。
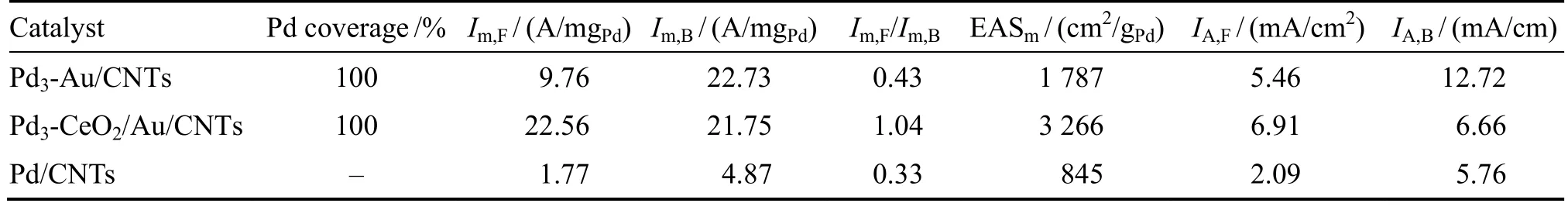
表1 基于图4的数据分析Table 1 Data analysis based upon results in Fig. 4
为进一步探究不同催化剂性能差异的本质原因,利用Im和EASm计算不同催化剂的电化学活性面积比活性,对应的正扫面积比电流IA,F和反扫面积比电流IA,B也列于表中。可以看出,Pd3-CeO2/Au/CNTs和Pd3-Au/CNTs的IA,F值明显大于Pd/CNTs,表明Au对催化剂的活性发挥有促进作用。此外,Pd3-CeO2/Au/CNTs的IA,F值大于Pd3-Au/CNTs,这是由于IA,F值的大小受毒物CO的影响,也进一步说明CeO2的加入对催化剂的抗中毒性能有提升作用。
图4d是不同催化剂在 -0.6 V时的i-t曲线。可以看出,在整个2 500 s时间段内,Pd3-CeO2/Au/CNTs的电流值(Ii-t)一直明显高于 Pd3-Au/CNTs和Pd/CNTs,说明与 Pd3-Au/CNTs和 Pd/CNTs催化剂相比,Pd3-CeO2/Au/CNTs的稳定性更好,即抗中毒性能更好。为进一步定量说明不同催化剂Ii-t值的差异(抗中毒性能的差异),分别计算其相对活性保留值 RAR(RAR=Ii-t/ICV)[20],其中Ii-t为催化剂的终端电流,ICV为CV曲线中在-0.6 V对应的反扫峰电流,具体计算数值列于表2。从表中可以看出,Pd3-CeO2/Au/CNTs的RAR值明显高于Pd3-Au/CNTs和Pd/CNTs,进一步验证了CeO2对催化剂抗中毒性能的提升作用。

表2 Pd3-Au/CNTs和Pd3-CeO2/Au/CNTs RAR值分析Table 2 RAR analysis for Pd3-Au/CNTs and Pd3-CeO2/Au/CNTs
基于以上分析,为进一步探究催化剂的抗中毒机理,对三种催化剂进行CO溶出实验。如图5,Pd/CNTs的CO氧化峰位于-0.234 V,Pd3-Au/CNTs的CO氧化峰位于-0.3 V,相较于Pd/CNTs更负,意味着CO类毒物更容易被氧化,说明Au的引入对催化剂的抗中毒能力有一定的提升作用。Pd3-CeO2/Au/CNTs在更负的电位下(-0.435 V)出现了新的氧化峰,说明CeO2对于催化剂抗中毒性能的提升作用,也进一步验证了 TEM 中的结论,在Au与CeO2之间有新的界面形成。
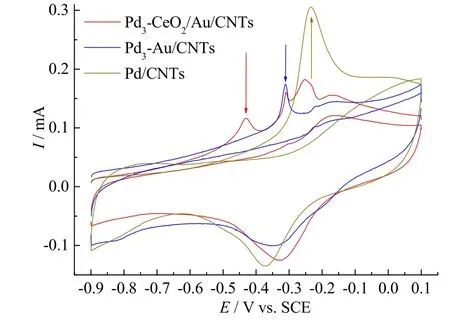
图5 扫速为20 mV/s下, Pd3-Au/CNTs、Pd3-CeO2/Au/CNTs和Pd/CNTs在1 M KOH溶液中的CO溶出曲线Fig. 5 CO stripping curves for Pd3-Au/CNTs, Pd3-CeO2/Au/CNTs,and Pd/CNTs in 1 M KOH at scanning rate of 20 mV/s
3 结 论
利用GRR技术在Au颗粒表面沉积单原子层的金属Pd,达到提高贵金属利用率的目的。在此基础上,进一步引入过渡金属氧化物CeO2形成Pd-CeO2结构,提高了催化剂的抗中毒性能。为合成具有低价格、高性能的液体燃料电池催化剂提供借鉴。
