三叶因子3的调控及作用机制
2018-08-31吴靖芳高福禄
林 旭 吴靖芳 高福禄
(河北北方学院形态学实验室,河北 张家口 075000)
肠三叶因子(TFF)3是三叶因子家族(TFFs)中最后被发现的一个成员,生理情况由胃肠道杯状细胞特异性表达。研究表明,当胃肠黏膜发生炎症、溃疡等病变时,TFF3的表达上调,诱导细胞迁移,参与黏膜保护及受损黏膜的修复过程;并且在多种恶性肿瘤高表达〔1〕。本文就TFF3的调控及作用机制进行综述。
1 TFF3的分子结构
TFF3是由59个氨基酸组成的6 700个小分子分泌性多肽,位于21 号染色体长臂(21q22.3),基因跨越2 295 bp,含有3个外显子、2个内含子。其cDNA为222 bp,编码73个氨基酸,前22个氨基酸为信号肽,后 59个氨基酸为成熟肽。第 1个外显子含 ATG 起始密码,编码14个氨基酸的信号肽及 6 个氨基酸的N末端;第2个外显子编码三叶状结构基因;第3个外显子编码 C末端和一个长的含2个多聚腺苷酸化序列的 3′非翻译区〔1〕。TFF3肽链中42个氨基酸(Gln10 到 Pro51)通过6个高度保守的半胱氨酸残基按照1-5,2-4,3-6的顺序形成3个分子内二硫键,折叠形成“三叶状”结构,也叫P结构域〔2〕。TFF3的C端氨基酸序列非常保守,已鉴定的不同种属TFF3(63%)是相同的,C端对TFF3的生物学功能要比N端重要。TFF3经常形成同源或异源二聚体,第7位半胱氨酸对于二聚体形成至关重要〔3〕。天然状态的TFF3既有单体又有二聚体的存在形式。TFF肽特有的紧密结构使其在胃肠道上段具有强烈的耐酸和胰、糜蛋白酶能力。TFF3主要由黏膜上皮分泌并与黏蛋白共分泌形成黏液凝胶,保护黏膜。三叶草结构域环2与环3之间的裂隙主要是寡糖类(如黏蛋白)或芳香族氨基酸结合位点〔4,5〕,TFF3的P结构域赋予其稳定、紧密的结构,在强消化酶、强酸的消化道环境中能保持结构和功能的完整,发挥黏膜保护和损伤修复作用。hTFF3 基因启动子上游 2 000 bp正负链转录因子结合部位共计 204 个,主要包括基本转录因子Sp1、CCAAT/增强子结合蛋白(C/EBP)α、核转录因子(NF)-κB、雌酮(E1)、转录因子(AP)-1、雌激素受体(ER)、八聚体结合转录因子(Oct)-1、GATA结合蛋白(GATA)-3、糖皮质激素受体(GR)、原癌基因c-Jun、c-Fos、N-Myc、AP-2等,其中Sp1对维持TFF3转录活性有重要作用〔6〕,见图1~3。
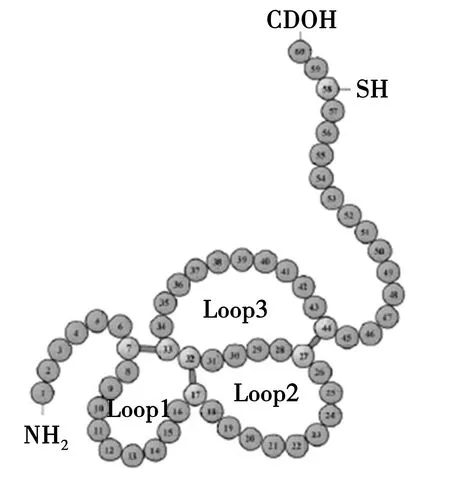
图1 TFF3 P结构域
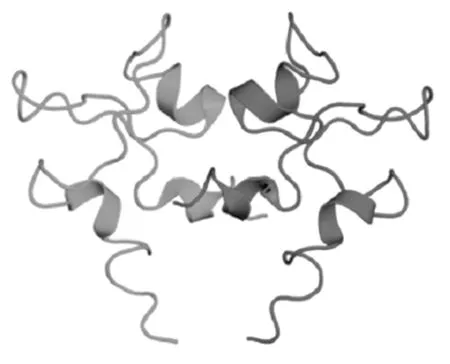
图2 TFF3二聚体
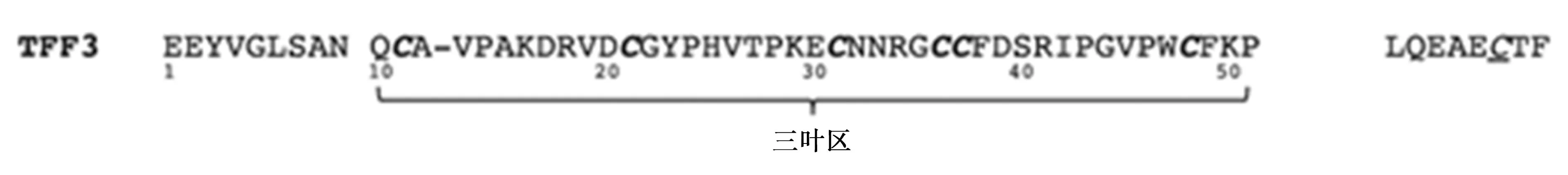
C半胱氨酸残基,C为形成TFF3二聚体的半胱氨酸残基图3 TFF3的氨基酸序列
2 TFF3的表达与功能
2.1TFF3的正常表达 最早发现TFF3由小肠杯状细胞分泌;人类唾液腺,啮齿动物的胰腺和人前列腺,女性生殖器官,泌尿生殖系统、结膜和泪器均可表达TFF3〔7〕。Wiede等〔8〕研究显示人呼吸道和子宫有大量TFF3 mRNA累积,而TFF1、2几乎没有〔8〕。Belovari等〔9〕研究发现小鼠和大鼠星形胶质细胞表达TFF1和TFF3。脑组织TFF3 mRNA转录局限在海马、颞叶皮质和小脑3个脑区。TFF3蛋白在发育中大鼠、人不同脑区及脊髓均有表达。小鼠胚胎TFF3表达于神经节细胞、脊髓及延髓神经元〔9〕。大鼠肠三叶肽TFF3主要由垂体前叶细胞、丘脑室旁核神经元合成并与促乳素共存于大细胞部神经元〔10〕。同时,Paterson等〔11〕也证实脑脊液含TFF3,低水平TFF3与广泛的脑室扩张、全脑及海马萎缩有关,并可作为神经退行性变的标志物。Bernstein等〔12〕以免疫组化技术系统研究了成人脑组织TFF3表达模式,发现TFF3主要分布于丘脑外侧脑区;人胚胎神经元尤其中脑和脑干神经核团是表达TFF3的主要细胞,少突胶质细胞和脉络丛上皮也呈TFF3阳性。大脑TFF3主要功能是参与恐惧、抑郁、学习、阿片成瘾等活动。
2.2TFF3肽的病理表达 研究表明TFF3肽在多数肿瘤发展过程中过表达,在人类实体肿瘤的致癌性转化、生长和转移过程发挥积极作用〔13〕。文献报道TFF3在肿瘤中具有两面性,既可作为肿瘤进展标志物,也可作为肿瘤抑制因子〔7〕。May等〔14〕报道TFF1和TFF3基因在乳腺增生和肿瘤组织及乳腺癌MCF-7细胞均高表达。但在视网膜母细胞瘤和未分化甲状腺癌中TFF3低表达〔15,16〕。上调一般是由炎症和溃疡性引起。TFF3高表达和TFF1低表达是胃上皮化生的标志,生理情况下TFF3在肠道黏膜高表达,胃癌TFF3高表达是预后不良的标志。人类结肠癌、胰腺癌、乳腺癌和肝细胞癌TFF3高表达促进了癌症进程。肝细胞癌TFF3高表达与肝癌的肿瘤分级有关。前列腺癌患者TFF3阳性,血清水平TFF3升高,被认为是晚期前列腺癌的标志物;近年研究表明TFF3还可作为乳腺癌、结直肠癌诊断标志与远期疗效及复发率预测标志物或胃肠癌化疗药物的药代动力学监测指标〔14,17~19〕。
3 TFF3表达调控机制
3.1蛋白质和化学物质对TFF3的调节 ①TFFs相互诱导与自分泌:肠道杯状细胞的TFF3基因启动子含有顺式调控增强子和沉默子区域(GCSI),核蛋白与之结合,调节杯状细胞TFF3特异性转录〔20〕。Taupin等〔21〕研究表明,TFF2和TFF3可以与启动子顺式作用元件结合通过分裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)途径增强小肠和胃细胞系中3个TFF肽的表达;另外,TFF3敲除小鼠不仅有TFF3的表达缺失,同时也伴有TFF1和TFF2的低表达。②雌激素调节:2014年,Sun等〔6〕成功扩增了hTFF3启动子区域,生物信息学分析证实这个区域包含1个Sp1转录因子结合位点,Sp1能增强hTFF3基因启动子的转录,从而增加hTFF3表达。TFF3基因启动子区有2个雌激素反应元件(ERE),所以雌激素也能调节乳腺癌细胞TFF3表达〔22〕。此外,处于月经周期的子宫内膜上皮细胞TFF3高表达,与雌激素水平有关〔8〕。植入期子宫内膜TFF3低表达与此时子宫内膜的屏障功能降低,利于胚泡着床有关〔23〕。Mhawech-Fauceglia等〔24〕最近研究发现TFF3表达与ER在子宫内膜腺癌具有相关性,雌激素促进子宫内膜腺癌TFF3的上调,在Ⅰ型子宫内膜癌中与良好的预后有关。③炎症因子:人支气管上皮细胞系(BEAS-2B)分泌TFF2 和TFF3通过蛋白激酶(PK)C和ERK1/2途径促进肿瘤坏死因子(TNF)-α诱导的白细胞介素(IL)-6和IL-8表达〔25〕。在炎性肠病中TNF-α诱导NF-κB活化,降低TFF3表达,并作为促炎因子导致溃疡形成。同样,TNF-α刺激可以引发HT-29细胞系TFF3表达降低10倍以上,证实了TNF-α下调TFF3是通过NF-κB途径实现的。实验性结肠炎的急性期肠上皮NF-κB的活化降低TFF3表达〔26〕。Blanchard等〔27〕研究表明甲氨蝶呤刺激结肠癌HT-29细胞TFF3表达上调与IL-4和IL-13活化信号传导及转录激活因子(STAT)6有关。④Toll样受体(TLR)2:杯状细胞TLR2活化可诱导TFF3表达,而TFF3缺失导致创伤愈合减慢,当给予rTFF3 治疗时创伤愈合加速。TLR2活化选择性诱导TFF3合成。TLR2-缺陷小鼠急性结肠炎的发病率和死亡率升高,口服rTFF3可降低死亡率〔28〕。
3.2TFFs的表观遗传学调节 表观遗传学是基于非基因序列改变所致基因表达水平变化,即研究在没有细胞核DNA序列改变时,基因功能可逆、可遗传的改变。主要包括DNA甲基化和组蛋白乙酰化。DNA甲基化是在DNA甲基化转移酶的作用下,在基因组CpG二核苷酸的胞嘧啶5′碳位共价键结合一个甲基基团。表观遗传机制也参与了癌症TFF表达的调控。在肠道、胰腺癌、人胰腺导管癌、肝细胞癌中,TFF3高表达常与其启动子低甲基化共存。前列腺癌细胞系和前列腺癌组织TFF1和TFF3启动子区低甲基化与TFF1和TFF3高表达密切相关。DNA甲基转移酶抑制剂5-Aza-dC增加低表达TFF3的前列腺癌细胞中TFF3表达〔29〕。组蛋白乙酰化对TFF3的影响未见报道。
3.3miRNAs对TFFs的影响 miRNAs是约22个核苷酸长度的小非编码RNA分子,在细胞分化、细胞周期、生长和凋亡等过程中发挥重要作用。miRNAs失调在不同疾病和癌症中发挥关键作用,也参与TFFs的表达调节。Sousa等〔30〕研究发现过表达miR-30可通过肝细胞核因子(HNF)4γ依赖途径靶向下调肠化生标志物人绒毛蛋白(VIL)1、TFF2和TFF3。Rotkrua等〔31〕发现过表达和敲低miR-9表达可以改变胃癌MKN45和 NUGC-3细胞系尾型同源盒基因(Cdx)2蛋白及下游靶基因TFF3的表达。
3.4受体和信号通路 ①TFFs结合蛋白:TFF的生物学功能是通过细胞表面受体-配体途径介导的。然而,迄今为止并没有发现明确的TFF高亲和性结合受体。②TFFs下游信号通路:Emami等〔32〕在对人结肠癌PC/AA/C1细胞和狗肾MDCK上皮细胞的研究中发现过表达TFF3可诱发凝胶剂内的细胞分散式生长,三叶肽可以通过激活Src原癌基因及RhoA蛋白来诱发细胞的分散,致使其迁入胶原蛋白凝胶剂内。与TFFs生物学功能有关的信号通路包括磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt),Rho-ROCK级联,COX-2/TXA2-R/Gαq 信号途径,PLC/PKC,MAPK和表皮生长因子受体(EGFR)信号通路〔32,33〕。另外,COX-2,ERK1/2,JNK,Akt,NF-κB和EGFR酪氨酸激酶等也参与TFF的信号调节〔32,34〕。结肠细胞系中TFF1和TFF3通过活化MAPK/ERK信号通路发挥抑制生长的效应,结直肠癌HCT8/S11细胞系的浸润通过TFF1以COX-2和TXA2-R依赖途径启动。胃癌细胞SGC7901中TFF3通过Twist依赖方式调节细胞迁移,TFF3促进SGC7901细胞迁移时Twist途径被激活,相反,以siRNA介导的Twist敲低表达可以消减TFF3诱导的SGC7901细胞迁移,同时,迁移相关标志物细胞角蛋白(CK)-8、紧密连接蛋白(ZO)-1和基质金属蛋白酶(MMP)-9表达也通过Twist途径由TFF3调控〔35〕。TFF3还可通过STAT3磷酸化调节肿瘤血管生成、细胞侵袭、迁移和恶性转化。Pandey等〔36〕研究发现TFF3阳性与乳腺癌肿瘤大小、淋巴结转移、临床分期和不良预后密切相关;体外实验中强制MCF7和T47D的乳腺癌细胞系表达TFF3,可促进癌细胞浸润、迁移和增强成瘤性,裸鼠体内移植后,转移结节明显增多;而siRNA沉默TFF3降低乳腺癌细胞侵袭、转移能力。该作用是通过c-Scr磷酸化活化STAT3导致E-钙黏蛋白(cadherin)表达下调所致。
3.5细胞保护和能动性机制 TFF3通过PI3K/Akt信号通路促进黏膜细胞完整性和抗凋亡。外源TFF3也可保护HCT116结肠癌细胞和正常大鼠小肠上皮细胞(IEC)-6上皮细胞免于细胞凋亡。这种影响可被渥曼青霉素(wortmannin)和酪氨酸磷酸化抑制剂A25翻转,表明PI3K和EGFR的激活可能参与TFF3的抗凋亡过程〔37〕。TFF3阳性HT-29细胞系中PI3K激活的下游产物磷酸化AKT的表达升高。TFF3可以减轻脂多糖诱导的胃黏膜细胞(GES)-1细胞凋亡,细胞活力降低及受损的细胞紧密连接。抑制活化PI3K/Akt通路,TFF3对GES-1细胞保护作用下降,可见TFF3促进胃黏膜上皮细胞增殖、迁移及抗凋亡,维持胃黏膜上皮完整性,是通过PI3K/Akt信号通路的活化介导的〔32〕。TFF3可以通过活化PI3K和EGFR抑制化疗药依托泊甙通过p-53途径导致胃癌细胞系死亡,然而在TFF3缺陷小鼠模型未检测到Fas或TNF受体介导的凋亡途径或凋亡相关蛋白Bcl-2、Bax、Bad或Bcl-xL基因表达差异〔37〕。TFFs在上皮重建中也有关键作用,上皮重建的第一步是减少细胞间接触,3个TFF肽均可诱导黏着小带E-cadherin/β-catenin复合体下调,利于TFF的促迁移作用。Meyerzum Buschenfelde等〔38〕转染稳定表达Flag标签的人TFF3后,TFF3通过下调E-cadherin、增加紧密连接蛋白(Claudin)-1水平和降低Claudin-2途径影响HT29、MDCK细胞的黏附连接功能,促进细胞迁移。一个完整的P结构域或二聚体均不能促进细胞移行,TFF3的促修复活性与其突变体激活MAPK相关,不受EGF受体磷酸化调控。相反,只有完整的ITF才能保持HCT116和IEC-6细胞中PI3K和EGF受体活性,发挥抗凋亡作用。这些结果提示TFF3对细胞迁移和凋亡的影响是通过不同的细胞内信号转导途径介导的〔39〕。
4 TFF3敲减和过表达的体内外效应
4.1体内效应 TFF3-/-小鼠角膜创伤修复时间明显比TFF3+/+小鼠延长〔40〕。 TFF3-/-缺陷小鼠结肠细胞凋亡增加、黏膜愈合能力明显减弱,并且更易罹患化疗和放疗所致的黏膜炎,增加口服硫酸葡聚糖引起的大肠炎死亡率〔41〕。相反,Marchbank等〔42〕研究发现TFF3缺陷的小鼠细胞凋亡相对增强,且与应激或受体相关的细胞死亡调节因子Fas或Bcl无关。空肠异常表达大鼠TFF3的转基因小鼠,并未增加细胞增殖、迁移和凋亡的改变。
4.2体外效应
4.2.1TFF3过表达与敲减抑制和诱导凋亡 外源TFF3可以拮抗血清饥饿引起人结肠癌HCT116细胞和大鼠肠上皮细胞凋亡〔37〕。同样,TFF3通过增加肠上皮细胞NF-κB激活 (p50/p65)异源二聚体的活性,增强IEC-18细胞的抗凋亡能力,NF-κB阻断剂则显著降低IEC-18细胞的抗凋亡能力。相反,反义TFF3能增加人胃癌细胞的化学敏感性和凋亡。以TFF3抗体中和分泌性TFF3促进乳腺癌细胞凋亡〔43〕。然而Rosler等〔44〕在软骨性骨关节炎研究中提出TFF3促凋亡,发现TFF3通过活化MMP增加软骨细胞凋亡诱导。
4.2.2TFF3过表达与敲减在细胞增殖中的作用 Sun等〔33〕报道TFF3通过活化PI3K/Akt通路促进胃黏膜上皮细胞增殖,与rTFF3通过活化 ERK1/2信号通路促进胃内皮GES-1细胞系增殖相似。此外,乳腺癌和前列腺癌细胞过表达TFF3明显促进细胞增殖和提高活力〔43,45〕。相反,Uchino等〔46〕研究表明TFF3抑制结直肠癌细胞系增殖,结肠癌细胞系LoVo和SW837中稳定转染TFF3,过表达TFF3的细胞在体外或接种到动物体内生长速度明显减慢,而且这一效应的发生与EGFR诱导的MAPK/ERK的磷酸化及其活性抑制相互伴随。在外源rTFF3作用24 h后人角膜上皮细胞生长减慢〔47〕。
4.2.3TFF3过表达与敲减在迁移、侵袭中的作用 TFF3促进甲状腺乳头状癌K1细胞、口腔上皮、人支气管上皮细胞增殖、迁移〔48〕。rTFF3增加小肠上皮IEC-6细胞系划痕愈合速度〔49〕。TFF3也能促使胃GES-1细胞系和人结肠癌细胞系迁移和侵袭。与此同时,无侵袭性大鼠结肠癌细胞转染TFF3后增加了细胞的迁移、侵袭和恶性行为。siRNA介导敲低转移大鼠结肠癌细胞系TFF3表达则明显抑制迁移和侵袭〔18〕。前列腺癌和乳腺癌过表达TFF3增加细胞软琼脂成瘤能力,促进细胞迁移和浸润〔43,45〕。过表达TFF3的乳腺癌细胞促进裸鼠移植瘤的生长,抗体中和TFF3后,可阻滞移植瘤生长〔43〕。
综上,TFF肽的表达变化似乎是许多类型肿瘤的共同特征。TFF3影响致癌过程的关键功能如:细胞存活、凋亡、细胞迁移和侵袭调节。然而TFF3作为一个广泛的一般标记癌症潜在标志物,寻找新的诊断策略,具有挑战性,能为未来的靶向癌症提供有用的新治疗工具。
