脓毒症大鼠IL⁃6、TNF⁃α、TH水平和D2活性变化及血必净注射液的干预研究
2018-08-30赵露茜朱国栋张靖轩杨自力
赵露茜 朱国栋 张靖轩 杨自力
广州市第一人民医院,华南理工大学附属第二医院,老年病科(广州 510180)
脓毒症伴非甲状腺疾病综合征(nonthyroid illness syndrome,NTIS)在临床重症患者中非常常见,目前大多数学者认为,导致NTIS中枢和外周甲状腺激素水平改变最主要的因素是炎性细胞因子。有研究认为,炎症反应状态下,肿瘤坏死因子(TNF)可能通过影响下丘脑伸长细胞2型脱碘酶(D2)的表达进而导致NTIS[1-2],但有关炎性细胞因子对D2的影响研究尚少。目前尚无明确的证据说明甲状腺激素替代治疗的益处,大多数人仍支持针对原发疾病的治疗改善NTIS。血必净注射液是由红花、川芎、赤芍、丹参、当归等组成的复方中药制剂,具有拮抗内毒素、抗炎、改善免疫功能、改善凝血、保护组织细胞的作用[3-4],近年来被逐步推广应用于脓毒症治疗,但其在治疗脓毒症的同时是否对NTIS也存在一定的影响,其机制是否与干扰炎症因子对D2的影响有关,目前尚未见相关报道。因此,本文章通过实验研究对此进行了进一步探讨。
1 材料与方法
1.1 大鼠盲肠结扎打孔(CLP)脓毒血症模型的建立成年雄性SD大鼠100只,体重220~250 g,SPF级,随机分为手术组(78只)和非手术组(22只)。手术组再分为真手术组(52只)和假手术组(26只),真手术组大鼠建立盲肠结扎打孔(Cecal ligation and puncture,CLP)脓毒血症模型,具体操作参考文献方法[5-6],假手术组大鼠则于相同时间施以假手术,其余处理同CLP造模过程,观察并记录造模前后大鼠精神状态、活动、进食、毛发、反应能力。
1.2 分组及给药处理造模成功后,剔除死亡大鼠,各组大鼠按以下方法处理:A、正常组(n=22):未施手术,自由进食及饮水,静脉注射生理盐水5 mL/kg,每12 h一次;B、假手术组(n=24):施以假手术,术后静脉注射生理盐水5 mL/kg,每12 h一次;C、模型组(n=22):建立CLP脓毒血症模型,模型成功后静脉注射生理盐水5 mL/kg,每12 h一次;D、血必净组(n=22):建立CLP脓毒血症模型,模型成功后1 h内静脉注射血必净注射液5 mL/kg(约为60 kg成人50 mL/次的等效剂量),每12 h一次。
1.3 大鼠血清甲状腺激素及IL⁃6、TNF⁃α水平检测分别于药物处理后12 h、24 h腹主动脉采血后,颈椎脱臼处死大鼠,RIA(放射免疫分析技术)测定血清T3、T4及TSH水平,ELISA(酶联免疫吸附法)检测大鼠血清IL⁃6、TNF⁃α水平。
1.4 大鼠下丘脑、脂肪组织D2 mRNA含量检测取出大鼠脑下丘脑,称重后暂于-4℃保存。同时取大鼠肩胛间区新鲜皮下脂肪组织,称重后低温保存。采用Qpcr(实时荧光定量聚合酶链反应)测定以上两种组织中D2的mRNA相对表达量。
1.5 统计学分析采用SPSS20.0分析软件,对数据进行统计学分析,计量资料采用±s描述数据,同组不同时间段之间两两比较采用配对t检验,方差不齐者采用配对秩和检验;多组独立样本比较采用单因素方差分析(one⁃way ANOVA),两两比较采用Bonfferoni法,方差不齐者或小样本资料则采用H检验。P<0.05认为差异有统计学意义。

表1 实时荧光定量PCR反应体系Tab.1 RNA quantitative test through Real⁃time fluorescent PCRreaction system μL
2 结果
2.1 大鼠一般情况观察及CLP模型的评估实验过程中意外死亡大鼠10只,其中正常对照假手术组死亡2只,模型组死亡4只,血必净组死亡4只。剩余90只大鼠进入结果分析。盲肠结扎穿孔16 h后,随机选择2只术后大鼠,打开其腹腔,可闻及恶臭味,肉眼观察可见肠蠕动减弱、小肠明显水肿、肠壁可见出血点、肠管内有浑浊液体积聚。结合文献报道[7],判定本研究中CLP模型造模成功。
2.2 各组大鼠血清甲状腺激素水平药物处理后12 h观察,CLP模型组大鼠T3及TSH水平较正常组及假手术组大鼠降低(均P<0.01),给予血必净注射液静脉注射后,可不同程度提高大鼠血清T3及TSH水平,与模型组比较均具有统计学意义(P<0.05或P<0.01)。而12 h后观察CLP大鼠T4水平虽较正常大鼠稍微下降,但与正常组及假手术组比较均无统计学意义(P>0.05,表2)。
表2 药物处理12 h后各组甲状腺激素水平比较Tab.2 Comparison of thyroid hormone levels in each group after drug treatment for 12 hours ± s

表2 药物处理12 h后各组甲状腺激素水平比较Tab.2 Comparison of thyroid hormone levels in each group after drug treatment for 12 hours ± s
注:与正常组比较,*P<0.01;与假手术组比较:▲P<0.01;与模型组比较,△P<0.05,△△P<0.01
组别正常组假手术组模型组血必净组F值P值n 10 10 10 10 0 T3(nmol/L)1.90±0.27 1.95±0.22 1.16±0.19*▲1.51 ± 0.11△△31.7 0.0000 T4(nmol/L)53.39±5.95 52.91±7.46 50.67±7.62 51.76±8.92 0.26 0.8544 TSH(μIU/mL)1.90±0.28 1.62±0.20 1.30±0.26*▲1.67±0.32△8.49 0.0002
药物处理后24 h观察,CLP模型组大鼠T3、T4及TSH水平均较正常组及假手术组大鼠降低(P<0.01),给予血必净注射液静脉注射后,可不同程度提高大鼠血清T3、T4及TSH水平,与模型组比较均具有统计学意义(P<0.05,表3)。
进一步观察血必净注射液作用时间的长短对甲状腺激素的不同影响,结果发现,随着脓毒症时间的延长,CLP模型组大鼠甲状腺激素水平均逐渐下降,24 h后的血清T3、T4、TSH水平均比12 h更低,三者不同时段的水平差别均具有统计学意义(P<0.01);给予血必净注射液处理24 h后T3、TSH水平回升明显较处理12 h更明显(P<0.01),提示血必净注射液可影响大鼠血清T3、TSH水平,而对T4的影响不明显(图1~3)。
表3 药物处理24 h后各组甲状腺激素水平比较Tab.3 Comparison of thyroid hormone levels in each groupafter drug treatment for 24 hours ± s

表3 药物处理24 h后各组甲状腺激素水平比较Tab.3 Comparison of thyroid hormone levels in each groupafter drug treatment for 24 hours ± s
注:与正常组比较,*P<0.01;与假手术组比较:▲P<0.01;与模型组比较,△P<0.05,△△P<0.01
TSH(μIU/mL)1.89±0.25 1.62±0.23 1.15±0.28*▲1.77 ± 0.39△△14.84 0.0000组别正常组假手术组模型组血必净组F值P值n 12 14 12 12 T3(nmol/L)1.82±0.26 1.92±0.23 0.98± 0.22*▲1.88± 0.19△△47.22 0.0000 T4(nmol/L)53.62±5.63 52.43±7.53 43.38±6.78*▲53.15±9.14△5.25 0.0034

图1 各组治疗后不同时段血清T3水平比较Fig.1 Comparison of serum T3 levels in different groups after treatment

图2 各组治疗后不同时段血清T4比较Fig.2 Comparison of serum T4 levels in different groups after treatment
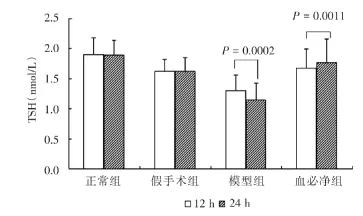
图3 各组治疗后不同时段血清TSH比较Fig.3 Comparison of serum TSH levels in different groups after treatment
2.3 各组大鼠血清IL⁃6、TNF⁃α水平CLP模型组大鼠血清IL⁃6、TNF⁃α水平于造模后12 h及24 h均较正常大鼠明显升高,与正常组及假手术组比较均具有统计学意义(P<0.01),给予血必净注射液处理后均可使二者的水平不同程度下降,与同时间点CLP模型组比较均具有统计学意义(P<0.01)。另外,药物处理24 h较处理12 h的大鼠血清IL⁃6、TNF⁃α水平更低,提示随着药物作用时间的延长,对IL⁃6、TNF⁃α的改善则更加明显(表4,图4)。

表4 不同时段各组大鼠血清IL⁃6、TNF⁃α水平比较Tab.4 Comparison of serum IL⁃6 and TNF⁃α levels in rats of different groups at different time pg/mL,x ± s
2.4 各组大鼠下丘脑及脂肪组织D2mRNA相对表达量分别于不同时段提取大鼠下丘脑及脂肪组织总RNA,qPCR检测D2基因相对表达量。成模后12 h、24 h,CLP模型组大鼠下丘脑D2含量均较正常组及假手术组大鼠升高(P<0.01),予血必净注射液处理12 h后D2含量未见明显改变,与CLP模型组比较无统计意义(P>0.05);予血必净处理24 h后下丘脑D2含量较CLP模型组下降(P<0.01),但未接近正常正常水平(P>0.05)。同时检测脂肪组织D2表达量,结果发现,成模后12 h、24 h,CLP模型组大鼠脂肪组织D2表达量均较正常组及假手术组大鼠下降,(P<0.01),予血必净注射液处理后12 h及24 h D2表达量均可见不同程度的回升,与同时间点模型组比较均具有显著统计学意义(P<0.01),而且基本接近正常组及假手术组水平(P>0.05,表5)。

图4 治疗后各组不同时段血清IL⁃6、TNF⁃α水平变化Fig.4 Serum IL⁃6 and TNF⁃α levels in different groups after treatment
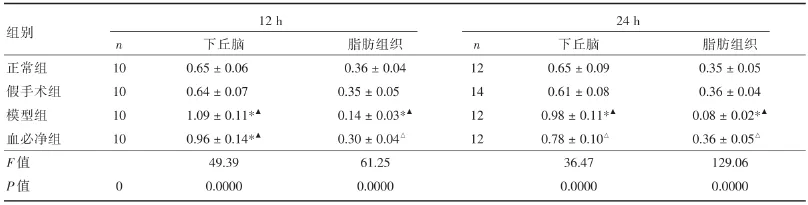
表5 不同时段各组大鼠下丘脑及脂肪组织D2mRNA表达量比较Tab.5 Comparison of D2mRNA expression in hypothalamus and adipose tissue of rats in different groups at different time points pg/mL,x± s
3 讨论
NTIS是指很多临床状态下发生,如感染、创伤、外科手术后、肾功能不全、急性心肌梗死、呼吸衰竭、异体骨髓移植、系统性红斑狼疮、营养不良、饥饿等情况[8-9],国外研究表明,脓毒症与NTIS密切相关[10],但其中的机制尚未完全阐明。有研究认为,炎症因子与脱碘酶在NTIS病理过程中发挥了重要作用,因处于炎症反应状态的患者,其体内的 TNF⁃α、IL⁃1、IL⁃6 等细胞因子大量分泌,使得D1和D2的活性减弱,导致T4转化为T3减少;同时细胞因子可增强D3的活性,使T4转化为rT3增多、T3转化为T2增多,从而增加了甲状腺激素的灭活[11]。有研究报道,与炎症相关的信号的激活可引起局部组织D2表达升高[12]。因此进一步推测炎症细胞因子TNF可能与D2表达增强有关。由于D2是正常甲状腺人群血清T3的主要来源,因此有研究认为,D2功能受损导致T3生成障碍可能是NTIS低T3综合征的主要原因[13-14]。有研究证实[15-16],在感染性疾病中,内毒素可直接引起下丘脑伸长细胞中的D2 mRNA表达升高,引起T4转化为T3增多,一方面可保证脑组织的能量代谢需要,但另一方面,T3过度累积可引起组织特异性甲状腺毒症,最终导致感染相关性中枢性甲状腺机能减退。然而,内毒素引起的伸长细胞D2表达升高是一种保护性生理反应,还是一种对机体有害的伴随现象,目前仍然不清楚,针对可调节D2水平变化的临床用药尚待开发。
血必净注射液在临床重症炎症患者中运用较广。它是由我国中西医结合急救医学奠基人王今达教授以古方血府逐瘀汤为基础,在“菌(细菌)、毒(内毒素)、炎(炎症介质)并治”的理论指导下研制而成,主要由红花、赤芍、川芎、丹参、当归等活血化瘀药组成,主要有效成分包括红花黄色素A、川芎嗪、丹参素、阿魏酸、芍药苷等,具有清热凉血、行气活血、解毒止痛之功效。研究发现血必净注射液可以保护内皮细胞、直接拮抗内毒素及其诱导释放的炎性介质,对重症炎症患者起到积极的治疗作用[17],临床常用于全身炎症反应综合征(SIRS)、脓毒症及MODS等疾病。另有研究报道[3],在脓毒症早期使用血必净注射液可促进大鼠纤溶系统的激活,改善微循环。此外,血必净注射液能明显抑制脓毒症大鼠肝脏低氧诱导因子-1α(HIF⁃lα)、iNOS的基因和蛋白表达水平,降低其诱导的炎症介质过度生成及释放,进而减轻多器官炎症反应、防止脓毒症的进一步发展,最终对改善预后起着积极影响[18-19]。目前对于血必净注射液治疗脓毒症的研究,多集中在临床疗效观察,及血清学炎性相关指标等,而对于其在治疗脓毒血症过程中甲状腺激素的变化则暂未见报道。因此,本研究对此试做探讨。
本研究结果提示,血必净注射液可显著降低脓毒症大鼠IL⁃6、TNF⁃α水平,同时可提高其血清T3、T4、TSH水平,并可在某种程度上提高脓毒症大鼠下丘脑D2的基因表达。通过此现象,我们推测血必净可启动脓毒症大鼠体内保护性调节机制,促进T4转化为T3,以保证中枢神经系统T3供给,引起下丘脑D2表达减弱。而在外周组织,则随着脓毒症造模时间的延长,脂肪组织中D2表达量下降,推测这可能与炎症状态下TNF⁃α、IL⁃6等细胞因子大量分泌、使得组织的D2活性减弱有关。国外研究报道,炎症通路NF⁃κB的激活可引起局部组织D2表达升高[20],但本课题实验结果中发现,予血必净注射液处理后,随着炎性细胞因子TNF⁃α、IL⁃6水平的降低,脂肪组织下降的D2活性亦有所回升,因此,一定程度上验证了炎性因子可能抑制脂肪组织D2的表达。因此本研究认为,血必净注射液对CLP大鼠不同组织D2及甲状腺激素水平的调节作用是通过作用于炎性细胞因子,拮抗内毒素及其诱导释放的炎性介质来实现。
