IFN⁃γ通过下调PD⁃1和PD⁃L2信号通路拮抗CD33来干预肺结核发展的机制
2018-08-30张艳丽杨卫武丽李福建张贵贤
张艳丽 杨卫 武丽 李福建 张贵贤
1保定市传染病医院结核科(河北保定 071000);2保定市第一中心医院呼吸科(河北保定 071000)
结核病(tuberculosis,TB)每年导致860万新病例和170万人死亡[1]。表达IFN⁃γ的Th1细胞和产生IL⁃17的Th17细胞在控制结核感染中起关键作用。最近,髓系来源的抑制性细胞(MDSC)与T细胞反应的不平衡相关并参与TB的疾病进展。MDSC具有抑制T细胞应答的强大能力。MDSCs可分为两类:显示CD14⁃CD15+CD11b+CD33+HLA⁃DRlow/-表型的粒细胞MDSCs和具有CD14+CD15⁃CD11b+CD33+HLA⁃DRlow/-表达的单核细胞MDSCs[2]。高度抑制的MDSC通过细胞—细胞相互作用发挥其功能,包括共刺激/抑制分子如B7⁃H1(PD⁃L1)、B7⁃H3[3]、CD40和CD80。在IFN⁃γ存在的情况下通过GM⁃csf和IL⁃6体外产生人CD33+MDSC可用作鉴定IFN⁃γ的功能。
1 对象与方法
1.1 研究对象活动性肺结核(LTBI)患者120例,LTBI患者80例,健康体检者40例。所有参与者都是成年人,不包括孕妇和儿童。肺结核的诊断基于阳性痰涂片和(或)培养结果和胸片。对于细菌培养结果阴性的患者,通过胸片、临床症状确诊,经抗结核化疗后症状改善和影像学改善。健康人从本院进行健康体检随机抽取。健康个体筛选标准:(1)无发热,咳嗽或其他活动性结核体征;(2)体格检查结果正常,X线正常;(3)TST检查,T⁃SPOT阴性。排除标准:恶性肿瘤,HIV感染或摄入免疫抑制剂的个体。
1.2 体外产生人类MDSC通过聚蔗糖梯度离心从健康个体分离PBMC,并在含有10%FBS(Sigma Aldrich,Munich,Germany),2 mmol谷氨酰胺,100 IU/mL青霉素和100 mg/mL链霉素的RPMI⁃1640培养基。为了产生功能性MDSC,在重组人细胞因子GM⁃csf,IL⁃6(10 ng/mL)和 IFN⁃γ(10 ng/mL)(R&D Systems,Minneapolis,MN,USA)的存在下,在完全培养基中以5×105个细胞/mL在T⁃25烧瓶中培养PBMC 7 d。用单独培养基和单核细胞培养的PBMC[通过磁性活化细胞分选抗CD14微珠(BD Pharmingen)分离]用作对照。培养操作重复运行。培养基和细胞因子每3天进行一次。1周后,收集所有细胞并除去贴壁细胞。通过FACSAria细胞分选仪(BD Biosciences,San Jose,CA,USA)分离CD33+或CD33+HLA⁃DR+/-细胞。
在BD LSRFortessa流式细胞仪(BD Bioscienc⁃es,Franklin Lakes,NJ,USA)上测量细胞并使用Facs Diva软件(BD Biosciences,San Jose,CA,USA)进行分析。使用FlowJo软件(Tree Star Inc,Ash⁃land,OR,USA)进行数据分析。通过流式细胞术发现分离的细胞群的纯度为90%。
1.3 流式细胞仪为了表面染色,收获PBMC,洗涤并用荧光缀合的mAbs或同种型匹配的对照的混合物在冰上染色30 min。MDSC的表型通过CD11b(ICRF44),CD33(WM53),HLA⁃DR(G46⁃6),CD14(MφP9),CD15(W6D3),CD80(BB1),CD86(2331),PD⁃L1(MIH1)和PD⁃L2(MIH18)的表达来评估。通过CD4(RPA⁃T4),CD8(RPA⁃T8),HLA⁃DR(L243),CD25(M⁃A251)和 CD69(FN50)(均来自BDPharmingen)来评估T细胞的表面表达。对于细胞内染色,在brefeldin A(eBioscience)存在下用佛波醇肉豆蔻酸酯乙酸酯(PMA)和伊屋诺霉素(Invitrogen,Carlsbad,CA)模拟细胞4 h,然后收获。表面染色后,将细胞固定,透化并用IFN⁃γ(B27),Foxp3(236A/E7)和相应的同种型对照(BD Pharmingen)染色。用膜联蛋白V(BD Pharmingen)和PI(BD Pharmingen)染色检测细胞活力和细胞死亡。在流式细胞仪(BD LSRFortessa)(BD Biosci⁃ences)上通过流式细胞术分析细胞表型。数据是作为活细胞门内设置的50 000个事件中标记细胞的分数获得的,并使用FlowJo软件(Tree Star)进行分析。
1.4 T细胞抑制测定分选CD33+或CD33+HLA⁃DR+/-细胞的抑制功能通过在下列抑制测定中抑制自体T细胞增殖的能力来测定。通过抗-CD3微珠和磁性柱分离(Miltenyi Biotec)从PBMC分离的T细胞被CFSE标记(5 μmol/L,Sigma⁃Aldrich),并以1×105个细胞/孔接种在96孔平板中。先前从细胞因子诱导培养系统分离的CD33+或CD33+HLA⁃DR+/-与CD3+T细胞以1∶4,2∶4和4∶4的比率共培养。通过抗CD3/CD28(1 μg/mL)和IL⁃2(50 U/mL;R&D Systems)诱导T细胞增殖。3 d后分析CD4+或CD8+T细胞的增殖。对于所指出的研究,将FACS分选的抑制细胞与T细胞在下列抑制剂存在下共培养:10 mmol/L NG⁃单甲基-L-精氨酸(L⁃NMMA),100 μmol/L N⁃羟基-正-L-精氨酸(NOHA)(Sigma⁃Aldrich)和 10 μg/mL抗 PD⁃1和IgG对照(R&D Systems)。以15 000个事件的活淋巴门控细胞的增殖百分比获得数据。
1.5 T细胞的增殖原代CD4+T细胞(CD4+CD45RO⁃CD62LhiCD25⁃)由 PBMC 阴性选择磁珠(BD Pharmingen)纯化,分离的T细胞群的纯度为95%。在Th1或Treg倾斜条件下,在96孔U形底板中以1×105个细胞/mL切下初始CD4+T细胞。Th1 条件:在 IL⁃12(10 ng/mL)和 IFN⁃γ(10 ng/mL)存在下用平板结合的抗CD3(4μg/mL),抗CD28(1μg/mL)刺激初始T细胞。5 d后,用重组IL⁃2(50 U/mL)(BD Pharmingen)补充培养物。Treg条件:在TGF⁃β(5 ng/mL)和IL⁃2(10 ng/mL),抗IFN⁃γ(10μg/mL)和抗IL⁃4(10μg/mL)存在下,用平板结合的抗-CD3(4 μg/mL),抗-CD28(1 μg/mL)刺激初始T细胞。培养基每3天添加一次细胞因子和中和抗体。第7天,在IL⁃2(10 ng/mL)存在下收获细胞,洗涤,计数并与先前分离的CD33+HLA⁃DR+细胞以1∶1的比率共培养。第12天,分析细胞的IFN⁃γ产生和FoxP3表达。
1.6 Transwell分析从细胞因子诱导培养系统分离的CD33+HLA⁃DR+/-细胞在抗CD3/CD28(1 μg/mL)和IL⁃2(10 ng/mL)存在下与自体CFSE标记的CD3+T细胞以1∶2的比率共培养3 d。当将CD3+T细胞置于上Transwell室(Costar⁃Corning,Amsterdam,The Netherlands)时,将 CD33+HLA⁃DR+/-细胞置于下Transwell室中。
1.7 一氧化氮(NO)按照制造商的方案(Promega,Madison,WI)测量血浆中的NO含量。将等体积的上清液(50μL)与Greiss试剂A和B混合,并在室温下避光孵育10 min。使用酶标仪(Bio⁃Rad,Hercules,CA)测量550 nm处的吸光度。通过比较测试样品的吸光度值与通过连续稀释0.25 mmol/L亚硝酸钠产生的标准曲线来确定亚硝酸盐浓度。
1.8 精氨酸酶活性测定在来自分离的CD33+HLA⁃DR+细胞的细胞裂解物中测量精氨酸酶的活性[33]。简而言之,将细胞用0.1%Triton X⁃100裂解30 min,随后加入25 mmol/L TrisHCl。通过在56℃加热10 min使酶活化。通过将裂解物与0.5 M L-精氨酸和10 mmol/L MnCl2在37℃孵育120 min进行精氨酸水解。加入α-异亚硝基苯丙酮(溶于100%乙醇)后,在95℃加热30 min,用酶标仪(Bio⁃Rad)在540 nm处测量尿素浓度。基于连续稀释的尿素标准曲线计算尿素含量(以上使用的药剂均来自德国慕尼黑的西格玛奥德里奇公司)。
1.9 统计学方法分别使用GraphPad Prismversion 5.0和SPSS Statistics 17.0,通过单因素方差分析(ANOVA)和Kruskal⁃Wallis检验评估临床患者中MDSC水平的变化。如果发现显著差异,则进行学生t检验以分析组之间的差异。使用Spearman秩和检验分析不同参数之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 结核病患者外周血单核细胞MDSCs水平升高与HC相比,在TB患者中清楚地观察到HLA⁃DR-/lowCD11b+CD33+MDSCs的显著更高的群体。MDSCs主要是CD14阳性而不是CD15阳性。LTBI患者的MDSCs水平显著高于HC患者,未经治疗的活动性结核病患者的MDSCs水平高于LTBI患者,接受抗结核治疗的结核病患者中MDSCs的频率显著降低。见图1。

图1 MDSCs在结核病患者中的扩展Fig.1 The expansion of MDSCs in tuberculosis patients
2.2 MDSC频率与Th1的百分比呈负相关在HC中检测到较低水平的IFN⁃γ或产生IL⁃17的CD4+T细胞。同时,在M.tb肽刺激后MDSCs的百分比显著降低。MDSCs百分比与结核病患者Th1频率成反比。见图2。
2.3 GM⁃csf和IL⁃6诱导的CD33+HLA⁃DRlow细胞抑制T细胞增殖功能性CD33+MDSC样细胞是HLA⁃DR+细胞而不是 HLA⁃DR⁃细胞。当与 HLA⁃DR高单核细胞比较时,CD33+HLA⁃DR+MDSC样细胞几乎是HLA⁃DR低表型。与配对的CD33+HLA⁃DR细胞相比,GM⁃csf和IL⁃6诱导的CD33+HLA⁃DRlow细胞能够以剂量依赖的方式抑制自体T细胞的增殖。见图3。
2.4 IFN⁃γ受体CD33+HLA⁃DRlow MDSCs表现出抑制功能下降GM⁃csf和IL⁃6诱导的CD33+HLA⁃DRlowMDSC与相应的IFN⁃γ受体化的MDSC相比,具有更强的抑制自体T细胞的能力。而CD33+HLA⁃DR-细胞显示非抑制活性。与细胞因子诱导的CD33+HLA⁃DRlowMDSC共培养后,分析自体CD3+T细胞上CD69,CD25和HLA⁃DR的活化标志物的表达。IFN⁃γ-培养的CD33+HLA⁃DRlowMDSC抑制T细胞活化程度较低,而GM⁃csf和IL⁃6诱导的CD33+HLA⁃DRlowMDSC显著抑制自体T细胞的活化。见图4。

图2 MDSC频率与Th1在TB患者中呈负相关Fig.2 MDSCfrequency was negatively correlated with Th1 in TBpatients
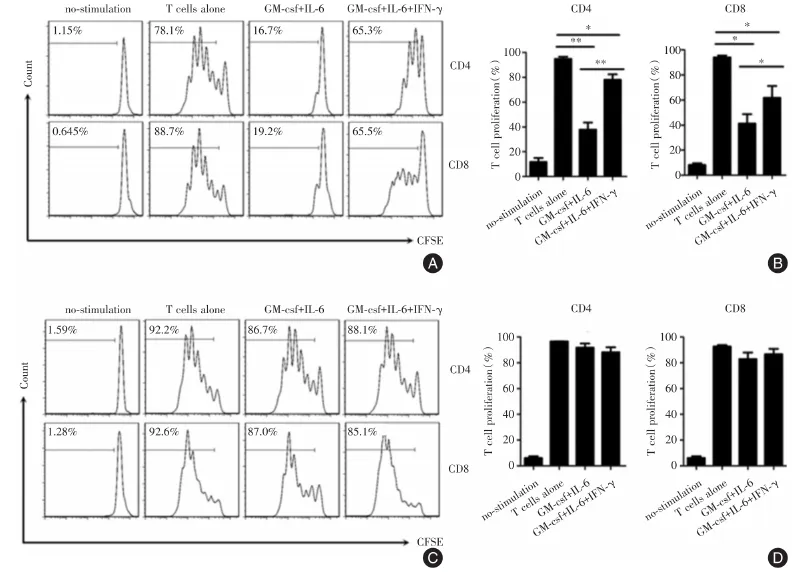
图3 IFN⁃γ教育抑制CD33+HLA⁃DRlow MDSC抑制T细胞增殖Fig.3 IFN⁃γ educate inhibition CD33+HLA⁃DRlow MDSCinhibition of T cell proliferation
细胞内流式细胞术分析表明,受IFN⁃γ培养的CD33+HLADRlowMDSC在较小程度上阻碍产生IFN⁃γ的 CD4+T,而 GM⁃csf和 IL⁃6诱导的 CD33+HLA⁃DRlowMDSC显著抑制CD4+T细胞中的IFN⁃γ产生。此外,GM⁃csf和IL⁃6诱导的CD33+HLA⁃DRlowMDSCs与IFN⁃γ⁃受体相比诱导更高水平的FoxP3+CD4+T细胞。
3 讨论
MDSCs与人类结核感染的进展密切相关,MD⁃SCs在活动性结核病患者以及LTBI患者的外周血中均有扩增[4-6]。此外,药物治疗减少了MDSC的积累。有证据表明MDSCs可以作为结核病治疗反应的标志物。有趣的是,最近接触结核病的结核菌素皮试(TST)(+)个体中MDSC的频率高于远程接触结核病。活动性结核病患者的MDSC比具有LTBI的患者具有更广泛的抑制作用。MDSCs的蓄积和功能与病原菌的加载或炎症微环境有关。MDSC功能与病原体负载无关,尽管它们能够摄取M.tb。鉴于MDSCs有较高可塑性,笔者设想在M.tb慢性炎症过程中微环境中的免疫介质可影响MDSCs的积累和功能。具有潜伏感染的个体通常获得有效的T细胞应答保护,而患有活动性结核病,晚期或播散性疾病的患者缺乏有效的T细胞免疫[7-9]。同抑制效应T细胞反应与活跃性结核或播散性疾病中MDSCs的旺盛扩增有关[10]。本研究显示,MDSCs的扩增与IFN⁃γ+CD4+T细胞呈负相关。众所周知MDSCs能够抑制IFN⁃γ+CD4+T细胞的产生。

图4 IFN⁃γ教育抑制CD33+HLA⁃DRlow MDSCs抑制T细胞活化Fig.4 IFN⁃γ educate inhibition CD33+HLA⁃DRlow MDSCs from inhibiting Tcell activation
IFN⁃γ最近被认为是MDSC扩增和小鼠免疫抑制功能的基本分子[11-12]。一方面,据报道,IFN⁃γ通过降低抗凋亡蛋白Bcl2a的表达负调节粒细胞-MDSC的存活,并连续抑制粒细胞-MDSC的抑制功能,阻断IFN⁃γ直接损害单核细胞-MDS的抑制功能[13-15]。另一方面,在具有 IFN⁃γ-或 IFN⁃γR-/-肿瘤的小鼠中,MDSC的表型,积累和抑制功能与来自野生型小鼠的相似物类似,表明IFN⁃γ不是MDSC的关键调节剂。表明IFN⁃γ处理将人肿瘤相关巨噬细胞(TAM)从免疫抑制转变为免疫刺激细胞并阻止TAM从其前体产生。到目前为止,关于IFN⁃γ对人MDSC的影响知之甚少。来自健康个体的IFN⁃γ-培养的CD33+HLA⁃DRlowMDSC比GM⁃csf和IL⁃6-诱导的CD33+HLADRlowMDSC具有更少的抑制性质,作为T细胞活化,增殖和IFN⁃γ产生的恢复以及Treg诱导减少的证据。故IFN⁃γ抑制了人类MDSCs的抑制功能。由GM⁃csf和IL⁃6诱导的MDSC产生的免疫抑制的唯一子集是CD33+HLA⁃DRlow细胞群,和CD33+HLA⁃DR-细胞完全没有抑制活性。抑制性活动可能不是MDSCs的稳定特征,而是暂时的状态,这将由MDSCs迁移的微环境中的本地信号改变。

图5 IFN⁃γ教育抑制CD33+HLA⁃DRlow MDSC抑制Th1应答并且促进Treg扩展Fig.5 IFN⁃γ educate inhibition CD33+HLA⁃DRlow MDSCinhibitis of Th1 responses and promotes Treg expansion
本研究表明,CD33+HLA⁃DRlowMDSC的免疫抑制活性通过阻断PD⁃1而显著减少,CD33+HLA⁃DRlowMDSC的免疫抑制功能是PD⁃1/PD⁃Ls途径依赖性的。然而,PDL1在细胞因子诱导的MDSC中的可比较的表达水平不能支持PD⁃L1在受IFN⁃γ培养的抑制性较弱的MDSC上的作用。PD⁃L1的中和不会消除未治疗的慢性淋巴细胞性白血病患者外周血中PD⁃L1hiCD11b+CD33+CD14+HLA⁃DR1单核细胞MDSCs的免疫抑制功能。值得注意的是,尽管PD⁃L1可能是显性负抑制分子,但PD⁃L2被认为是可能的第二重要抑制分子。PD⁃L2与PD⁃1的相对亲和力高于PD⁃L1,因此如果PD⁃L1在相同水平上表达,PD⁃L1与PD⁃L1结合的能力会超出PD⁃L1。因此,与IFN⁃γ-受教育的CD33+HLA⁃DRlowMDSC相比,更高水平的PD⁃L2负责GM⁃csf和IL⁃6诱导的CD33+HLA⁃DRlowMDSC更强的抑制功能。
综上所述,MDSCs的积累与TB的疾病进展有关。此外,M.tb感染诱导了一个适当的微环境来驱动MDSCs的积累,其抑制适应性免疫反应以促进持续感染。而且,产生IFN⁃γ的细胞通过抑制细胞-细胞接触介导的免疫抑制来抑制MDSC的抑制活性,从而增强了抗分枝杆菌反应以控制疾病进展。
