HPLC法同时测定大鼠尿样中秦皮甲素和秦皮乙素的浓度
2018-08-30杨建华迪丽拜尔马木提王晓梅胡君萍
杨建华, 迪丽拜尔·马木提, 王晓梅, 王 梅, 胡君萍
(新疆医科大学1第一附属医院药学部; 2药学院, 乌鲁木齐 830011)
药物的排泄是药代动力学研究的主要部分,经尿液及粪便排泄是药物排出体外的主要途径,能较直观反映药物的体内代谢过程和排泄特征,其中药物的肾脏排泄是目前大多数药物的最主要排泄途径[1]。秦皮甲素和秦皮乙素均属于香豆素类化合物,是毛菊苣(Cichoriumglandulosum)保肝作用的主要有效成分[2-4]。本课题组前期对毛菊苣药材中秦皮甲素、秦皮乙素等5种主要成分进行了含量分析[5],并研究了两者在大鼠体内的药物代谢动力学[6]以及在大鼠尿液中的代谢产物[7]。本实验采用固相萃取富集大鼠尿液中的秦皮甲素和秦皮乙素,用HPLC法进行分离测定,建立了HLPC法同时测定大鼠尿中秦皮甲素与秦皮乙素的方法,并初步探索了其在大鼠尿中的药动学行为,现报道如下。
1 仪器与试药
1.1仪器Waters 2695高效液相色谱仪(美国Waters公司),Shim-pack VP-ODS色谱柱(日本岛津岛津),INLUCK T74420型C18固相萃取小柱(北京英莱克科技发展有限公司),Microfuge 22R型高速低温离心机(贝克曼科技发展有限公司),UB-7型pH计(北京丹佛仪器有限公司),S-114型电子天平(北京丹佛仪器有限公司),VORTEX-5型漩涡振荡器(海门市其林贝尔仪器制造有限公司),KQ-200 VDB型双频数控超声波清洗器(昆山市超声仪器有限公司),HSC-24A型氮吹仪(天津HENGAO科技发展有限公司),Milli-Q型超纯水系统(上海摩速科学器材有限公司)。
1.2试药秦皮甲素对照品(上海同田生物技术有限公司,批号09040722),秦皮乙素对照品(上海同田生物技术有限公司,批号09040724),替硝唑对照品(中国药品生物制品鉴定所,批号10036-200703),色谱纯甲醇、乙腈(美国Fisher公司),水为超纯水(自制,Milli-Q型超纯水系统)。
1.3实验动物6只SD大鼠,雌雄各半,体质量(200±20)g,新疆医科大学实验动物中心提供,动物合格证号:SCXK(新)2016-0002。
2 方法与结果
2.1混合对照品溶液与内标溶液的配制称取秦皮甲素对照品和秦皮乙素对照品各0.050 g置于25 mL容量瓶,配成秦皮甲素与秦皮乙素浓度为2.0 mg/mL的混合对照品溶液。称取替硝唑对照品适量配制浓度为100 μg/mL的内标溶液。
2.2色谱条件色谱柱为Shim-pack VP-ODS柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.2%甲酸(13∶87),流速为1.0 mL/min,进样量5 μL,柱温为35℃,检测波长为339 nm。在此色谱条件下秦皮甲素与秦皮乙素色谱峰分离度均大于1.5,拖尾因子分别为0.994 2和1.035 4,理论塔板数分别为4 973和6 128,均符合含量测定要求。
2.3大鼠尿液样品的收集SD大鼠6只,实验前禁食12 h,自由饮水,收集大鼠0~48 h的空白尿,分别以秦皮甲素(66.6 mg/kg体质量)和秦皮乙素(77.4 mg/kg体质量)灌胃,收集0~1、1~3、3~6、6~10、10~24、24~36、36~48 h的尿液,-20℃冰箱冷冻储藏,备用。
2.4大鼠尿样的处理固相萃取小柱先依次用甲醇3 mL,水3 mL活化[8],取尿样500 μL,加入内标溶液10 μL,混匀后通过已活化的固相萃取小柱,用1 mL蒸馏水淋洗,继用甲醇1 mL洗脱,收集洗脱液,于40℃水浴上氮气吹干,残渣用100 μL甲醇复溶,涡旋振荡1 min,于10 000 r/min离心5 min,取上清液5 μL,进样。
2.5专属性考察在选定的实验条件下,大鼠空白尿样中无秦皮甲素、秦皮乙素和内标峰出现,证明大鼠尿样中内源性物质不干扰样品及内标的测定,见图1、2。

图1 大鼠空白尿液HPLC色谱图
2.6基质效应取空白尿液,按“2.4”项下方法先处理后再加混合标准溶液10 μL和内标溶液10 μL,配制成0.1、1.0、10.0 μg/mL浓度的3个质控(QA)样品,每个浓度2份,吹干后复溶进样;同时相应浓度的对照品和内标溶液直接进样,记录峰面积,加入尿样基质的秦皮甲素和秦皮乙素的峰面积(A)与未加尿样基质的峰面积(A0)的比值,即为基质效应。结果表明秦皮甲素与秦皮乙素的基质效应(MS)与内标校正的基质效应(MS-IFA)在0.8~1.1,均能满足方法学要求,见表1。
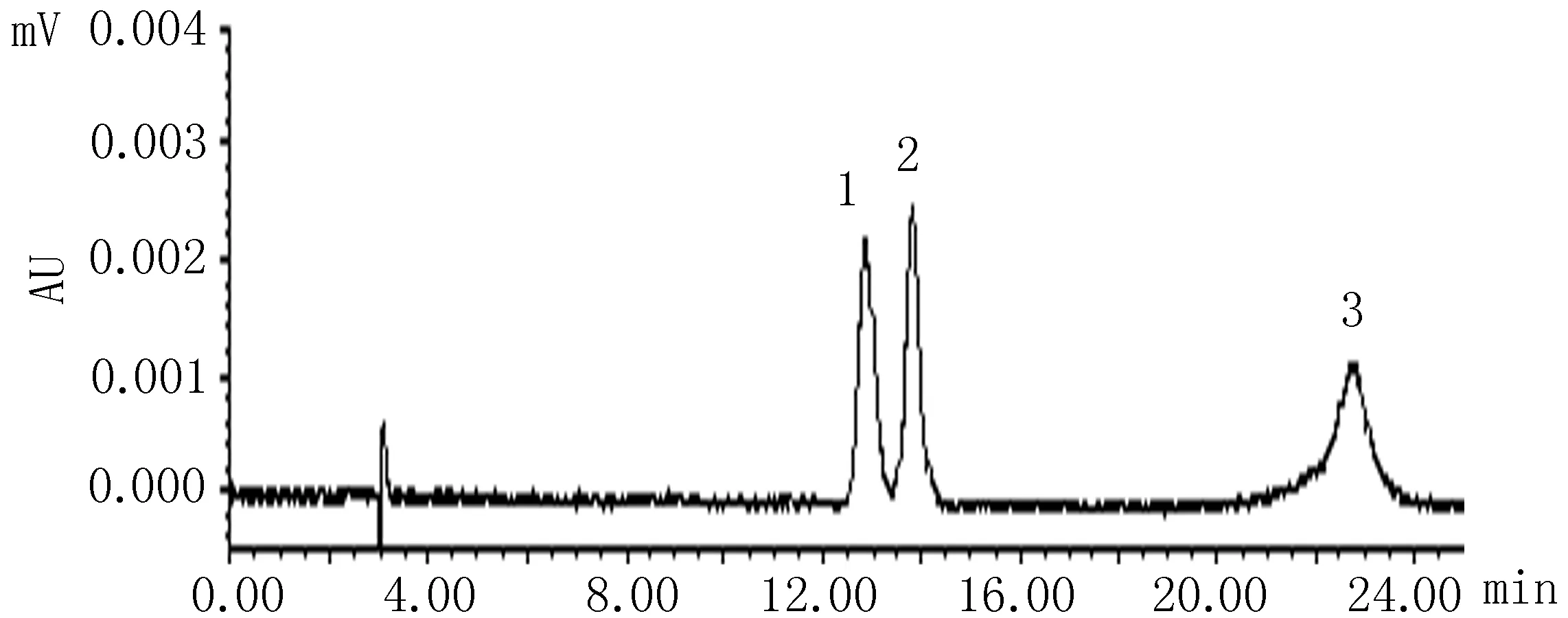
(注:1.秦皮甲素;2.替硝唑;3.秦皮乙素)
2.7线性关系与检出限取混合对照品溶液配制秦皮甲素与秦皮乙素浓度分别为5、25、50、250、500 μg/mL的系列标准溶液。取大鼠空白尿样480 μL共5份,分别加入系列标准溶液10 μL、浓度为50 μg/mL的内标溶液10 μL,混匀,使SD大鼠尿液中秦皮甲素与秦皮乙素的浓度为0.1、0.5、1.0、5.0、10.0 μg/mL。按“2.4”项下方法操作,在前述色谱条件下进行测定。分别用秦皮甲素、秦皮乙素的峰面积与内标峰面积的比值(F1,F2)对秦皮甲素、秦皮乙素浓度(X1,X2)进行直线回归,求得的回归方程分别为:F1=0.121 4X1-0.028 3,r=0.998 5(n=5);F2=0.138 9X2-0.043 1,r=0.999 1(n=5)。结果秦皮甲素和秦皮乙素尿样在0.1~10.0 μg/mL浓度范围内线性关系良好,检测限分别为0.055 7 μg/mL和0.060 0 μg/mL。
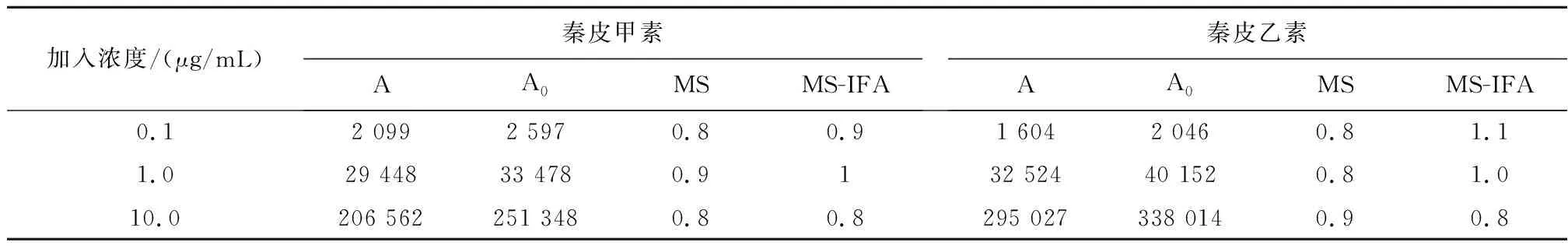
表1 秦皮甲素和秦皮乙素在大鼠尿中的基质效应(n=2)
2.8精密度试验取浓度分别为0.1、1.0、10.0 μg/mL的QA样品各5份,分别按“2.4”项下方法处理尿样,24 h内重复测定5次,连续测定5 d,秦皮甲素的日内、日间精密度RSD≤6.63%,秦皮乙素的日内、日间精密度RSD≤7.61%,表明方法精密度良好,见表2。
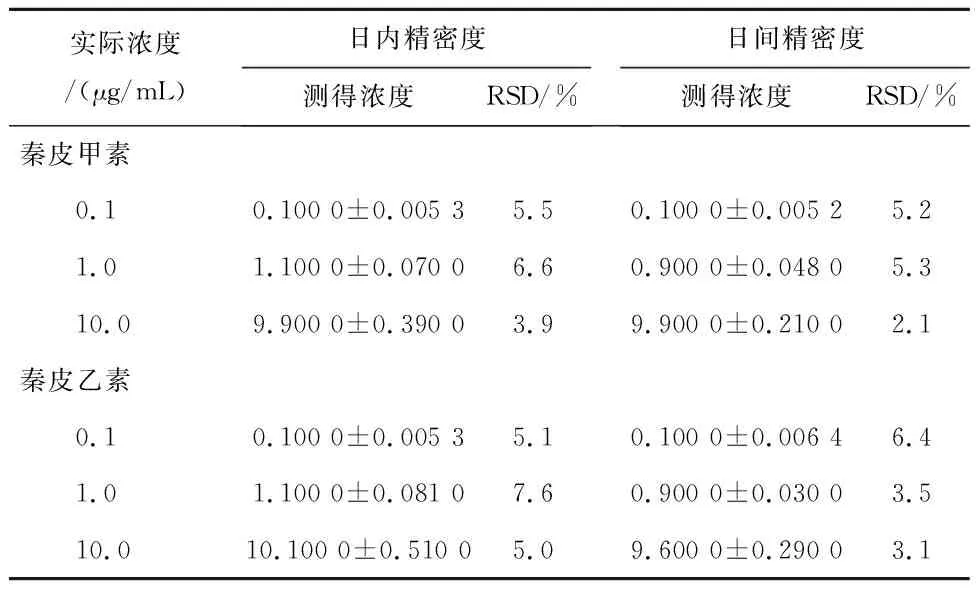
表2 秦皮甲素和秦皮乙素大鼠尿样日内、日间精密度(n=5)
2.9回收率试验取高、中、低浓度的3组QA样品测定浓度,另取3组相同浓度的标准溶液,未经处理直接进样,前后两个浓度的比值为提取回收率。结果表明,高、中、低 3个浓度的提取回收率均大于70%,见表3。
2.10稳定性试验取高、中、低浓度的3组QA样品,于4℃冰箱中放置0、4、12、24 h后取出,置于室温进样测定。将放置4、12、24 h的样品与其处理后立即进样的数据来进行分析比较,观察其浓度变化。结果表明秦皮甲素、秦皮乙素尿液样品24 h内稳定,见表4。

表3 秦皮甲素,秦皮乙素在大鼠血浆中的回收率(n=3)
2.11大鼠尿样中秦皮甲素和秦皮乙素排泄参数秦皮甲素和秦皮乙素灌胃给予大鼠后不同时间段尿中测得的累积排泄量数据,见表5。尿药排泄数据经3P87药代动力学计算程序采用速度法来计算药动学参数,秦皮甲素体内滞留时间为1.280 3 h,ke=0.063 1/h,t1/2=10.983 h;秦皮乙素体内滞留时间为3.396 9 h,ke=0.064 0/h,t1/2=10.828 h。两种药累积排泄百分率分别为0.578%和0.355%,秦皮乙素48 h累积尿药排泄量大于秦皮甲素,见图3。

表4 秦皮甲素和秦皮乙素的稳定性试验结果(n=4)
表5 秦皮甲素和秦皮乙素尿药累积排泄量
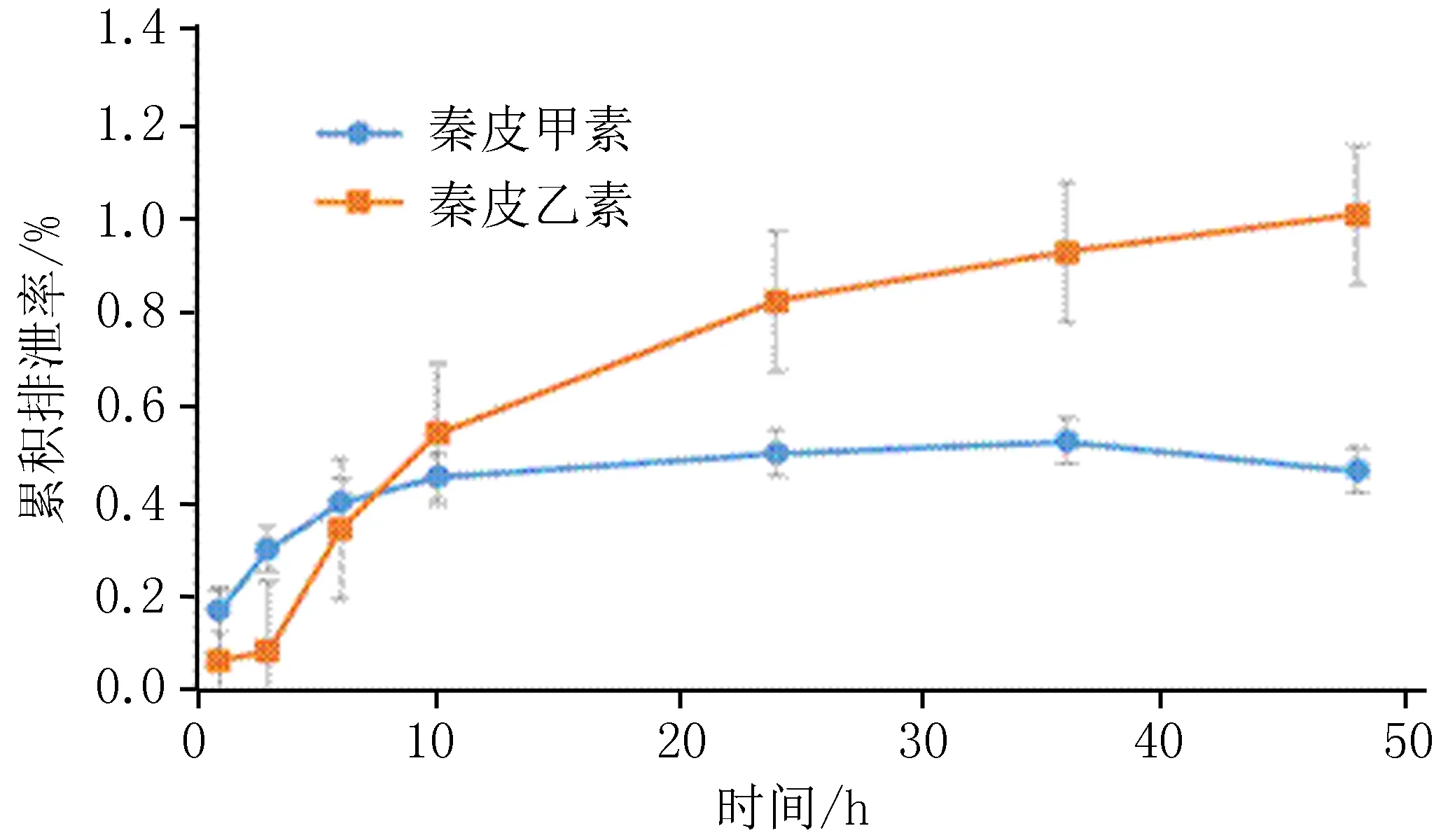
图3 大鼠尿样中秦皮甲素和秦皮乙素的累积排泄率
3 讨论
萃取法是生物体内药物分析测定前样品处理应用最多的分离、纯化方法。萃取法包括液-液萃取法(LLE)和固相萃取法(SPE)。SPE原理是采用适当填料的小柱经合理的洗脱步骤后使得被分析物与杂质干扰分离,该方法最大优点是处理样品干净,若洗脱条件优化恰当,还具有回收率高、重现性好等优点。本实验考察了C18与聚酰胺2种不同填料的固相萃取柱,结果表明C18柱对秦皮甲素、秦皮乙素均有较强的吸附性,处理样品干净,无明显基质效应,萃取回收率高。实验还考察样品最佳上样量,淋洗液的种类和体积,洗脱液的种类和体积,最后确定固相萃取小柱先依次用甲醇3 mL,3 mL水活化,尿液样品500 μL,1 mL蒸馏水淋洗,1 mL甲醇洗脱时,样品过柱、淋洗、洗脱过程中损失的最小,回收率高,没有杂质峰干扰。
口服香豆素在生物体胃肠道中很快被吸收并在体内分布,并正常代谢,少许以原形排泄[9-11]。本研究结果显示:大鼠口服秦皮甲素、秦皮乙素后,秦皮甲素最大的尿排泄量发生在0~1 h时间段内,而秦皮乙素最大尿排泄量发生在3~6 h时间段内,且秦皮甲素体内滞留时间短,累积排泄百分率低;根据尿药排泄参数可知秦皮甲素、秦皮乙素口服后吸收快,迅速达到峰浓度,体内消除快,秦皮甲素、秦皮乙素仅极少部分以原形药物从肾排泄,绝大部分以代谢产物从体内排泄,提示秦皮甲素经胃酸进行苷键水解为秦皮乙素后发生吸收,主要的代谢产物均为秦皮乙素的还原、水解及二相代谢产物。
