辛伐他汀PLGA缓释微球对大鼠椎间盘退变的影响
2018-08-30奚菊群刘忠军王静成冯新民杨建东黄泽楠毕松超
陈 涛,奚菊群,刘忠军,王静成,冯新民,张 亮,*,杨建东*,黄泽楠,毕松超
(1.中南大学湘雅医学院,长沙 410013; 2.扬州大学临床医学院,江苏 扬州 225001;3.扬州大学医学院药学系,江苏 扬州 225001; 4.北京大学第三医院骨科,北京 100191)
腰痛已成为45岁以上人群功能受限的最主要原因,80%的成年人一生中受到不同程度的腰痛影响[1]。在美国,每年用于治疗腰痛的花费高达1000亿美元[2]。尽管腰痛的确切致病因素仍不明确,但研究发现至少40%的腰痛与椎间盘退变密切相关[3]。目前无论保守治疗或手术治疗均只能改善症状,无法实现改善椎间盘退变的本质。近年来,采用细胞生物学手段,通过促进细胞外基质合成或抑制其降解,以期从根本上延缓或逆转椎间盘退变[4]。研究发现骨形态发生蛋白(bone morphogenetic protein,BMP)可以影响椎间盘细胞外基质的合成,上调BMP-2表达可以促进正常髓核细胞甚至是退变髓核细胞的细胞外基质II型胶原及蛋白多糖的表达,从而重建正常椎间盘的功能[5-6]。考虑到在脊柱融合手术中直接使用BMP的多种并发症[7],因此直接将BMP用于椎间盘退变的治疗存在一定风险。
他汀类药物属羟甲基戊二酰辅酶A(HMG -COA)还原酶抑制剂,临床上广泛用于高脂血症的治疗。研究发现,辛伐他汀可通过甲羟戊酸途径上调髓核细胞中骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)得表达,从而促进II型胶原及蛋白多糖等细胞外基质表达[8]。邹立学等[9]进一步研究发现小于0.4 μmol/L的较低浓度范围内辛伐他汀对细胞活力无明显影响。进一步将辛伐他汀植入大鼠退变椎间盘,治疗2周后发现磁共振成像(magnetic resonance imaging, MRI)上椎间盘信号好转,髓核细胞外基质合成增加,II型胶原及BMP-2 的mRNA表达增加[10]。然而辛伐他汀难溶于水,口服生物利用度低等缺点限制了其临床应用。聚合物缓释微球作为一种新型药物载体,由天然或合成的高分子物质聚合而成,具有靶向给药、提高药物稳定性及控制药物释放等优势。聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是一种常用的药物缓释系统,其负载的药物已成功用于多种疾病动物模型的治疗[11]。
因此,本研究通过在大鼠退变椎间盘内注入辛伐他汀-PLGA缓释微球,通过影像学、组织学及分子生物学等评估对于椎间盘退变的影响。
1 材料和方法
1.1 实验动物
清洁级雄性SD大鼠32只,3月龄,体重320~400 g,购自江苏大学实验动物中心[SCXK(苏)2013-0011号],动物饲养及取材于扬州大学农学院动物实验设施内进行[SYXK(苏)2017-0044号],并通过扬州大学实验动物福利伦理委员会的福利伦理审查。
1.2 主要试剂与仪器
辛伐他汀、PLGA(PLA: PGA=50:50,分子量=31000)、HEPES(美国Sigma公司);DMEM培养基(美国Gibco公司);二氯甲烷、聚乙烯醇、100%乙醇(国药集团化学试剂北京有限公司);RT-PCR引物(上海吉凯生物);紫外可见光光度计(U-3900 Hitachi);扫描电镜(S-4800II Hitachi);X线(MX-20,美国Faxitron公司);MRI(7.0T,Bruker Pharmascan公司)。
1.3 实验方法
1.3.1 椎间盘退变动物模型的制备
采用本课题组既往的方法制备[12],1%戊巴比妥纳溶液,以0.4 mL/kg经腹腔注射麻醉。达到麻醉效果后,用数字式钼耗线摄像机拍摄大鼠尾椎正位片,定位Co6/7、Co7/8、Co8/9尾椎椎间隙(Co6/7、Co8/9作为穿刺组,Co7/8作为对照组)。大鼠俯卧位,消毒骶部及鼠尾,用21号注射针头于背侧中心经皮垂直穿刺入椎间隙约5 mm后,注射针头旋转360度,并停留30 s。术后再次消毒,并密切观察至麻醉苏醒,放回笼中自由活动。
1.3.2 辛伐他汀PLGA缓释微球制备
将PLGA与辛伐他汀按质量比10∶3.3共同溶解于二氯甲烷中,形成均匀分散液;加入200 μL水,超声混合;缓慢加入10 mL的5%聚乙烯醇水溶液中,超声粉碎3 min,加入50 mL 0.3%聚乙烯醇水溶液中,搅拌过夜,除净有机溶剂;冷冻干燥48 h,获得辛伐他汀PLGA缓释微球。
1.3.3 微球的包封率及载药量测定
精确称量5 mg 的微球,配成100 mL的乙醇溶液,以乙醇为空白对照,在238 nm处测定吸光度,根据标准曲线计算微球中辛伐他汀含量。根据以下公式计算包封率和载药量:包封率=微球中的辛伐他汀总量/微球总量×100%,载药量=实际载药量/理论载药量×100%。
1.3.4 缓释微球形态观察及微球的体外释放
通过扫描电镜观察微球形状、大小和表面形态。取干燥的辛伐他汀PLGA缓释微球及空白微球粉末各0.005 g,用20 mL磷酸盐缓冲液 (pH=7.4)分散,37℃水浴;分别于不同时间间隔取3 mL上清液,用新鲜磷酸盐缓冲液3 mL补足原液;紫外可见光光度计检测各试样于238 nm处的吸收值,通过标准曲线方程求出各试液中辛伐他汀浓度,计算累积释放量,确定载药微球的辛伐他汀释放曲线。
1.3.5 实验分组及处理
在实验动物造模完成2周后将模型动物尾椎Co6/7节段作为对照组,Co8/9作为实验组,每组16只。对照组注入等量生理盐水,实验组注入辛伐他汀PLGA缓释微球溶液2 μL,注射时采用生理盐水将微球浓度调整到5 mg/mL,为防止PLGA微球溶液的弱酸性特征,故釆用DMEM培养基、HEPES及NaHCO3将溶液pH值调整到中性。使用31G针头的微量注射器,手术方法同模型建立,注射后,在局部停留30 s,保证注射液不会溢出,同时每次注射后都更换新的无菌微量注射器。
1.3.6 X线观察椎间隙高度
在注射前、注射后2周及4周时进行大鼠尾椎X线检查,扫描参数为50 kV,100 mA,50 ms。根据X线计算椎间隙高度指数(disc height index, DHI)用以表示椎间隙高度[7],相对椎间隙高度指数(DHI%)=(穿刺后DHI/穿刺前DHI)×100%。
1.3.7 核磁共振成像(magnetic resonance imaging,MRI)检查
在注射前、注射术后2周及4周时采用进行MRI检查,扫描参数如下:序列重复时间/回波时间为3000/30 ms,层厚0.5 mm,间隔0 mm。根据矢状位T2WI像Pfirrmann进行分级评分[13]。
1.3.8 组织学检查
MRI扫描后采用注射戊巴比妥过量麻醉法处死,切取对照组及实验组椎间盘(包含上下终板),4%多聚甲醛固定3 d,脱钙处理,石蜡包埋后切片,进行苏木素-伊红(HE)染色,并按照Keorochana等[14]方法评分;甲苯胺蓝染色按照Norcross等[15]方法进行评分。
1.3.9 RT-qPCR检测
处死后的大鼠,切取对照组及实验组椎间盘,将髓核剪成1 mm3左右小块并研磨,采用Trizol法提取总RNA,按照qPCR试剂盒操作说明书进行BMP-2、低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)、II型胶原及蛋白多糖mRNA表达检测,同时将甘油醛-3-磷酸脱氢酶(GAPDH)作为内参照。RT-qPCR反应步骤:95℃ 20 s,95℃ 5 s,60℃ 20 s,重复40个循环,每次循环读取Ct(cycle threshold)值,重复3组。所得各组Ct值用2-△△Ct表示计算各靶基因相对表达水平。各引物序列信息见(表1)。

表1 引物序列Table.1 Primer sequences
1.4 统计学方法

2 结果
2.1 辛伐他汀PLGA缓释微球的表征
图1a可见辛伐他汀PLGA缓释微球呈球形、形状规则,分散性好且无聚集现象,表面光滑,分布均匀,平均粒径为(1.52 ± 0.54)μm。微球载药率为(23.3±1.3)%,包封率为(90.4±2.6)%。图1b所示,微球包裹的辛伐他汀在最初24 h内存在药物突释现象,约占药物总量的45%,而在随后144 h内持续缓慢释放辛伐他汀且释放浓度较稳定,累计释放超过81.2%。由此可见,本实验制备的辛伐他汀PLGA缓释微球能够满足缓释要求。
2.2 相对椎间隙指数
图2所示,对照组椎间隙高度进一步降低,与治疗前相对椎间隙指数比较,2周及4周时差异均有显著性(P< 0.05)。实验组治疗后椎间隙高度降低不明显,与治疗前相对椎间隙指数比较,差异无显著性(P> 0.05);但4周时与对照组比较,差异有显著性(P< 0.05)。
2.3 MRI评分
图3所示,对照组椎间盘退变程度进一步加重,与治疗前MRI评分比较,2周及4周时差异均有显著性(P< 0.05)。实验组治疗后椎间盘退变程度有所减轻,与治疗前MRI评分比较,4周时差异有显著性(P< 0.05);与对照组同时间点比较,差异均有显著性(P< 0.05)。
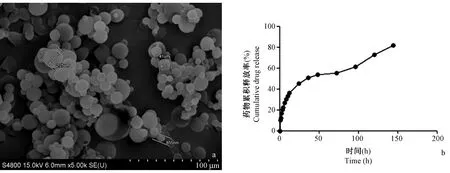
注:(a)辛伐他汀PLGA缓释微球的扫描电镜图片;(b)微球药物释放曲线。图1 辛伐他汀PLGA缓释微球形态及药物释放曲线Note.(a)SEM image of simvastatin-loaded PLGA microspheres.(b)Cumulative drug release rate of microspheres.Figure.1 SEM image of simvastatin-loaded PLGA microspheres and cumulative drug release rate

注:与同组注射前比较,*P< 0.05;与对照组比较,#P< 0.05。图2 对照组及实验组椎间隙高度及相对椎间隙高度指数Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.2 The disc height and DHI% of the control group and experimental group
2.4 苏木素-伊红染色结果
图4所示,对照组HE染色评分逐渐增加,4周时与治疗前比较差异有显著性(P< 0.05)。实验组治疗后HE染色评分逐渐降低,与治疗前及对照组相同时间点比较,差异均有显著性(P< 0.05)。
2.5 甲苯胺蓝染色结果
图5所示,对照组甲苯胺蓝染色评分逐渐降低,4周时与治疗前比较差异有显著性(P< 0.05)。实验组治疗后甲苯胺蓝染色评分逐渐增加,4周时与治疗前比较差异有显著性(P< 0.05);与对照组同时间点比较,差异均有显著性(P< 0.05)。
2.6 RT-qPCR检测结果
与对照组比较,实验组中BMP-2、HIF-1α、II型胶原及蛋白多糖表达明显增加,差异有显著性(P< 0.05),但2周与4周时比较,差异无显著性(P> 0.05)。(图6)

注:与同组注射前比较,*P< 0.05;与对照组比较,#P< 0.05。图3 对照组及实验组MRI影像及评分Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.3 MRI images and scores of the control group and experimental group

注:与同组注射前比较,*P< 0.05;与对照组比较,#P< 0.05。图4 对照组及实验组HE染色图像及HE染色评分Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.4 The HE staining images and scores of the control group and experimental group
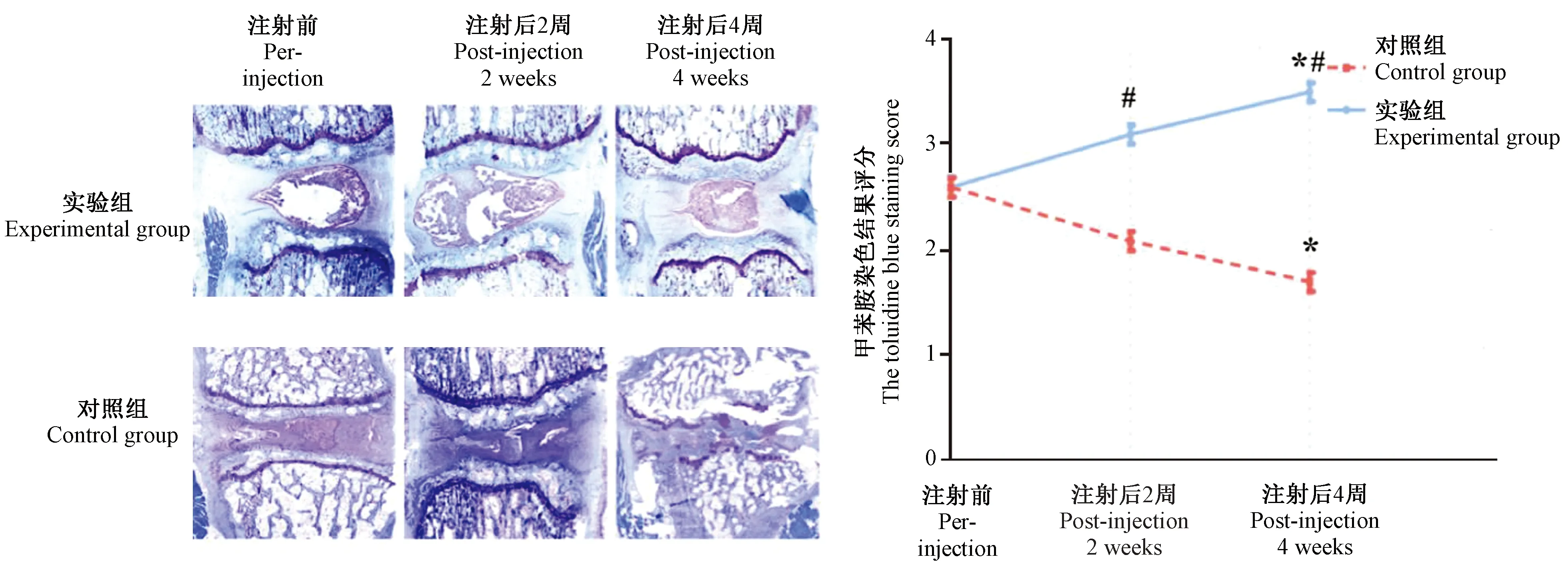
注:与同组注射前比较,*P< 0.05;与对照组比较,#P< 0.05。图5 对照组及实验组甲苯胺蓝染色图像及甲苯胺蓝染色评分Note.Compared with the pre-injection,*P< 0.05.Compared with the control group,#P< 0.05.Figure.5 The toluidine blue staining images and scores of the control group and experimental group

注:与同时间点对照组比较,*P< 0.05。图6 对照组及实验组的BMP-2、HIF-1α、Collagen II 和Aggrecan基因mRNA相对表达量比较Note.Compared with the control group,*P< 0.05.Figure.6 BMP-2, HIF-1α, collagen II, and aggrecan mRNA expression of the control group and experimental group
3 讨论
研究表明,辛伐他汀可促进Π型胶原及聚集蛋白聚糖等椎间盘细胞细胞外基质的mRNA表达[8-9]。本课题组前期研究发现合适浓度的辛伐他汀可以促进椎间盘髓核内源性干细胞增殖及细胞外基质分泌,同时有助于诱导髓核干细胞向髓核细胞分化[16-17]。因此本研究通过建立椎间盘退变动物模型,研究椎间盘内局部注射PLGA辛伐他汀缓释微球的治疗效果,以期延缓甚至逆转椎间盘退变进程。结果发现在椎间盘退变2周后注射PLGA辛伐他汀缓释微球,MRI上椎间盘退变评分明显改善,并且在注射后4 周时达到最佳;组织学评分在治疗后逐渐好转,且细胞外基质成分II型胶原及蛋白多糖mRNA表达逐渐增加,与文献报道类似[10]。说明辛伐他汀PLGA缓释微球可以有效改善椎间盘退变进程。
高分子材料PLGA因具有良好的生物降解性、相容性、无刺激性、无免疫原性及无毒等特点,已被广泛用于药物缓释和被动靶向给药系统,且已用于临床[11]。因此本研究选择PLGA作为缓释材料负载辛伐他汀,以提高辛伐他汀使用效率。从PLGA辛伐他汀缓释微球的体外释放曲线可看出,缓释微球包裹的辛伐他汀可以达到较稳定的缓释效果,保证椎间盘内稳定的药物浓度,为退变椎间盘提供可靠的再生环境。
对于辛伐他汀促进椎间盘退变修复的机制,目前研究认为辛伐他汀主要通过上调髓核细胞中BMP-2表达,从而促进髓核细胞外基质的表达[5,9-10]。而Hu等[18]研究发现他汀类药物可使单层培养的已去分化的髓核细胞表型发生逆转,从而促进II型胶原等细胞外基质表达。本课题组前期研究还发现适当浓度的辛伐他汀可在体外促进内源性髓核干细胞增殖和细胞外基质Ⅱ型胶原及蛋白多糖的分泌,其机制可能与HIF-1α信号通路有关[16, 19]。Liu等[20]研究发现HIF-1α可以通过NOTCH1信号途径调节椎间盘髓核细胞中蛋白多糖及II型胶原表达,从而影响椎间盘退变进程。於绍龙等[21]研究还发现,HIF-1α基因可以增强转染BMP-2基因的骨髓间充质干细胞的成骨分化能力,说明一定程度上HIF-1α可以促进BMP-2在目标细胞中发挥应有作用。结合本研究结果,注射辛伐他汀PLGA缓释微球后椎间盘中HIF-1α及BMP-2表达均明显增加,表明辛伐他汀可能通过HIF-1α及BMP-2途径来促进髓核细胞外基质表达,以及促进髓核组织中残留的髓核干细胞增殖等途径,来实现修复重建退变椎间盘的目的,但具体作用机制及信号通路仍需进一步研究明确。
本研究仍存在一些不足,尽管细针穿刺纤维环制作的椎间盘退变动物模型在组织学与人类椎间盘退变进程相似,但两者生理病理过程是否完全相同仍不可知,且因种属不同,因此应用于临床时应慎重。另外,本研究未比较不同浓度梯度的辛伐他汀PLGA缓释微球的疗效,无法得到最佳药物浓度。
综上所述,本实验发现在局部注射辛伐他汀PLGA缓释微球可以改善SD大鼠椎间盘退变程度,其机制可能与HIF-1α及BMP-2信号通路有关,这为辛伐他汀用于治疗椎间盘退变性疾病提供了一定的理论依据。
