小儿热速清糖浆抗流感病毒和抗菌作用研究
2018-08-30陈荣昌季宇彬葛一蒙孙桂波孙晓波
王 敏,陈荣昌,季宇彬,韩 冰,葛一蒙,王 姗,孙桂波*,孙晓波*
(1.中国医学科学院药用植物研究所药理毒理中心,北京 100193; 2.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076; 3.黑龙江珍宝岛药业股份有限公司,黑龙江 鸡西 158400)
急性呼吸道感染是世界范围内儿童感染发病和死亡的重要原因之一[1-2],造成急性呼吸道感染的病原体90% 约为病毒,细菌感染为病毒感染后继发感染或直接感染约占10%。病毒感染主要包括流感病毒,呼吸道合胞病毒(respiratory syncytial virus,RSV)和腺病毒等[3-4]。细菌感染主要包括流感嗜血杆菌、肺炎球菌、葡萄球菌和大肠埃希菌等[5]。RSV和流感病毒被证明是导致急性上呼吸道感染的主要原因,RSV被报道为儿童下呼吸道感染的主要病原体,也是与细菌性病原体相结合最常见的病原体[6-9]。小儿热速清糖浆具有清热解毒,泻火利咽等功效[10-11]。临床研究表明小儿热速清糖浆对于儿童上呼吸道感染具有确切疗效[12]。但对急性下呼吸道感染及病菌感染是否有疗效尚未有临床及实验证明。本文据此对小儿热速清糖浆的抗病毒及抗菌作用进行实验研究,为其治疗下呼吸道感染提供实验支持,并为临床治疗急性呼吸道感染提供进一步的实验依据。
1 材料和方法
1.1 实验动物
SPF级ICR小鼠442只,3周龄,体重9~11 g,抗病毒实验小鼠134只,抗菌实验小鼠308只,雌雄各半,实验动物由吉林大学基础医学院实验动物中心提供[SCXK(吉)2013-0001],在吉林大学基础医学院病原生物教研室进行实验[SYXK(吉)2013-0005],福利伦理审查证号2015-11-10。
1.2 细胞、病毒及菌株
宫颈癌细胞(Helen Lane,Hela) 用于呼吸道合胞病毒的培养,犬肾细胞(MDCKcanine kidney cell,MDCK) 用于流感病毒培养,本实验室保存。甲型流感病毒FM1 购于武汉病毒研究所。呼吸道合胞病毒ATCC标准株(RSV,Long株) 由广州呼吸病研究所馈赠。临床分离株:大肠埃希菌,金黄色葡萄球菌,铜绿假单胞菌,表皮葡萄球菌,乙型溶血性链球菌,肺炎克雷伯菌;耐青霉素和青霉素敏感金黄色葡萄球菌,均为本实验室保存。
1.3 主要试剂与仪器
小儿热速清糖浆(批号:z19980095),黑龙江珍宝岛药业股份有限公司;感冒止咳糖浆 (批号:20150101),贵州拜特制药有限公司;达菲(批号:SH0047),瑞士巴塞尔豪夫迈·罗氏有限公司;青霉素V钾片(批号:815004),重庆科瑞制药有限公司。
DMEM培养基(批号:8116489,美国Gibco);胎牛血清(批号:1619279,美国Gibco);胰蛋白酶(批号:20170912,北京索莱宝);乙醚(批号:20160118,北京化工厂);生理盐水(批号:E17042911,山东华鲁制药)。
CKX41型倒置相差显微镜(日本OLYMPUS);MQX 200型微孔板扫描酶标仪(美国BioTek instrument);Heraeus BB15型二氧化碳细胞培养箱(美国Thermo Scientific)。
1.4 实验方法
1.4.1 培养基
(1)营养琼脂培养基:培养大肠埃希菌,金黄色葡萄球菌、肺炎克雷伯菌、表皮葡萄球菌。
(2)4%琼脂培养基:普通肉汤培养基加入4%琼脂粉。培养铜绿假单胞菌。
(3)血琼脂培养基:营养琼脂培养基加热溶化,约55℃时注入羊全血,混均。培养乙型溶血性链球菌。
(4)MH肉汤、MH琼脂培养基:药物最小抑菌浓度(minimum inhibitory concentration,MIC)的测定。
1.4.2 药物对病毒致细胞病变作用的影响
FM1和RSV稀释为10-1,10-2,10-3…10-9不同稀释度,分别感染MDCK和Hela细胞,并设细胞对照,计算50% 细胞感染量(tissue culture infective dose,TCID50)。小儿热速清糖浆、感冒止咳糖浆浓度设为1,达菲为1000 g/L用无血清培养基对药物原液进行2倍递比稀释9个浓度,设8个复孔,分别加于Hela和MDCK单层细胞上,并设细胞对照,96孔板培养72 h,每孔加噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,thiazolyl blue tetrazolium bromide,MTT)100 μL,孵育4 h每孔加二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL震荡2 min酶标仪570 nm检测,计算最大无毒浓度(maximum non-toxic concentration,TC0),50%细胞中毒浓度(median toxic concentration,TC50)。FM1和RSV以100TCID50[13-14]的量攻击细胞,37℃,5% CO2细胞培养箱吸附2 h,弃病毒液,加入各药物最大无毒浓度和待测药物最大无毒浓度2倍递比稀释两个浓度每孔200 μL,设8个复孔。同时设阳性对照药物、细胞对照、病毒对照和空白对照组。培养5 d,观察细胞病变作用(cytopathic effect,CPE)并记录,计算药物对FM1和RSV病毒的半数抑制浓度(the half maximal inhibitory concentration,IC50),并计算治疗指数(therapeutic index,TI=TC50/IC50)。
1.4.3 药物对FM1流感病毒致小鼠肺炎的治疗作用
小鼠50只,随机平均分成5组,乙醚轻度麻醉滴鼻感染10-1,10-2~10-5不同稀释度的流感病毒液0.1 mL,观察14 d,计算病毒的半数致死量(median lethal dose,LD50)。小鼠84只随机分为7组,每组12只,包括正常组、病毒模型组、达菲组0.0364 g/kg、感冒止咳糖浆组10 mL/kg和小儿热速清糖浆高(40 mL/kg)、中(20 mL/kg)、低(10 mL/kg)剂量组。感染前1 d给药,乙醚浅麻醉下滴鼻感染FM1 5LD50[15-17]一次,连续给药7 d,病毒模型和正常对照组灌服等体积的生理盐水。感染后第6天解剖,取肺称重,计算肺指数和肺指数抑制率,取各组鼠肺分别修块,经梯度酒精脱水,石蜡包埋,切片(厚度5 μmol/L),苏木精-伊红染色(hematoxylin-eosin staining,HE),光镜下检查。
肺指数=肺重/体重×100%
肺指数抑制率=(感染模型组平均肺指数-实验组平均肺指数)/感染模型组平均肺指数×100%
1.4.4 药物体外抑菌率测定
小儿热速清糖浆和感冒止咳糖浆原液浓度设定为1,青霉素V钾片MH肉汤稀释,终浓度为64 mg/mL,MH肉汤将三种药物进行二倍递比稀释5个浓度,测定乙型溶血性链球菌MIC培养基中需加10%血清。将细菌接种于各自适用的琼脂平板上,37℃培养24 h后,刮取菌苔,无菌生理盐水稀释,根据麦氏比浊管测细菌浓度,配成1.5×108/mL的菌液。各取0.1 mL接种于各药物培养基中,小儿热速清糖浆和感冒止咳糖浆终浓度依次为:1、0.5、0.25、0.125、0.0625、0.0312,青霉素V钾片终浓度依次为64、32、16、8、4、2 mg/mL;同时设细菌和培养基对照,37℃培养24 h,观察并记录,无细菌生长试管中所含的最小药物浓度即为最小抑菌浓度(MIC)。
1.4.5 小儿热速清糖浆体内抑菌实验
耐青霉素和青霉素敏感金黄色葡萄球菌分别接种到血琼脂平板上,37℃,18 h。根据麦氏比浊管的浓度,生理盐水稀释两株细菌成7个浓度,分别为0.3×109CFU/mL、0.6×109CFU/mL、0.9×109CFU/mL、1.2×109CFU/mL、1.5×109CFU/mL、1.8×109CFU/mL、2.1×109CFU/mL。小鼠140只,随机分为14组,每组10只,每只腹腔注射菌液0.2 mL,连续观察7 d,能使小鼠全部死亡的最低细菌浓度即为最小致死量(minimum lethal dose,MLD)。小鼠168只按体重随机分成14组,每组12只,抗青霉素敏感和耐青霉素金黄色葡萄球菌感染实验各7组,灌胃给药,分为小儿热速清糖浆高(40 mL/kg)、中(20 mL/kg)、低(10 mL/kg)组;感冒止咳糖浆组10 mL/kg;青霉素V钾片组33 mg/kg;正常对照和模型组(均给予生理盐水灌胃)。提前3 d给药,第4天,除正常组,其余各组腹腔注射最小致死量菌液每只0.2 mL,继续给药3 d,每天1次。记录动物死亡数。
1.5 统计学方法

2 结果
2.1 小儿热速清糖浆对病毒致细胞病变保护作用
FM1和RSV对MDCK和Hela细胞的TCID50分别为10-5.8和10-4。小儿热速清糖浆对MDCK细胞TC0为0.0312,TC50为0.9750。对Hela细胞TC0为0.0156,TC50为0.1280,达菲对MDCK和Hela细胞的TC0均为0.1250 g/L,感冒止咳糖浆对MDCK和Hela细胞的TC0均为0.0156。分别感染100TCID50FM1和RSV小儿热速清糖浆浓度为0.0312对两种病毒抑制明显,浓度为0.0156仅能抑制RSV,浓度为0.0078对两种病毒均无抑制作用。感冒止咳糖浆0.0156对两种病毒抑制明显,达菲0.1250 g/L仅能抑制FM1。小儿热速清糖浆对FM1和RSV的IC50分别为0.0128和0.0068。治疗指数分别为TI=76.2和TI=18.8,表明小儿热速清糖浆能有效抑制FM1和RSV致细胞病变作用。
2.2 小儿热速清糖浆对FM1流感病毒致小鼠肺炎的影响
FM1对小鼠的半数致死量LD50为10-3.32。小儿热速清糖浆剂量20 mL/kg和40 mL/kg能明显降低FM1所致肺炎小鼠肺指数(P< 0.05),见表1。正常组小鼠肺、肺泡结构完整,支气管上皮完整,腔内无渗出物,壁上有散在的红细胞。模型组肺为间质性肺炎,肺泡壁增厚,部分肺泡融合,腔内充有炎性细胞和浆液性渗出物,肺泡间隔血管充血,支气管上皮细胞脱落到腔内,管壁增厚,周围大量的炎性细胞浸润;与模型组相比,小儿热速清糖浆10 mL/kg对肺的改善较为明显,见图1。
2.3 各组药物对6种细菌MIC50、MIC90及累积抑菌率
小儿热速清糖浆和感冒止咳糖浆体外对6种细菌均有很好的抑制效果,青霉素V钾片在体外对铜绿假单胞菌无抑制作用,对其它细菌均有抑制作用,见表2。
小儿热速清糖浆累积抑菌率为乙型溶血性链球菌>表皮葡萄球菌>金黄色葡萄球菌>肺炎克雷伯菌>大肠埃希菌>铜绿假单胞菌;感冒止咳糖浆的累积抑菌率为肺炎克雷伯菌>金黄色葡萄球菌>铜绿假单胞菌>大肠埃希菌>表皮葡萄球菌>乙型溶血性链球菌;青霉素V钾片累积抑菌率为表皮葡萄球菌>乙型溶血性链球菌>金黄色葡萄球菌>肺炎克雷伯菌>大肠埃希菌>铜绿假单胞菌,见表3和4。

表1 小儿热速清糖浆对小鼠流感病毒性肺炎的作用Table.1 Effect of Xiaoer Resuqing syrup on influenza virus-related pneumonia in mice
注: 与病毒对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the virus control group,*P< 0.05,**P< 0.01.
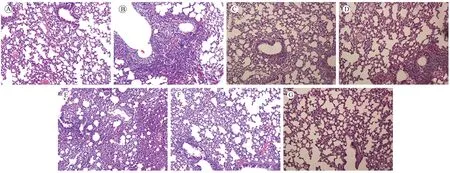
注:(A)正常组;(B)病毒模型组;(C)达菲组0.0364 g/kg;(D)感冒止咳糖浆组10 mL/kg;(E)小儿热塑清糖浆40 mL/kg;(F)小儿热塑清糖浆20 mL/kg;(G)小儿热塑清糖浆10 mL/kg。图1 对小鼠肺的病理形态影响(HE×200)Note.(A)Normal group.(B)Model group.(C)Duffy group 0.0364 g/kg.(D)Cold cough syrup group 10 mL/kg.(E)Xiaoer Resuqing Syrup 40 mL/kg.(F)Xiaoer Resuqing Syrup 20 mL/kg.(G)Xiaoer Resuqing Syrup 10 mL/kg.Figure.1 Effect of pathological morphology of mice lungs

菌株Strain药物MedicineMIC 范围MIC rangeMIC50MIC50MIC90MIC90金黄色葡糖球菌Staphylococcus aureusABC0.25~1.000.25~1.004~32 mg/mL0.500.258 mg/mL0.500.5016 mg/mL大肠埃希菌 Escherichia coliABC0.25~0.500.25~0.504~32 mg/mL0.500.5016 mg/mL0.500.5016 mg/mL铜绿假单胞菌Pseudomonas aeruginosaABC0.25~10.25~1Not suppress0.500.50Not suppress0.500.50Not suppress肺炎克雷伯菌Klebsiella pneumoniaeABC0.25~0.50.25~0.54~64 mg/mL0.500.2532 mg/mL0.500.5064 mg/mL表皮葡萄球菌Staphylococcus epidermidisABC0.25~0.500.25~0.504~16 mg/mL0.500.508 mg/mL0.500.5016 mg/mL乙型溶血性链球菌Beta hemolytic streptococcusABC0.25~0.500.25~1.004~32 mg/mL0.250.5016 mg/mL0.500.5032 mg/mL
注:(A)小儿热速清糖浆;(B)感冒止咳糖;(C)青霉素V钾片。
Note.(A)Xiaoer Resuqing Syrup.(B)Cold cough syrup.(C)Penicillin V potassium.

表3 小儿热速清糖浆和感冒止咳糖浆对6种细菌的累积抑菌率 (%)Table.3 Accumulative inhibitory rates of Xiaoer Resuqing syrup and cold cough syrup on six different bacteria
注:(A)小儿热速清糖浆;(B)感冒止咳糖浆。
Note.(A)Xiaoer Resuqing Syrup.(B)Cold cough syrup.

表4 青霉素V钾片对6种细菌的累积抑菌率(%)Table.4 Accumulative inhibitory rates of penicillin V potassium on six different bacteria
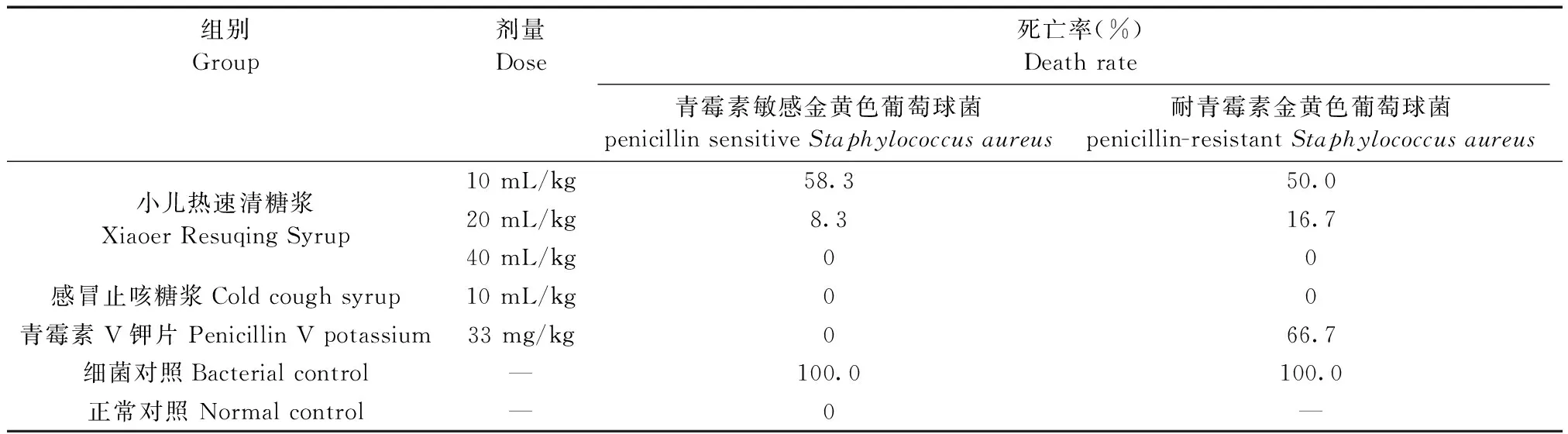
表5 小儿热速清糖浆对青霉素敏感和耐青霉素金黄色葡萄球菌感染小鼠的保护作用 (n=12)Table.5 The protective effects of Xiaoer Resuqing syrup in mice infected with penicillin-sensitive and penicillin-resistant Staphylococcus aureus
2.4 小儿热速清糖浆对金黄色葡萄球菌感染小鼠的保护作用
实验结果表明青霉素敏感和耐青霉素金黄色葡萄球菌对小鼠的MLD分别为1.2×109CFU/mL和1.5×109CFU/mL。小儿热速清糖浆40 mL/kg对青霉素敏感和耐青霉素金黄色葡萄球菌感染的小鼠保护作用明显,ED50分别为0.0989 mL和0.1064 mL,结果见表5。
3 讨论
小儿热速清糖浆是由柴胡、板蓝根、金银花、黄芩、水牛角、连翘、葛根、大黄组成的中药糖浆制剂。目前,针对RSV病毒药物主要有RSV免疫球蛋白和病毒唑,但病毒唑毒性较大,存在安全问题,而且呼吸道感染的治疗存在抗生素滥用情况,既延误病情又浪费财力,对症用药非常重要[18-19]。中药在治疗病毒感染方面有其优势和特点,与西药相比副作用较低。此外,在病毒感染期间我们并不能排除细菌感染的可能。本实验待测药物小儿热速清糖浆选择呼吸道感染的主要病毒流感病毒和RSV进行相关的抗病毒实验[9],并选择标准菌进行抗菌试验,验证其是否同时具有抗病毒和抗菌效果。
本实验选择小儿热速清糖浆的最大无毒浓度为最大给药剂量,在排除药物本身毒性的条件下,连续稀释2倍给药,体外实验结果表明小儿热速清糖浆体外对FM1流感病毒、呼吸道合胞病毒致细胞病变均有抑制作用,表明有保护细胞的抗病毒作用。流感病毒是造成急性呼吸道感染的主要病原体,主要在呼吸道和肺中复制,容易引起肺炎等并发症[20-22]。体内抗病毒试验结果显示,小儿热速清糖浆20 mL/kg和40 mL/kg均可有效的抑制流行性感冒病毒所致的病毒性肺炎,与病毒对照组比较差异显著。小儿热速清糖浆在体外对金黄色葡萄球菌、表皮葡萄球菌、乙型溶血性链球菌、大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌均有抑制作用,抑菌效果与感冒止咳糖浆相近,而对铜绿假单胞菌的抑菌效果明显好于青霉素V钾片,青霉素V钾片在体外对铜绿假单胞菌无抑制作用。金黄色葡糖球菌是引起化脓性感染的主要病菌,并且容易产生耐药性,其耐药性发病率逐年增高,死亡率也逐年递增,已经成为世界范围内临床治疗的难题,亟待解决[23-24]。而小儿热速清糖浆对青霉素敏感的金黄色葡萄球菌和青霉素耐药的金黄色葡萄球菌感染小鼠均有很好的抑制作用。此研究首次通过实验证明小儿热速清糖浆具有抗病毒以及抗菌作用,为临床小儿热速清糖浆治疗婴幼儿上呼吸道感染提供了理论依据,并对临床用药提供指导作用。也为急性呼吸道感染的治疗目前存在的抗生素滥用、疗效差、价格昂贵等问题提供了新的治疗手段。
综上所述,小儿热速清糖浆具有一定的抗病毒和抗菌的效果,且其抗菌效果优于抗病毒,可以考虑应于抗生素耐药型病菌的治疗。但其抗病毒抗菌作用机制及对其他的感染性疾病是否有效果尚不清楚,仍需进一步的研究及相关临床试验。
