聚吡咯/聚乳酸生物材料联合骨髓基质细胞移植治疗脊髓损伤的基础研究
2018-08-30Raynald周俊峰孙晓丹安沂华2
Raynald,舒 兵,黄 华,周俊峰,孙晓丹,秦 川,安沂华2,*
(1.中国医学科学院医学实验动物研究所,北京 100021; 2.中国人民武装警察部队总医院,北京 100039; 3.首都医科大学北京三博脑科医院,北京 100093; 4.清华大学材料学科与工程系,北京 100084; 5.首都医科大学北京市神经外科研究所,北京 100050)
脊髓损伤(spinal cord injury,SCI)可能会导致损伤节段以下机体感觉和运动功能丧失,目前尚没有有效的治疗措施。脊髓损伤的治疗方法包括手术、药物和康复等,可以对神经功能的缺失有一定的改善作用,然而这些治疗手段并不能从根本上解决脊髓损伤的问题,近年来神经再生研究发展迅速,为SCI带来了新的希望。随着组织工程学技术的发展,采用复合生物材料移植治疗SCI也得到了很多关注。聚吡咯(polypyrrole,PPy)作为导电生物材料由于其具有较好组织相容性被用于制作生物支架。而骨髓基质细胞(bone marrow stromal cells,BMSCs)在修复中枢神经系统中有着重要的作用[1],最近的研究发现电刺激可以促进细胞增殖分化从而促进组织再生[2-3]。本研究尝试利用骨髓基质细胞作为种子细胞,聚吡咯/聚乳酸(Polypyrrole/Poly Lactic Acid,PPy/PLA)材料作为支架,研究干细胞联合导电材料支架在SCI中的修复作用。
1 材料和方法
1.1 实验动物
SPF级SD大鼠27只,雌性,体重200~220 g,10周龄。购于北京维通利华实验动物技术有限公司[SCXK(京)2012-0001]。实验在北京市神经外科研究所动物实验设施内进行[SYXK(京)2013-0009]。
1.2 主要试剂及仪器
10%胎牛血清、0.25%胰蛋白酶(含EDTA)、DMEM/F12、TritonX-100(Invitrogen);N,N-二甲基甲酰胺(DMF,北京化工厂);聚吡咯纳米颗粒粉末(国药集团);二氯甲烷(DCM,北京化工厂);聚乳酸(山东省医疗器械研究所);NF抗体(Abcam);PBS缓冲液(GIBCO);NeuN抗体(Abcam);荧光标记二抗TRITC(Jackson ImmunoResearch);RT试剂盒(Invitrogen);RNA提取试剂盒(Promega);荧光定量PCR仪(Applied Biosystem 7500 Fast);微量紫外分光光度计(NanoDrop 2000 C);手术显微镜(上海精密仪器厂,SXP-1C);倒置相差荧光显微镜(ZEISS,Axio Observer A1);超声波细胞破碎仪超声(宁波新芝生物科技股份有限公司)。
1.3 实验方法
1.3.1 细胞培养
选取200 g成年大鼠,摘除双侧股骨。经过抗凝处理的大鼠骨髓5 mL,将用密度梯度离心法分离骨髓基质细胞,室温1500 r/min,离心10 min,弃上清,沉淀物用PBS洗涤再离心2次后,将细胞重悬(密度为4×107/mL)于DMEM+10%胎牛血清的完全培养基中,置培养箱培养(37℃、5% CO2);每3~4 d进行换液;细胞生长至80%融合,用0.25%胰蛋白酶(含EDTA)消化,继续传代培养。
1.3.2 聚吡咯/聚乳酸材料的制备
将聚吡咯纳米颗粒粉末分散于N,N-二甲基甲酰胺中得到质量体积浓度为5.6%的聚吡咯悬浮液。使用超声波细胞破碎仪超声至聚吡咯颗粒均匀分散,然后搅拌过夜。聚乳酸以质量体积浓度为 18.75%的浓度溶于二氯甲烷。将聚吡咯悬浮液滴加到聚乳酸溶液中,直至 DMF∶DCM=1∶2。继续搅拌24 h得到混合均匀的聚吡咯/聚乳酸静电纺丝前驱液。向聚乳酸溶液中加入DMF溶液直至 DMF∶DCM=1∶2,则可以得到聚乳酸静电纺丝前驱液。
1.3.3 动物分组
SD大鼠27只,随机分为3组,每组9只,分别为单纯损伤组(对照组)、PPy/PLA移植组、PPy/PLA/BMSCs移植组。
1.3.4 制作脊髓全横断模型
大鼠腹腔注射水合氯醛(0.4 mL/100 g)麻醉后,常规无菌操作,暴露T 7~9节段脊髓,在T8水平脊髓头尾端完全横断脊髓,用虹膜剪刀去除长度约2.5 mm脊髓组织,确保损伤脊髓头尾端完全离断。将PPy/PLA复合导电材料和培养的BMSCs移植到脊髓损伤区域后,进行逐层缝合;对于单纯PPy/PLA组大鼠不移植BMSCs;对单纯损伤组大鼠不移植PPy/PLA复合导电材料和BMSCs,其后依次逐层缝合。
1.3.5 免疫荧光染色
脊髓全横断6周后,采用心脏灌注固定(固定液:4%中性多聚甲醛),以损伤中心为中点,取出长度约2 cm的脊髓组织,4%中性多聚甲醛固定2 h,其后冰冻切片(片厚15 μm),进行免疫荧光染色。所使用的一抗分别为:NF(1∶200)、NeuN(1∶200)。具体的染色方法:0.01 mol/L PBS浸泡20 min;TritonX-100室温30 min,0.01 mol/L PBS 洗3次,每次5 min;滴加正常羊血清封闭液封闭非特异性反应,37℃ 30 min后弃去封闭液,直接加一抗(NF、NeuN)40℃过夜;取加一抗的脊髓标本,放置室温10 min;PBS洗3次后免疫荧光染色加1∶100 TRITC荧光标记二抗,室温避光5 h,PBS洗3次,每次5 min,用荧光封片剂封片,荧光显微镜下观察。
1.3.6 损伤部位形态学评价
大鼠存活6周后处死,分别采用共聚焦显微镜和电镜,观察3组大鼠,明确脊髓损伤局部新生轴突是否存在,记录形态是否存在差别。

注:A:对照组(全横断);B:PPy/PLA纳米纤维支架组;C:PPy/PLA纳米纤维支联合BMSCs组。图1 各组损伤后6周NF免疫荧光染色阳性表达Note. A: Control group(Complete transection).B: PPy/PLA nanofibrous scaffold group.C: PPy/PLA nanofibrous scaffold combined with BMSCs group.Figure.1 NF immunofluorescence staining 6 weeks after operation in each group
1.3.7 实时荧光定量PCR(RT-PCR)
检测脊髓中的血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、Caspase3,Casp3转录情况,抽提各组细胞总RNA,微量紫外分光光度计测定RNA,确定A260与A280比值在1.8~2.0。qPCR逆转录法合成cDNA,应用RT试剂盒根据primerbank进行引物合成,设计VEGFA、Casp3及内参基因GAPDH引物。VEGFA上游引物:5’-CCAGGCTGCACCCACGACAG-3’,下游引物:5’- TCATTGCAGCAGCCCGCAC-3’,扩增长度192 bp;Casp3上游引物:5’-ACTGGAAAGCCGAAACTCTT CATCA-3’,下游引物:5’-GGAAGTCGGCCTCCAC TGGTATC-3’,扩增长度127 bp;GAPDH上游引物:5’-TGGAGTCTACTGGCGTCTT-3’,下游引物:5’- TGTCATATTTCTCGTGGTTCA-3’,扩增长度138 bp。
1.4 统计学方法
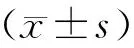
2 结果
2.1 免疫荧光与定量PCR评价局部形态
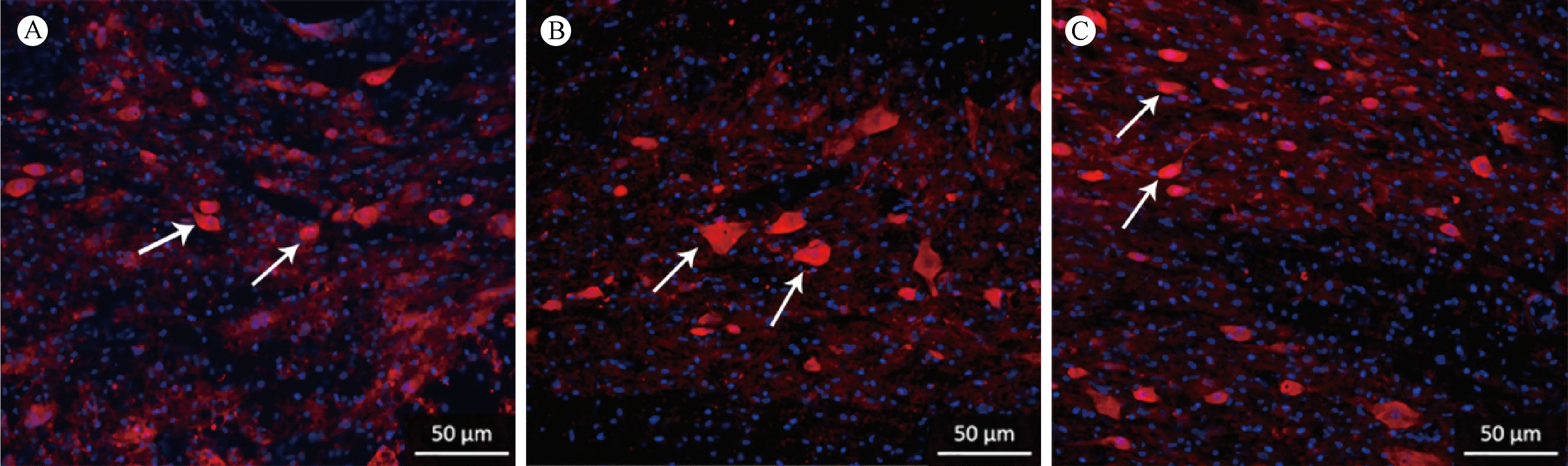
在脊髓损伤区域6周后,可见NF阳性表达的细胞(图1)。大鼠移植PPy/PLA/BMSCs组(521.4+58.97)显示NF阳性明显多于PPy/PLA(475.6+35.01)与对照组(404.9+31.12)。在损伤区域,可见NeuN阳性的细胞(图2A~C)。大鼠移植PPy/PLA/BMSCs组(35.81+6.01)显示NeuN阳性明显多于PPy/PLA(30.11+4.61)与对照组(19.42+3.8)(图3)。
2.2 VEGFA、Casp3基因表达
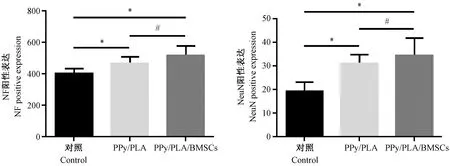
脊髓损伤区域内,PPy/PLA组和PPy/PLA/BMSCs组中的转录VEGFA mRNA量和转录Casp3 mRNA量在术后6周明显高于对照组。(图4)
2.3 电镜评价损伤局部形态
采用半薄切片投射电镜,观察术后6周损伤区域的脊髓组织,单纯脊髓损伤组可见大量的成纤维细胞(白色箭头),有较多胶原成分分布于成纤维细胞之间,可见较多胶原瘢痕,胶原瘢痕组织为成纤维细胞与胶原共同形成,新生髓鞘少见(黑色箭头),生长欠佳。在PPy/PLA与PPy/PLA/BMSCs移植组,移植区域可见到新生有髓神经纤维(图5)。损伤后6周,PPy/PLA/BMSCs移植组(12.96+1.74)的轴突数量大于PPy/PLA(8.19+1.62)与对照组(4.59+1.19),差异有显著性(P< 0.01)。(见图6)
注:A:对照组(全横断);B:PPy/PLA纳米纤维支架组;C:PPy/PLA纳米纤维支联合BMSCs组。图2 各组损伤后6周NeuN免疫荧光染色阳性表达Note.A: Control group(Complete transection).B: PPy/PLA nanofibrous scaffold group.C: PPy/PLA nanofibrous scaffold combined with BMSCs group.Figure.2 NeuN immunofluorescence staining 6 weeks after operation in each group
注:与对照组比较,*P< 0.05;与PPy/PLA组比较,#P< 0.05。下同。图3 损伤后6周各组的NF与NeuN免疫荧光表达定量Note.Compared with the control group,*P< 0.05.Compared with the PPy/PLA group,#P< 0.05.The same below.Figure.3 Quantification of NF and NeuN immunofluorescence expression 6 weeks after operation in each group
图4 各组术后VEGFA,Casp3表达Figure.4 Expression of VEGFA and Casp3 6 weeks after operation in each group

注:A:对照组(全横断);B:PPy/PLA纳米纤维支架组;C:PPy/PLA纳米纤维支联合BMSCs组;轴突(黑色箭头);成纤维细胞(白色箭头)。图5 TEM新轴突生长在各组损伤后6周Note.A: Control group(Complete transection); B:PPy/PLA nanofibrous scaffold group; C:PPy/PLA nanofibrous scaffold combined with BMSCs group.Axon (black arrow). Fiber cells (white arrow).Figure.5 TEM image of new axon formation in each group 6 weeks after operation
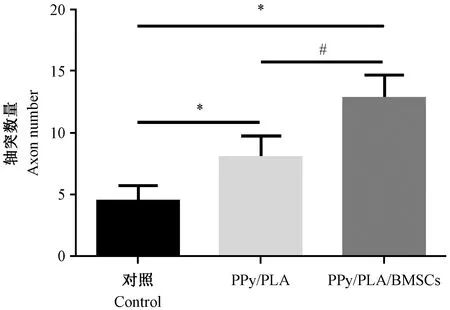
图6 损伤后6周各组的轴突定量Figure.6 Quantification of axon quantity 6 weeks after operation in each group
3 讨论
有研究表明,脊髓损伤后给与电刺激能促进损伤部位的神经修复,而导电高分子材料可以为这种神经修复方式提供电传导的介质,而且可以在电刺激的同时结合其他诱导因素促进神经修复[4]。目前应用于组织工程的很多聚合物不具备或具有较低的传导电信号的能力,因而其对神经功能的恢复能力有限。具有导电性的材料能提高材料与种子细胞以及神经组织的相容性,增强材料对种子细胞以及神经组织的支持作用。PPy具有良好的细胞相容性和电传导性能,但是单纯的PPy易碎且不能降解,而PLA是可降解性聚合物。作为细胞移植的载体已被体外实验证实,PC12细胞、施万细胞和嗅鞘细胞均可在PPy表面良好地存活和生长[5-8]。因此本研究合成PPy与PLA支架材料。PPy/PLA复合支架促进神经再生,且由于其本身可生物降解的特性,无需有创干预取出移植物。本研究团体近期的研究也证实施万细胞和人脐带间充质干细胞在PPy/PLA支架上能够很好地生长和存活[2-3]。这些研究与前期关于PPy材料良好组织相容性的研究相一致[9-10]。BMSCs具有多向分化、自我更新和分泌营养因子的潜能。许多研究已证明,BMSCs治疗中枢神经系统损伤具有巨大潜力,能通过促进自我修复和新血管生成等多种途径来修复中枢神经系统损伤。因此,本实验联合使用PPy/PLA支架材料与BMSCs治疗大鼠脊髓损伤并探讨其治疗的可能机制。
脊髓损伤导致感觉和运动功能丧失。这由于损伤导致的原发性神经元的损害,以及损伤后的复杂病理生理改变影响了局部微环境产生了继发性损害,从而阻碍轴突再生和延伸。脊髓损伤后自发的轴突再生能力有限。国内外诸多研究表明,引导再生的轴突穿过损伤间隙与远端是治疗脊髓损伤的主要策略[11-12]。PPy/ PLA可降解生物材料促进周围神经再生的研究前期已有相关报道,Xu等[4]使用PPy/PDLLA修复大鼠坐骨神经,为以后的神经工程研究带来希望。然而该材料在中枢神经系统中的研究尚鲜有报道。本研究免疫荧光检测结果显示损伤大鼠在接受PPy/PLA及PPy/PLA/BMSCs移植后较对照组显示出更多的NF阳性信号。而电镜结果显示PPy/PLA及PPy/PLA/BMSCs移植后较对照组轴突数量更多。qPCR结果显示PPy/PLA/BMSCs组较PPy/PLA及对照组的Nefh 和Tubulin表达增加。这些数据表明组织工程支架本身能够促进再生,而结合BMSCs移植治疗也能够支持和优化损伤部位的再生。
损伤局部的改变,例如水肿、炎症反应、细胞死亡、脊髓脱髓鞘、血管破坏等,会影响功能恢复。如何改善这些变化对于功能恢复有巨大支持作用。血管再生是神经再生的重要因素。前期研究揭示血管再生可能与神经突再生、轴突再生和神经保护相关[12-15]。而Mihardha等[16]报道了PPy材料的血管生成作用。本研究qPCR检测显示PPy/PLA和 PPy/PLA/BMSC治疗组较对照组具有更高的VEGF表达。此外,免疫荧光检测显示PPy/PLA 和 PPy/PLA/BMSC组NeuN阳性表达较对照组多。qPCR检测显示Casp3在PPy/PLA 和 PPy/PLA/BMSC组低表达。这些数据显示血管生成和神经保护在促进神经生长中发挥重要作用。
综上所述,应用PPy/PLA/BMSCs在治疗中枢神经系统损伤方面具有很大的潜能,有望成为神经修复新的治疗策略。其机制可能是PPy/PLA/BMSCs促进血管生成改善微环境并同时给予局部损伤区域神经保护。
