电解锰废液中锰镁分离及产物的利用研究
2018-08-29
(四川大学化学工程学院,四川成都,610065)
1 引言
电解锰废液是一种潜在的污染物,每年大量的产生于电解锰厂,我国是电解锰第一大生产国,每年的电解锰产量占据世界总产量的94%。根据之前的报道,每生产一吨电解锰,就要产生1~3吨的电解锰废水,然而,这些电解锰废液中仍然含有丰富的金属元素,如镁,锰等。显然,将这些电解锰废液直接排放不仅会造成环境的污染还会造成资源的浪费,又由于锰镁这两种元素在化学性质上具有许多的相似性,所以分离溶液中的锰镁也成为了行业中的一大难题[1]。目前,针对锰镁分离已经存在一些研究和报道,杨绍泽等研究了利用在乙醇溶液中硫酸锰与硫酸镁的溶解度不同,对锰镁元素进行分离,但是分离效率不高,实际应用价值也不高[2]。梁腾宇等采用氟化法形成氟化锰的方法,但会引入新的杂质,后续处理麻烦,造成环境污染。袁飞等采用蒸发结晶的方法对锰镁进行分离,但是锰镁的质量比的影响交大,在锰镁溶度接近的情况下采用结晶分离,效果不好[3]。李盼禹等研究了利用碳酸氢铵法对锰镁废液的分离,能够取得比较好的效果,但依旧有少量的锰离子不能分离[4]。
锰氧化物由于其具有的独特化学性质,在催化剂,超级电容,锂电池等领域引起了人们广泛的兴趣,但之前的研究大多数锰氧化物都是从纯净的化学试剂制得,是而直接对电解锰废液中得到的锰氧化物的研究很少,碱式碳酸镁用途也十分广泛,可应用于橡胶,药物,绝缘材料的制备,近年来,在食品,化妆品等领域作为添加剂也取得了良好的应用价值[5]。
本文对四川某电解锰厂的废液进行了锰镁分离,采用过硫酸铵法去除了废液中的锰离子,考察了pH值,反应温度,反应时间对电解锰废液中锰离子去除的影响,将分离过后的滤液,通过减压蒸氨,碳酸氢铵法制得碱式碳酸镁,针对电解锰废液中制得的锰氧化物,并对其中锰氧化物进行了表征,且研究锰氧化物的催化性能。
2 实验部分
2.1 实验原料
四川某电解锰厂的电解锰废液,其中主要离子及含量见表1。
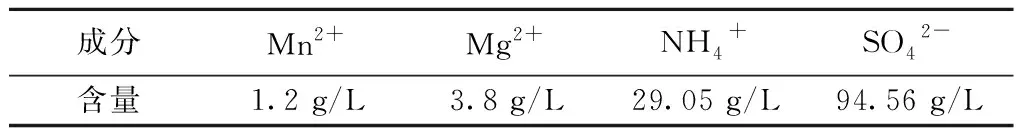
表1 锰废液中主要成分及含量
2.2 实验试剂与仪器
主要试剂:过硫酸铵、浓氨水、碳酸氢铵、过氧单磺酸钾(PMS)等(购自四川蜀都试剂厂)。
主要仪器:恒温水浴磁力搅拌器(鼎新DF-101S);紫外分光光度计(上海普元1900s);高效液相色谱(赛默飞 Ultimate3000);扫描电镜(Zeiss Merlin Compact-61-78);X射线衍射仪(Riau D/max-TTR III);旋转蒸发仪(RE-52AA)。
2.3 实验方法
取100 mL 电解锰废液放入250 mL 烧杯,并将其并放入恒温水浴磁力搅拌器中,加入0.6 g过硫酸铵,在一定的时间间隔内,取1 mL反应液,通过0.2 μm滤头过滤1 mL离心管内,并检测滤液中锰离子和镁离子浓度。待反应充分反应后,过滤,将滤液进行蒸氨后,添加碳酸氢铵制得碱式碳酸镁。将过滤后的棕黑色沉淀收集,用去离子水清洗三次,并放置在60 ℃ 的恒温干燥箱12 h。
2.4 主要涉及的原理与化学反应式
2.4.1 锰氧化物制备
pH值<7
(NH4)2S2O8+MnSO4+H2O→(NH4)2SO4+δ-MnO2↓+H2SO4
(1)
pH值>7
Mn2++OH-→Mn(OH)2
(2)
Mn(OH)2+(NH4)2S2O8→(NH4)2SO4+Mn3O4↓+H2O+H2SO4
(3)
2.4.2 碱式碳酸镁的制备
MgSO4+NH4HCO3+H2O→4MgCO3·Mg(OH)2·4H2O↓+(NH4)2SO4+CO2
(4)
2.5 分析方法
2.5.1 溶液中锰和镁的测定方法
锰的测定:甲醛肟分光光度法;镁的测定:EDTA络合滴定法;苯酚的测定:高效液相色谱法。
2.5.2 锰氧化物催化性能的检测方法
取20 mg 锰氧化物,放入含有100 mL 苯酚浓度为25 mg/L的烧杯中,将烧杯放在恒温水浴的磁力搅拌器上,烧杯外面包裹锡箔纸,避免了光照对催化性能的影响,加入0.15 g PMS,充分搅拌均匀,每隔一段时间,取一定量的反应液用0.2 μm滤头过滤,并用等体积的甲醇溶液进行猝灭反应阻止反应的进步一步进行,用高效液相色谱对滤液中的苯酚含量进行检测。高液液相色谱中苯酚的检测条件:流动相 乙腈/水= 7/3 检测波长 λ = 269 nm 分离柱C-18柱 流速为 1 mL/min。
2.5.3 锰氧化物的及碱式碳酸镁的表征
锰氧化物的表征:通过X射线衍射对所得到的锰氧化物,扫描电镜来观察锰氧化物的微观形貌;碱式碳酸镁的表征:通过X射线衍射对制备的镁化合物进行晶型测定。
3 结果与讨论
3.1 锰镁分离的影响因素
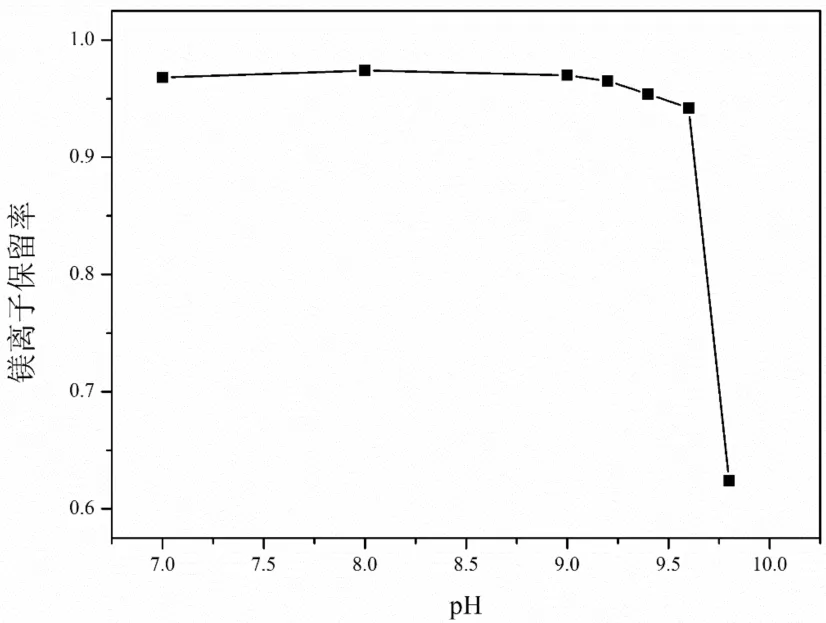
图1 pH值对镁离子保留率的影响
由图1可以看出,pH值在7到9.6之间,溶液中的镁离子的保留率在96%左右,这一部分损失的镁离子,可能由于产生的锰氧化物对镁离子产生吸附作用,带走溶液中一部分镁离子,而当pH值进一步增加时,镁离子的保留率急剧下降,如图1所示当pH值增加到9.8时,镁离子的保留率下降到63%,这可能是由于溶液中氢氧根离子过高导致,镁离子与氢氧根结合,产生了氢氧化镁沉淀,而之前的文献对比[6],pH值在接近9时就开始产生沉淀,而在这个反应体系中在pH值为9.8时才产生沉淀,可能原因是溶液中含有的铵根离子过多,能够形成硫酸铵镁,对氢氧化镁沉淀的生成起到了一定的抑制作用。
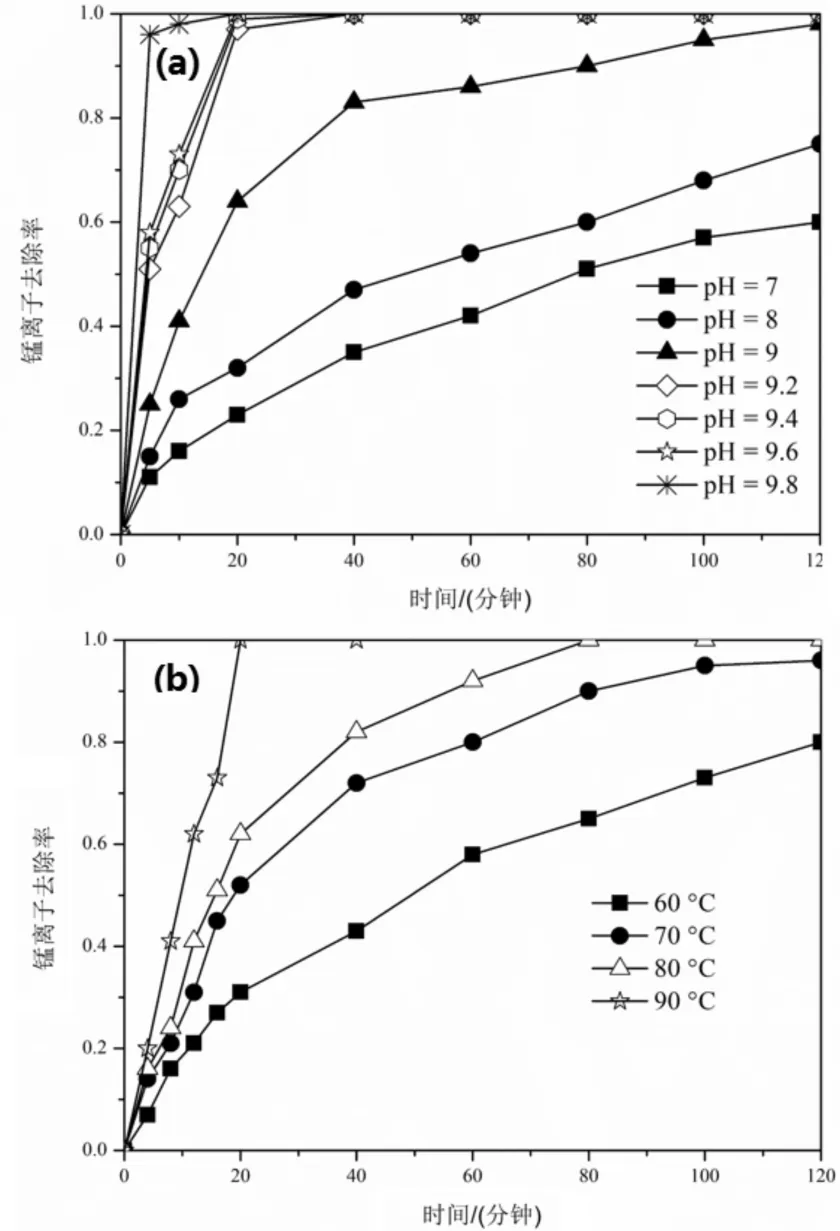
图2 pH值(a)和温度(b)对锰离子去除率的影响
由图2(a)可以看出,pH值对锰离子的去除速率影响十分大,锰离子的去除速率随着锰pH值的升高而升高,当pH值在9.6时,在反应时间为20min内,锰离子的去除率能达到100%,在一定pH值范围内溶液中的铵水及铵根离子能够抑制镁离子产生沉淀,而加快了溶液中锰离子的去除效率。而进一步增加pH值,尽管锰离子能够在更短的时间里去除干净,镁离子也终将变成氢氧化镁沉淀到溶液中,不利于锰镁的分离。pH值造成反应速率加快的原因可能是在碱性条件下生成的Mn(OH)2不稳定,更容易被氧化生成沉淀,所以锰离子溶液中最佳的pH值是9.6。从图2(b)看出,随着温度的升高,锰离子的去除速率逐渐增快,当温度为60 ℃且反应时间为120 min时,锰的去除率能达到81%,而当温度升高到90 ℃,在反应时间为20 min,就可以取得100%的去除率。在实验过程中,我们发现当温度进一步增高,溶液变得不稳定,开始剧烈沸腾,可能时由于体系中氨水及铵根离子溶度过高,使溶液沸点降低。所以我们选择90 ℃为锰镁分离的最佳温度。
3.2 锰氧化物的表征
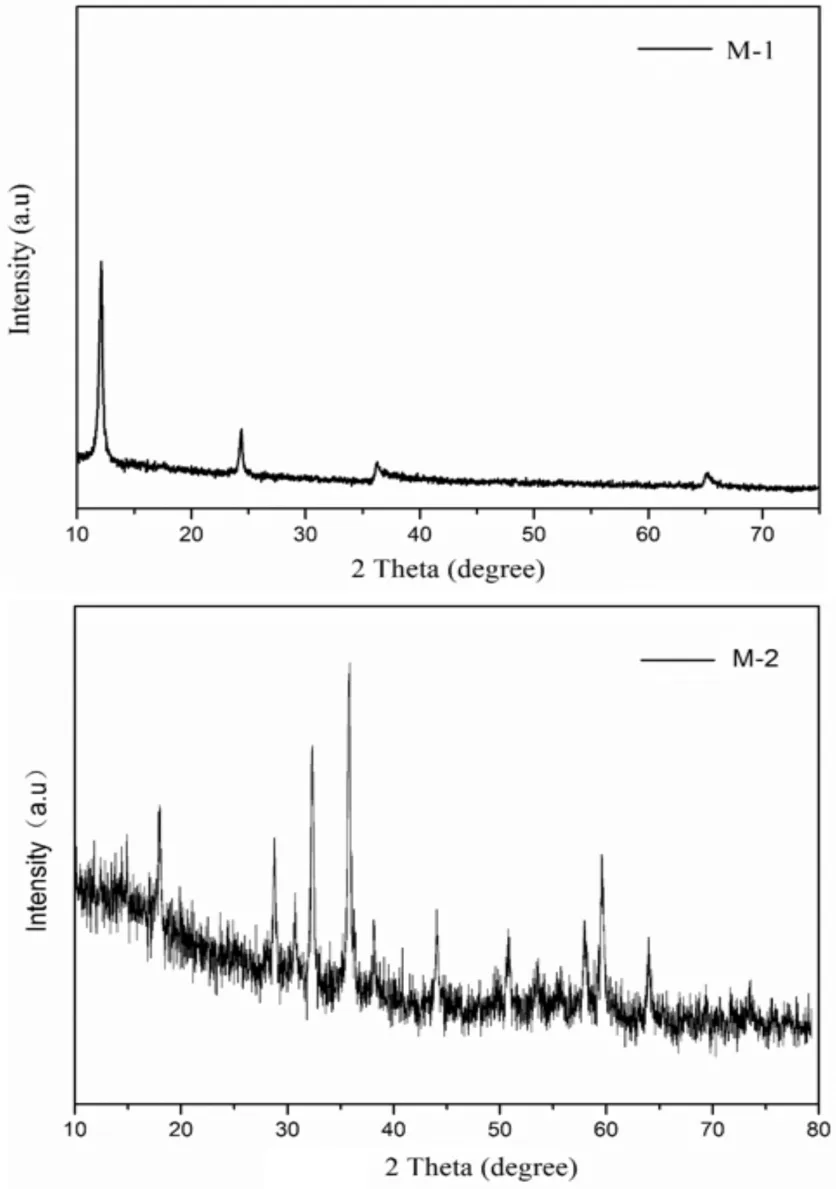
图3 M-1和M-2的XRD图谱
由图3可以看出,M-1和M-2锰氧化物为两种完全不同的峰,通过与标准XRD卡片对比,M-1为δ-MnO2,M-2所对应的峰时Mn3O4,两种锰氧化物的峰强度都很高,而且没有其它的峰,表明电解锰废液中所得到的锰氧化物的结晶度比较好而且纯度比较高[7-9]。

图4 M-1(A)和M-2(B)的扫描电镜图片
由图4(A)可以看出,其中的二氧化锰由均一的纳米花球状颗粒构成,直径在大约1~ 4 μm,而这些花状球由无数的纳米片构成,厚度大概在20 nm,而由图4(B)可以看出,在碱性条件下,从电解锰废水中制备的四氧化三锰由均一的直径大概在100 nm的球形颗粒构成,紧密的团聚在一起。
3.3 锰氧化物吸附催化性能及催化动力学研究
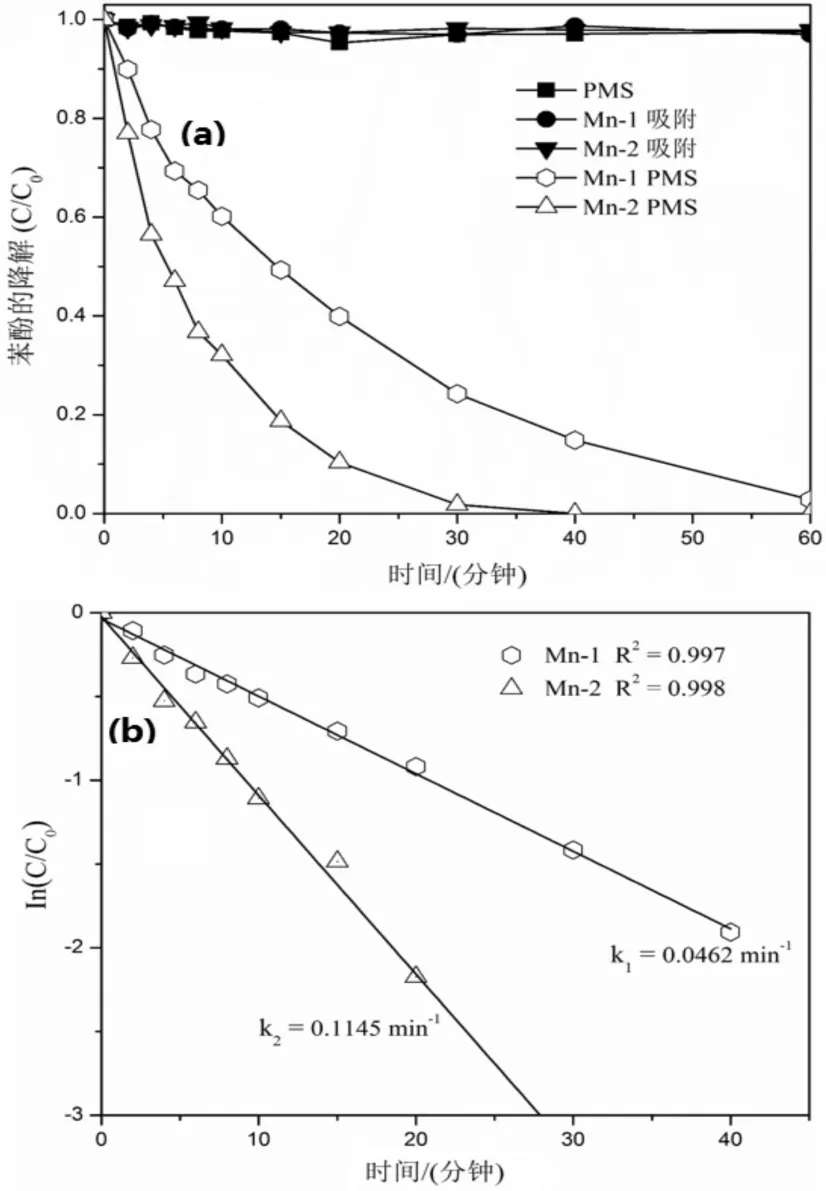
图5 锰氧化物催化吸附性能(a)以及催化动力学(b)的比较
由图5(a)可以看出,在60 min内,纳米二氧化锰与四氧化三锰对苯酚的吸附性能都很小,吸附量大概在2 %以内,所以表明吸附对催化性能的影响可以忽略不记,在40 min内,颗粒状的四氧化三锰能够完全催化PMS产生硫酸根自由基降解苯酚,并取得100%的降解率,而花球状的二氧化锰对苯酚的降解效率为81 %,表明从废液中制备的四氧化三锰具有更高的催化活性。由图5(b)可以看出,Mn3O4比MnO2都十分好的符合一阶段反应动力学,Mn3O4的速率常数明显比MnO2的反应速率常数高,原因可能是Mn3O4粒径更小,能够提供更多的活性位点,以及Mn3O4催化剂表面具有的三价锰离子具有更高的催化活性[10-11]。
3.4 碱式碳酸镁的测定

图6 M-3的XRD卡片
从图6可以看出,与标准XRD卡片对比,为碱式碳酸镁,而且没有其他的杂质峰出现,表明锰镁废液中,能够得到高纯度的碱式碳酸镁,并甲醇肟分光光度法检测其中的锰离子含量,结果显示锰离子含量小于0.002mg/g,能够达到国家的标准[12]。
4 结论
在用过硫酸铵法去除溶液中的锰离子时, pH值<9.6时能够明显的提高锰离子的去除速率,而对镁离子的保留率影响较小。废液中的铵根离子能够起到一个缓冲的作用,让镁离子能够在较高pH值下不产生沉淀,从而提高了锰离子的去除效率。当温度小于90℃时,温度的提高,使溶液在一个较稳定的体系内也能显著的提高锰离子的去除效率,所以在这个体系中,锰镁分离的最佳工艺条件是温度为90℃,pH值为9.6,反应时间为20 min。采用过硫酸铵法处理电解锰废液不仅可以得到高纯度的含镁溶液用来做工业原料,而且得到了具有高催化活性的四氧化三锰锰氧化物。
