青蒿琥酯逆转人卵巢癌3AO细胞所致T淋巴细胞的免疫抑制研究
2018-08-29高英芳张志敏张雪玲郝红娟
陈 晓,高英芳,张志敏,张雪玲,王 岩,郝红娟
(河北省石家庄市第四医院妇产科 050011)
卵巢癌是常见的妇科恶性肿瘤之一,确诊时多数已至晚期,预后较差。目前,临床多采用手术切除及术后化疗方法治疗,但80%患者会出现复发和病灶转移[1]。医学界对卵巢癌的发病机制进行了深入的研究,发现卵巢癌细胞分泌的多种免疫因子异常超表达,从而使机体处于免疫抑制状态,并导致肿瘤细胞的“免疫逃逸”[1]。随着肿瘤免疫学的广泛研究,肿瘤免疫生物学治疗已经成为肿瘤治疗的新型辅助治疗模式,具体包括抗体免疫导向疗法、接种肿瘤疫苗的特异性主动免疫疗法、癌基因表达封闭及抑癌基因恢复的基因疗法、肿瘤血管生成拮抗方法、表观遗传修饰等[2]。然而,上述几种肿瘤免疫疗法多处于试验研究阶段,缺点为作用靶点单一,且毒副反应较明显。抗瘤中药制剂具有多靶点的优点,不仅可明显干扰肿瘤细胞的增殖,上调机体免疫功能,还可增强放化疗敏感性、降低毒副反应[3]。本课题组前期的试验结果显示,砷剂、黄芪、川芎嗪、猪苓多糖、苦参碱和青蒿素衍生物等可有效逆转结直肠癌所致免疫抑制,弥补放化疗和肿瘤生物制剂在临床使用中的不足[4]。其中,青蒿琥酯(ART)可抑制自然杀伤细胞(NK)杀伤抑制及结直肠癌细胞株Colon26所致的CD3ε-ζ+表达抑制,但其在卵巢癌免疫抑制中的作用鲜见相关报道。本研究旨在原有报道的基础上,体外试验研究ART对卵巢癌所致T细胞免疫抑制的影响,以进一步验证ART具有逆转肿瘤免疫抑制的作用,为解决卵巢癌治疗中的瓶颈难题提供新思路和新依据。
1 材料与方法
1.1材料
1.1.1试验材料 人卵巢癌3AO细胞为河北医科大学基础医学院免疫教研室宋淑霞教授惠赠。外周血取自健康的女性志愿者(共20名),年龄17~22岁,平均(19.33±1.45)岁,所有志愿者均已知情同意,本研究操作均遵循石家庄市第四医院科学研究规范。
1.1.2主要试剂 DMEM购自北京海克隆生物化学制品有限公司;标准胎牛血清购自天津市灏洋生物制品科技责任有限公司;植物血凝素(PHA)、噻唑蓝(MTT)购自美国Sigma公司;二甲亚砜(DMSO)购自天津市永大化学试剂开发中心;淋巴细胞分离液购自上海恒信化学试剂有限公司;青蒿琥酯粉剂购自桂林南药股份有限公司;异硫氰酸荧光素(FITC)标记的小鼠抗人CD3ε单抗(CD3-FITC)及CD4单抗(CD4-PE)、藻红蛋白(PE)标记的小鼠抗人CD25(IL-2Rα)单抗(CD25-PE)及CD247(CD3ζ链)单抗(CD247-PE)购自美国eBioscience公司。
1.2方法
1.2.1试验分组 按照细胞培养上清液进行分组。完全培养基组为正常对照(Con)组,不含及含ART的完全培养基组分别为Con-S组和ART-S组,连续两次ART再培养组为ART-S1组及ART-S2组,不经ART作用的同步两次再培养组为Con-S1组及Con-S2组。
1.2.2人外周血单个核细胞(PBMC)的制备 抽取健康女性志愿者外周血15~20 mL入抗凝管, Hank′s液1.5倍稀释,淋巴细胞分离液沿管壁缓慢加入(淋巴细胞分离液与稀释前血液等体积),保持清晰的分层状态。2 000 r/min离心20 min后吸取液体界PBMC层入新离心管, Hank′s液轻柔清洗,加完全培养液制备细胞悬液。
1.2.3MTT法检测 0.25%胰蛋白酶消化处于对数增长期的3AO细胞,完全培养基重悬至2×108/L,接种于96孔板48 h。细胞培养结束前4 h,每孔加入MTT(5 g/L) 20 μL。细胞培养结束后离心弃上清液,每孔加入150 μL DMSO,酶联免疫检测仪检测A492 nm值。
1.2.4ART作用及作用后再培养的3AO细胞培养上清液的制备 0.25%胰蛋白酶消化对数生长期3AO细胞,分别用不含和含ART的完全培养基重悬至2×108/L,使ART的终浓度为12.50 mg/L。预试验已证明12.50 mg/L的ART对3AO细胞增殖无明显影响。培养48 h后收集不含及含ART作用的细胞培养上清液(Con-S组和ART-S组)。彻底清洗掉残余药物,重悬细胞至初始接种浓度,收集连续两次ART再培养上清液(ART-S1及ART-S2),以不经ART作用的同步再培养上清液(Con-S1组及Con-S2组)作对照。台盼蓝染色法进行活细胞计数,MTT法进行细胞增殖率检测(A492 nm值),细胞培养上清液-70 ℃冻存。
1.2.5ART对T淋巴细胞表面活化信号分子表达的影响 参考文献[5]报道,培养瓶中分别加入0.25 mL 的PBMC(1×107/mL)和PHA(20 mg/L)及0.5 mL的待测上清液,以完全培养基为正常对照(Con组)。培养48 h后消化、重悬细胞,并取1×106个细胞分别加入CD4-FITC及CD25-PE或CD3-FITC及CD247-PE单抗各20 μL,室温避光孵育20 min。离心弃上清液后悬浮细胞,流式细胞仪检测CD3ε+、CD3ε+ζ+、IL-2Rα+阳性细胞表达百分率,表达抑制率(%)=[(Con组阳性细胞表达百分率-Con-S和ART-S各组阳性细胞表达百分率)/Con组阳性细胞表达百分率]×100%。相同荧光素标记的人Isotype IgG作为阴性对照。
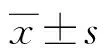
2 结 果
2.1试验用ART浓度的确定 添加不同浓度的ART作用于3AO细胞,MTT检测结果显示,最高浓度为12.50 mg/L的ART对3AO细胞增殖与Con组比较差异无统计学意义(P>0.05),见图1A。ART-S和Con-S组的培养基作用3AO细胞48 h及作用后连续两次再培养3AO细胞,MTT法结果显示,与未经ART作用同步培养的3AO细胞相比,12.50 mg/L的ART未明显影响细胞增殖(P>0.05),见图1B。本课题组考察了Con组、Con-S组和Con-S1组、 Con-S2组对PMBC增殖的影响,MTT检测结果显示,各组的A492 nm值分别为0.28±0.03、0.29±0.06、0.29±0.05和0.28±0.04,差异无统计学意义(P>0.05)。
A:不同浓度的ART细胞的A492 nm值;B:各组细胞的A492 nm值
图1 MTT法检测结果
2.2ART对3AO细胞所致T淋巴细胞表面活化信号分子表达抑制的影响 在Con组,淋巴细胞CD3ε+、CD3ε+ζ+、IL-2Rα+阳性细胞百分率分别为(86.07±10.05)%、(25.09±5.84)%、(39.11±5.83)%。Con-S组、Con-S1组和Con-S2组中3项免疫功能指标均明显受抑(P<0.05)。与Con-S组相比,ART-S组中T淋巴细胞表面CD3ε+、CD3ε+ζ+、IL-2Rα+的表达抑制明显下降(P<0.05)。ART-S1组对免疫功能抑制作用与Con-S1组相比均明显降低(P<0.05); ART-S2组对CD3ε+及IL-2Rα表达抑制的逆转作用与Con-S2组相比明显增加(P<0.05),但是对CD3ε+ζ+的表达抑制无明显逆转作用(P>0.05),见图2。
2.3ART对T淋巴细胞表面活化信号分子表达抑制率的影响 在Con-S组中,CD3ε+、CD3ε+ζ+、IL-2Rα+阳性细胞表达抑制率分别为(50.17±8.02)%、(87.51±9.17)%、(64.84±9.74)%。与Con-S组相比,ART-S组中CD3ε+、CD3ε+ζ+、IL-2Rα+表达抑制率明显降低(P<0.05)。与Con-S1组和Con-S2组相比,ART-S1组和ART-S2组对CD3ε+、IL-2Rα+的表达抑制率有明显下调(P<0.05),Con-S2组与ART-S2组中CD3ε+ζ+的表达抑制率比较差异无统计学意义(P>0.05),见图3。
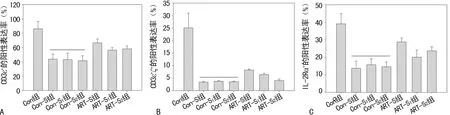
A:各组CD3ε+的阳性表达;B:各组CD3ε+ζ+的阳性表达;C:各组IL-2Rα+的阳性表达
图2 ART对T淋巴细胞表面3种免疫功能指标表达的影响
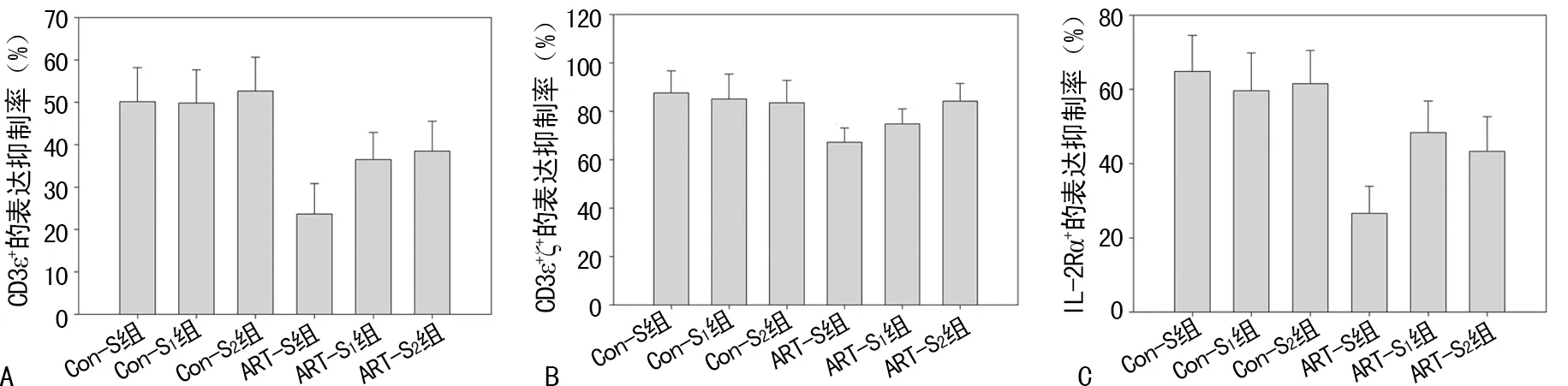
A:各组CD3ε+的表达抑制率;B:各组CD3ε+ζ+的表达抑制率;C:各组IL-2Rα+的表达抑制率
图3 ART对T淋巴细胞表面3种免疫功能指标的抑制效率
3 讨 论
卵巢癌是严重危害女性身心健康的恶性肿瘤之一[6]。常规采用的手术切除和放化疗治疗后患者5年生存率不足30%[7],手术及术后放化疗多加重卵巢癌所致的免疫抑制。
患者被诊断为卵巢癌时多数已至癌症晚期,此时肿瘤细胞已经跨过“免疫消除”和“免疫均衡”阶段,进入到 “免疫逃逸”阶段[8]。经典的手术及术后化疗会进一步加重免疫抑制。因此,寻找具有肿瘤免疫抑制作用的逆转类药物成为肿瘤治疗的关键所在,但此类药物目前尚处于试验阶段,初步研究结果与目标疗效尚有一定差距。
考虑到抗瘤中医制剂具有清热解毒、以毒攻毒、活血化瘀、化痰祛湿、软坚散结、扶正祛邪的作用特点[5],本课题组前期选取苦参碱和青蒿素衍生物(清热解毒类)、砷剂(以毒攻毒类)、川芎嗪(活血化瘀类)、猪苓多糖(软坚散结类)、黄芪(扶正祛邪类)6味中药,研究其在直肠癌所致免疫抑制中的逆转作用,结果显示我国科学工作者自主研发的抗疟药ART对结直肠肿瘤免疫抑制的下调效应强而持久[9]。另有文献报道,ART抑制人Tenon囊成纤维细胞和人肺腺癌细胞系A549的增殖[10-11],并将乳腺癌细胞阻滞在G2/M期[12],提示ART具有抑制肿瘤细胞增殖作用。与现有的抑瘤药物相比,ART注射液制剂具有起效较快、作用较强,促进肿瘤细胞的分化和凋亡、调控肿瘤新生血管形成的作用[13],但其对卵巢癌免疫抑制的影响尚未见报道。
CD3ζ链是一种受体激活的蛋白酪氨酸激酶底物,受体与配体的结合导致ζ链发生酪氨酸磷酸化,参与淋巴细胞胞内活化信号的转导。CD3ε链基因缺陷可致T细胞信号传导缺陷[14]。IL-2R分布于活化的T细胞、NK细胞和B细胞表面,其α链对形成高亲和力受体有重要意义。考虑到上述3种免疫因子在免疫细胞信号转导中的重要作用,本研究考察ART对其表达的调控作用。
肿瘤细胞自身分泌的免疫抑制物质可以引起肿瘤免疫抑制,且肿瘤细胞的分泌功能取决于自身的增殖活性。ART超过一定浓度范围后可影响免疫细胞的增殖,在本研究中, 12.50 mg/L ART用3AO细胞48 h,及连续两次48 h传代培养的细胞,其A492 nm值与未经药物作用同步对照培养的3AO之间差异无统计学意义(P>0.05)。单纯的3AO细胞培养上清液对PBMC的增殖率的影响与完全培养基代替3AO细胞培养上清液的Con组相比也无明显差异,说明单纯的3AO细胞培养上清液对免疫细胞的增殖无影响。
本研究收集添加或不添加ART(12.50 mg/L)的3AO细胞培养上清液,各种培养上清液处理PBMC后检测ART对3AO所致T淋巴细胞表面免疫因子的表达抑制是否具有逆转作用。流式细胞术结果显示,ART可明显下调卵巢癌3AO细胞所致CD3ε+、CD3ε+ζ+和IL-2Rα+的表达抑制,但是不可以完全消除表达抑制,提示ART可以与其他抗瘤药物组方以调整癌症患者的免疫抑制。崔澂等[5]报道了ART明显下调小鼠结直肠癌细胞Colon26所致NK细胞的杀伤抑制和脾细胞表面CD3ε+ζ+的表达抑制。本研究与崔澂的研究结果一致,提示ART可能通过降低癌细胞所致靶细胞表面免疫因子的表达抑制,进而激活免疫应答反应。卵巢癌细胞可以分泌多种免疫抑制因子,使机体处于免疫抑制状态,是卵巢癌免疫抑制的机制之一[1],本研究将在未来的工作中考察ART对卵巢癌细胞分泌免疫因子的影响,结合ART与其他抗瘤药物联合用药对免疫抑制的逆转作用,以期获得逆转卵巢癌免疫抑制的最佳方剂。
目前,肿瘤免疫抑制作用是制约手术、放化疗及肿瘤生物治疗的瓶颈性难题,其中关键的是肿瘤细胞所致T淋巴细胞免疫抑制[15]。因此,研发具有T淋巴细胞免疫抑制逆转效应的新型多靶点抗瘤药物已经成为医学热点。本研究通过体外卵巢癌细胞的免疫抑制试验证明了ART对卵巢癌所致T淋巴细胞免疫抑制的下调有一定的逆转作用,初步证明了ART具有抗瘤潜力,为考察ART的抗瘤机制提供了理论依据。
