细胞因子在肝泡球蚴病肝组织边缘带的表达及意义*
2018-08-29樊海宁王海久乜国雁张朝霞
张 萍,樊海宁,王海久,王 展,乜国雁,张朝霞,王 花
(1.青海卫生职业技术学院,西宁 810000;2.青海大学附属医院肝胆胰外科,西宁 810001; 3.青海省包虫病研究重点实验室,西宁 810001;4.青海省人民医院泌尿外科,西宁 810007)
肝泡球蚴病(HAE)是一种危害极大的致死性寄生虫病,在我国西北地区尤其是青藏高原地区广泛流行。该病几乎均原发于肝脏,具有与恶性肿瘤尤其是肝癌类似的浸润和转移的生物学行为[1]。HAE手术切除率低,病死率高,故有“虫癌”之称[2]。有学者认为在HAE病灶边缘可能存在着“浸润带”或“生物学边界”[3],是有活性的棘球蚴囊蚴赖以生存和增殖的基础,故边缘带成为HAE研究的一个重点。多项研究表明,基质金属蛋白酶-2(MMP-2)在肿瘤血管生成、侵袭转移过程中起着重要作用;CD34高表达可促进多种肿瘤新生血管形成。笔者研究MMP-2和CD34在HAE边缘带组织的表达,并结合临床病理特性,探讨新生血管在HAE浸润性生长中的作用。
1 资料与方法
1.1一般资料 收集青海大学附属医院、青海省人民医院2014年7月至2017年7月手术后经病理诊断为HAE的组织及距病灶边缘5 cm以外的正常肝组织标本各40例。所有患者均知情并签署知情同意书。其中男16例,女24例;年龄15~57岁,平均(34.6±5.8)岁;藏族32例,汉族8例;19例发生转移(包括肝内外转移)。所有患者术前均未接受任何包虫病药物治疗。
1.2方法
1.2.1试验方法 采用免疫组织化学SP法。即用型鼠抗人MMP-2 单克隆抗体(ZM-0330)、鼠抗人CD34单克隆抗体(ZM-0046)等购自北京中杉金桥生物技术有限公司。自动组织包埋机(Leica EG1160)及石蜡切片机(Leica 2245)均为德国Leica公司生产;显微镜(CX31RBSF)和数码相机(C-7070 Wide Zoom)均为日本Olympus公司生产。标本经10%甲醛固定,石蜡包埋后4 μm连续切片,行苏木素-伊红染色(HE)和免疫组织化学SP染色,同时以磷酸盐缓冲液(PBS)替代一抗做阴性空白对照。
1.2.2结果判定 每张切片观察5个高倍镜视野,参照MATTEM等[4]的方法判定免疫组织化学染色阳性细胞所占的百分数来计算结果。(1)显色深浅:不显色或显色不清为0分,黄色为1分,棕黄色为2分,深褐色为3分;(2)着色细胞占计数细胞百分率:未见着色细胞为0分,≤25%为1分,>25%~50%为2分,>50%为3分。二者之和为0~2分判为阴性,3~6分判为阳性。每张切片均要求有两位病理医师采用双盲法阅片。
1.3统计学处理 采用SPSS17.0统计软件,计数资料以频数或百分率表示,比较采用χ2检验,相互关联采用Spearman相关性分析,以P<0.05为差异有统计学意义。
2 结 果
2.1HAE大体标本观察 HAE病灶由无数小结节或小囊泡(直径多为1~3 mm)集合,为海绵状团块,颜色呈灰白与淡黄色相间,与周围肝组织分界不清,触之质地硬似软骨,刀切常有砂粒样感觉,切面为淡黄色的坏死区与灰白色发亮的纤维层交错出现,外观似蜂巢状或虫蚀状改变,病变中央有时呈胶冻状。巨块型的可见灰黄色豆渣样大片坏死,伴液化,见图1。
2.2HE染色观察 病变界限不清,呈浸润性生长,可见多灶性凝固性坏死和边缘带典型泡球蚴肉芽肿。肉芽肿由呈栅栏状排列的上皮样组织细胞组成,纤维组织增生明显,有较多淋巴细胞、浆细胞、巨噬细胞等炎性细胞浸润,病灶边缘残余少量肝组织结构,泡壁周围肝组织血管扩张充血,见图2。

图1 HAE病灶大体标本
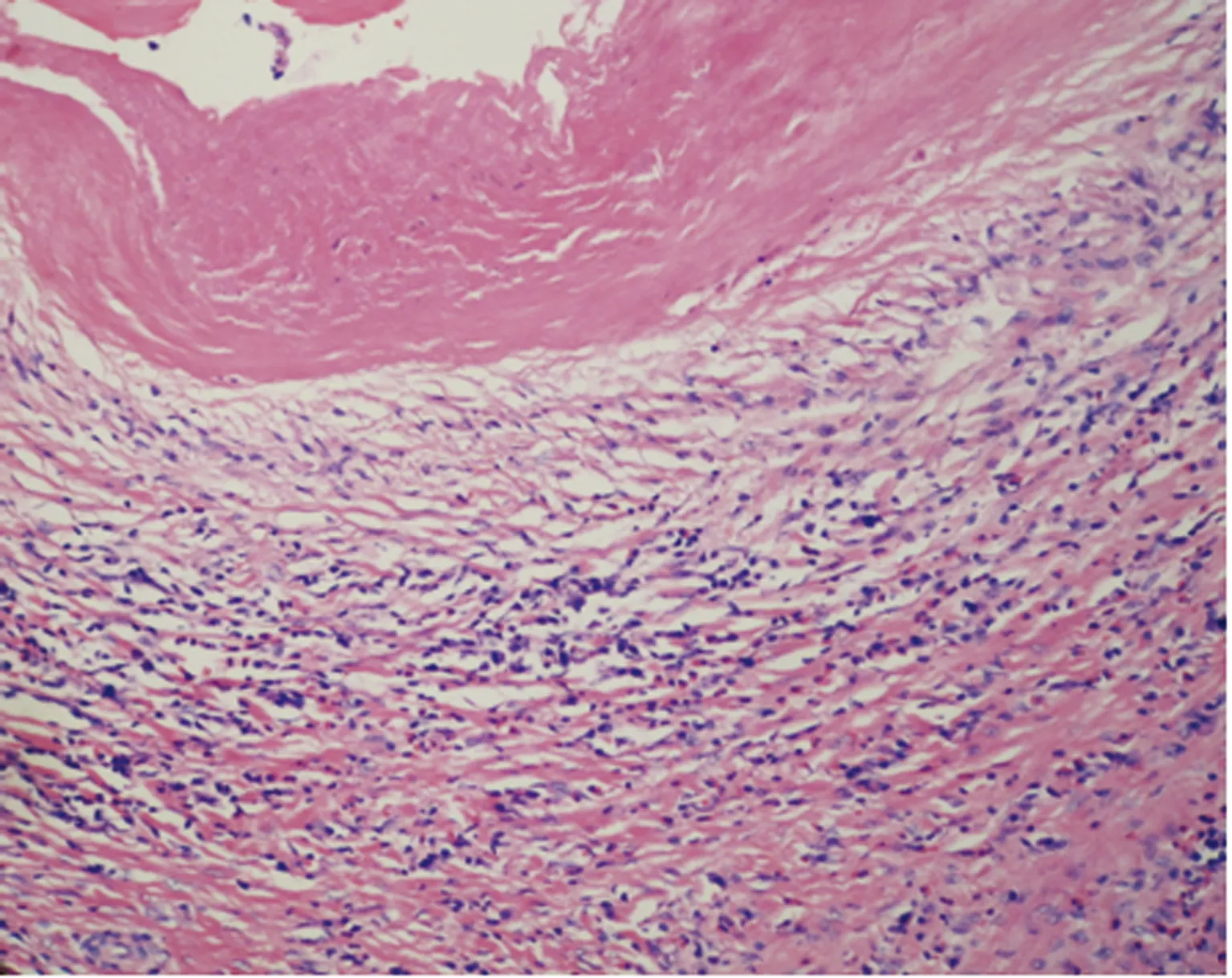
图2 HAE组织HE染色(×200)
2.3MMP-2和CD34在HAE组织中表达 HAE病灶内可见大片凝固性坏死,MMP-2和CD34的阳性表达程度以HAE病灶与正常肝组织交界的边缘带最明显。边缘带主要为囊泡壁周围肉芽肿炎症细胞和周边部分残存肝细胞,MMP-2以细胞质和部分细胞膜呈棕黄色为阳性细胞(图3);CD34定位于血管内皮细胞的胞质,呈棕黄色,CD34染色内皮细胞呈点状、线状、半环状、环状散在分布(图4)。HAE边缘带组织中MMP-2阳性表达率为60.0%(24/40),高于病灶旁正常肝组织中阳性表达率为27.5%(11/40),差异有统计学意义(P<0.01)。HAE边缘带组织中CD34阳性表达率62.5%(25/40)明显高于病灶旁正常肝组织中阳性表达率25.0%(10/40),差异有统计学意义(P<0.01)。

图3 MMP-2在HAE边缘带表达(SP,×200)

图4 CD34在HAE边缘带表达(SP,×200)
2.4MMP-2和CD34在HAE边缘带表达与临床病理特性关系 在发生转移的HAE边缘带组织中MMP-2、CD34的阳性表达率分别为78.9%(15/19)和78.9%(15/19),明显高于未发生转移的MMP-2、CD34的阳性表达率[42.9%(9/21)和47.6%(10/21)],差异有统计学意义(P<0.05);MMP-2和CD34在HAE边缘带阳性表达与HAE患者的性别、年龄、民族、甲胎蛋白(AFP)、乙型肝炎病毒表面抗原(HBsAg)、病灶大小等因素无关,见表1。
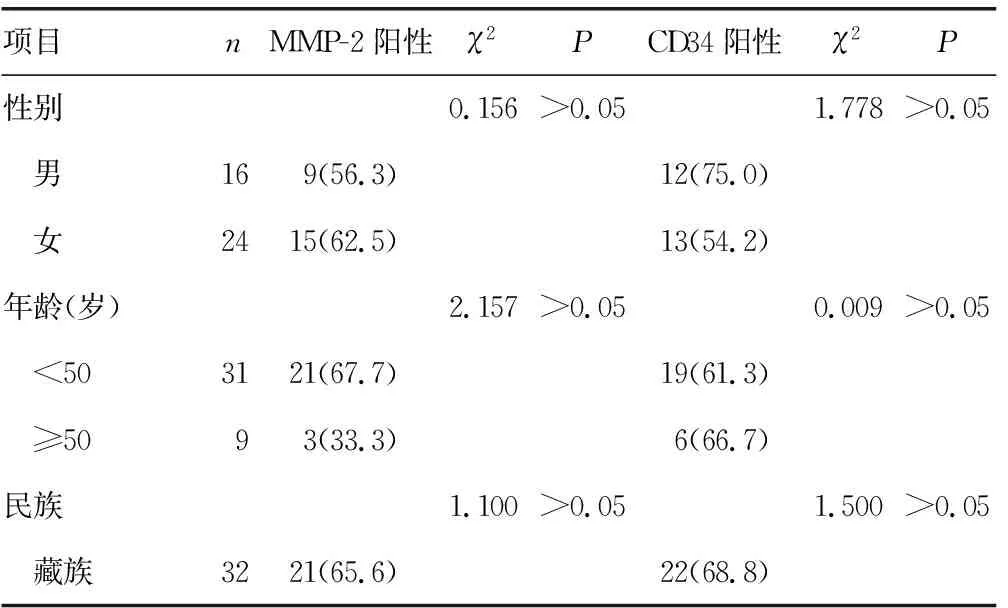
表1 MMP-2和CD34的表达与HAE临床病理的关系[n(%)]

续表1 MMP-2和CD34的表达与HAE临床病理的关系[n(%)]
2.5MMP-2和CD34在HAE组织中表达的相关性 在40例患者中,MMP-2和CD34均为阳性表达的有19例,均为阴性表达的有10例;MMP-2阳性表达和CD34阴性表达的有5例,MMP-2阴性表达而CD34阳性表达的有6例。Spearman相关分析显示,MMP-2和CD34两者之间的表达存在正相关(r=0.442,P<0.01)。
3 讨 论
恶性肿瘤的发生、发展、浸润、转移等生物学行为都与新生血管密切相关,而HAE病灶与肿瘤相比具有相似的生长方式[5]。
MMP-2为锌离子依赖性内肽酶,能降解血管基底膜和细胞外基质中的Ⅳ型胶原成分,使肿瘤细胞易于突破结构屏障,与肿瘤内血管生成、侵袭、转移相关[6]。有研究表明,MMP-2基因敲除的小鼠表现出肿瘤组织血管新生能力的减弱从而导致的肿瘤生长减慢[7]。本研究中MMP-2阳性表达率在HAE边缘带组织高于正常肝组织(P<0.01);有转移灶边缘带表达高于无转移灶边缘带(P<0.05)。本课题组前期研究表明, MMP-2高表达可能具有促进生物学行为,类似癌细胞的HAE的浸润和转移[8]。马少波等[9]报道,小鼠血清MMP-2水平升高可能与泡状棘球蚴的浸润性生长存在相关性。本研究结果提示,HAE边缘带MMP-2 的高表达可能使细胞外基质降解加速,破坏基底膜并可能促进HAE新生血管的形成,进而促使HAE的浸润转移。
CD34是高度糖基化的Ⅰ型跨膜蛋白,研究表明,CD34不仅具有造血作用,还可以通过促进内皮细胞转移进而促进血管新生[10]。本研究中CD34阳性表达率在HAE边缘带组织高于正常肝组织(P<0.01),有转移灶边缘带表达高于无转移灶边缘带(P<0.05)。张示杰等[11]报道,在早期沙鼠肝泡球蚴组织中存在CD34高表达的现象。姚冰等[12]研究报道,对HAE边缘区域CT灌注成像并与组织病理对照发现,HAE病灶与周围肝组织间存在边缘浸润带,该区域血流灌注高于病灶内部及周围肝脏组织。宋涛等[13]报道,HAE病灶周边存在着一边框样的增强带,结合超声造影剂的增强原理,此边框样的增强带代表了HAE病灶的边缘区存在着较为丰富的微血供状态。以上结论支持了本研究的结果。上述结果提示,CD34的高表达可能促使HAE新生血管形成,这说明血管生成可能是HAE浸润性生长的机制之一。
本研究经双变量相关分析显示,MMP-2和CD34表达呈正相关性(r=0.442,P<0.01),表明MMP-2与CD34表达可能有一致性和协同作用,共同促进HAE病灶新生血管形成和浸润转移。有研究表明癌细胞可以通过自身分泌或旁分泌等方式合成大量的MMP-2,破坏基底膜的完整性,发生侵袭和转移[14]。VUITTON等[15]提到“多房泡球绦虫幼虫自身所分泌的类细胞因子物质可能促进其周围肉芽肿内血管生成”。血管新生是一个复杂过程,任何组织血管生成都不会是单一因素作用的结果,另外是否还有其他促转移因子等的作用,还需进一步研究[8-9,16]。
综上所述,在HAE边缘带组织中存在MMP-2和CD34高表达,表明HAE病灶组织中存在血管新生迹象,初步说明血管新生可能参与了HAE在宿主体内的侵袭转移过程,而且MMP-2可能促使HAE组织血管新生。由于HAE的生长方式与肿瘤类似,人们借助肿瘤的浸润转移机制来研究HAE的发病机制,希望通过对HAE血管生成、浸润转移机制的研究能找到阻止其对宿主损伤的途径,帮助临床上开发新药、寻找新的治疗方法以达到治疗包虫病的目的。
