刺山柑总生物碱对系统性硬皮病小鼠皮肤纤维化相关指标的影响*
2018-08-29康小龙何承辉
康小龙,何承辉,卢 军,刘 晶
(1.新疆医科大学附属中医医院药研室,乌鲁木齐 830000;2.新疆维吾尔自治区药物研究所药剂室,乌鲁木齐 830004)
系统性硬皮病(systemic sclerosis,SSc)是一种结缔组织疾病,表现为过量胶原在皮肤、肺、消化道等内脏器官沉积,以皮肤和内脏器官纤维化为特征[1-2]。刺山柑总生物碱系本课题组从新疆地产药材刺山柑中提取的有效部位,拟用于SSc的治疗。本实验观察了刺山柑总生物碱对SSc纤维化相关指标Ⅰ型胶原α1链(COL1A1)、纤维连接蛋白(Fn)、血管紧张素Ⅱ(Ang Ⅱ)和白细胞介素-1β(IL-1β)表达的调节作用。
1 材料与方法
1.1材料
1.1.1动物 体质量(22.1±1.9)g清洁级雌性BALB/c小鼠90只,购自新疆实验动物研究中心,合格证号:SCXK(新)2015-0027。
1.1.2药材与试剂 刺山柑药材(新疆麦迪森维药有限公司饮片厂);盐酸博莱霉素粉针剂(日本化药株式会社,批号:430312);青霉胺片(上海信谊药厂,批号:052130503);小鼠Fn ELISA试剂盒(上海润裕生物科技公司,批号:201601);小鼠IL-1β ELISA试剂盒(美国R&D公司,批号:201603);小鼠Ang Ⅱ ELISA试剂盒(上海江莱生物科技公司,批号:201602);二辛可宁酸蛋白定量试剂盒(江苏碧云天生物技术研究所,批号:20160320);COL1A1抗体,β-actin抗体,HRP标记兔抗山羊IgG购自美国Santa Cruz公司;HRP标记山羊抗兔IgG购自美国Cell Signaling公司。
1.1.3主要仪器 酶标仪、低温离心机(美国Thermo Fisher公司);Western blot设备(美国Biorad公司)。
1.2方法
1.2.1SSc模型的建立及给药方法 BALB/c小鼠采用随机数字表法分为对照组、模型组、刺山柑总生物碱低(225 mg/kg)、中(450 mg/kg)、高(900 mg/kg)剂量组及阳性药青霉胺(125 mg/kg)组,每组15只,博莱霉素皮下注射法建立SSc模型[3-4]:将小鼠背部中央区被毛剃除,盐酸博莱霉素粉针剂用生理盐水配成浓度为300 μg/mL的药液,除对照组背部皮下注射生理盐水外,其余各组注射博莱霉素,30 μg/d,注射4周后,刺山柑总生物碱各剂量组小鼠注射部位外敷刺山柑总生物碱乳膏,青霉胺组给予青霉胺灌胃,对照组、模型组背部外敷不含药乳膏基质,每天1次,给药8周。
1.2.2小鼠皮肤COL1A1表达检测 给药8周后,取小鼠背部皮肤,加入预冷的RIPA裂解液,组织匀浆机研磨成组织匀浆,浓度为10%,冰浴裂解30 min,12 000 r/min离心10 min,吸取上清液,二辛可宁酸试剂盒定量上清液中蛋白水平,调整每孔上样量,使每个加样孔中总蛋白量相同,样品与上样缓冲液混合,95 ℃水浴中10 min变性蛋白,上样后进行聚丙烯酰胺凝胶电泳,电转移至PVDF膜上,5%的脱脂奶粉室温封闭2 h,Tris-HCl-Tween洗膜后,加入COL1A1一抗(按1∶1 000稀释),4 ℃孵育过夜,二抗室温孵育1 h,ECL发光剂显影,以β-actin做为内参,Image J软件扫描条带灰度,比较蛋白相对表达量。
1.2.3小鼠皮肤Fn表达检测 给药8周后,取小鼠背部皮肤,加入生理盐水,组织匀浆机研磨成组织匀浆,浓度为10%,4 000 r/min离心10 min后提取上清液。上清液中Fn水平采用ELISA试剂盒测定,按试剂盒说明书进行操作,同时用二辛可宁酸蛋白定量试剂盒检测上清液中总蛋白浓度,以每毫升上清液中总蛋白水平校正ELISA结果(pg/mg)。
1.2.4小鼠血清Ang Ⅱ和IL-1β水平检测 给药8周后,取血分离血清,Ang Ⅱ和IL-1β水平按ELISA试剂盒说明书进行测定。

2 结 果
2.1各组小鼠皮肤组织COL1A1表达水平 与对照组比较,模型组皮肤组织COL1A1表达增高(P<0.01);与模型组比较,刺山柑总生物碱中、高剂量及阳性药青霉胺可降低COL1A1表达(P<0.01),见图1。

A:Western blot检测小鼠皮肤COL1A1蛋白水平;B:COL1A1灰度分析;a:P<0.01,与对照组比较;b:P<0.01,与模型组比较
图1各组小鼠皮肤Ⅰ型胶原α1链(COL1A1)蛋白水平比较
2.2各组小鼠皮肤Fn表达水平 模型组小鼠皮肤组织Fn表达明显高于对照组(P<0.01);刺山柑总生物碱高剂量组和青霉胺组小鼠Fn水平显著下降(P<0.05或P<0.01);刺山柑总生物碱高剂量组与青霉胺组比较差异无统计学意义(P>0.05),见表1。
2.3各组小鼠血清Ang Ⅱ水平 模型组小鼠血清Ang Ⅱ水平明显高于对照组(P<0.01);刺山柑总生物碱高剂量组小鼠血清Ang Ⅱ水平较模型组明显降低(P<0.05),见表2。
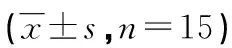
表1 各组小鼠皮肤Fn水平比较
a:P<0.01,与对照组比较;b:P<0.05,c:P<0.01,与模型组比较
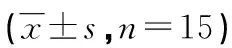
表2 各组小鼠血清Ang Ⅱ水平比较
a:P<0.01,与对照组比较;b:P<0.05,与模型组比较
2.4各组小鼠血清IL-1β水平 模型组小鼠血清IL-1β水平明显高于对照组(P<0.01);各给药组与模型组比较差异无统计学意义(P>0.05),见表3。
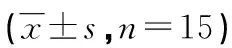
表3 各组小鼠血清IL-1β水平比较
a:P<0.01,与对照组比较
3 讨 论
SSc是一种表现为多组织炎症和纤维化的慢性自身免疫性疾病,目前认为SSc病因是由于过度活化的成纤维细胞(Fb)合成胶原、Fn和糖胺聚糖等增多,细胞外基质(ECM)沉积,引发组织纤维化[5-6]。Ⅰ、Ⅲ型前胶原主要由Fb合成,SScⅠ型前胶原合成较正常Fb升高,提示SSc以Ⅰ型前胶原增多为主[7-8]。将硬皮病Fb培养至第15代,其胶原合成量仍高于正常Fb,活化的Fb过量表达Ⅰ型前胶原,后者客观反映了硬皮病的纤维化程度[9]。本实验中,SSc模型组小鼠皮肤组织COL1A1和Fn表达显著增高,刺山柑总生物碱中、高剂量可明显降低COL1A1和Fn表达;本课题组已经证实:刺山柑总生物碱可使SSc小鼠真皮厚度变薄[10],病理结果亦表明SSc小鼠皮肤和肺部炎症和纤维化得到明显改善[11],提示刺山柑总生物碱可能通过抑制SSc纤维化形成过程中胶原合成及Fn表达,减少ECM沉积,改善SSc组织纤维化。
研究表明:SSc患者血清及皮损中Ang Ⅱ水平升高,体外培养的SSc患者真皮Fb中Ang Ⅱ表达上调,血管紧张素原的合成增加,皮肤及肺Fb血管紧张素受体1(AT1)和AT2受体表达上调。Ang Ⅱ与AT1结合后可诱导Fb合成转化生长因子-β,刺激α-平滑肌肌动蛋白在Fb中表达增高,胶原及Fn等ECM成分过度合成,促使胶原基质收缩及组织纤维化形成,因此认为Ang Ⅱ异常表达可促进SSc组织纤维化的形成[12]。本研究中,模型组小鼠血清Ang Ⅱ水平升高,刺山柑总生物碱高剂量可降低SSc小鼠Ang Ⅱ水平,提示刺山柑总生物碱可能通过降低Ang Ⅱ水平,抑制SSc纤维化形成。
自身免疫功能紊乱和炎性反应是SSc的病程初期的表现,导致细胞因子网络调节失衡,许多促炎因子如IL-1β、肿瘤坏死因子-α(TNF-α)等分泌增加,一方面,Fb被这些促炎因子激活后合成ECM增加;另一方面血管内皮细胞受损后释放促炎因子,后者激活Fb,最终造成小血管纤维化和组织炎性反应[13]。因此,抑制IL-1β、TNF-α等炎症相关因子的合成、分泌,阻断炎症信号转导通路可能在SSc早期阶段具有重要的治疗前景。本研究在对各组小鼠血清IL-1β水平检测后表明模型组IL-1β水平明显增高,提示IL-1β可能参与了SSc的形成,各受试药组与模型组比较IL-1β水平差异没有显著性意义,提示刺山柑总生物碱可能不能降低升高的SSc IL-1β水平。
本研究表明刺山柑总生物碱可能通过降低Ang Ⅱ水平,抑制SSc纤维化形成过程中胶原合成及Fn表达,减少ECM沉积,改善SSc组织纤维化,但刺山柑总生物碱如何降低Ang Ⅱ水平及Ang Ⅱ水平降低后如何调控下游信号通路的传导,从而抑制胶原合成及Fn表达等问题目前还不清楚,将成为本课题组今后研究的方向。
