EGCG对人肺癌细胞NCI-H1975和NCI-H520细胞增殖及凋亡的影响*
2018-08-29李承红孟庆华王小江
黄 洁,李承红,孟庆华,王小江,陈 实,石 奕
(江汉大学附属医院/武汉市第六医院呼吸内科 430016)
非小细胞肺癌(NSCLC)是临床生存率远不足10%的以肺腺癌细胞和肺鳞状上皮癌细胞的增殖异常为主要特征的癌症[1-3]。表皮生长因子受体(EGFR)突变NSCLC病患常表现为常规治疗药物的耐药和低效[4]。因此,寻找新型药物迫在眉睫。EGFR是调控细胞生长参与癌症病程的酪氨酸激酶受体[5-7]。且EGFR(Tyr845)/ERK/AKT信号通路参与增殖等多细胞应答[8-10]。表没食子儿茶素没食子酸酯(EGCG)是绿茶中具有抗菌、增强免疫力和抗肿瘤活性的儿茶素[11-12]。且EGCG可增强癌细胞对化疗的敏感性[13-15]。然而,在EGCG对NSCLC治疗没有详细的研究基础。本研究利用公认的NSCLC的肺腺癌和肺鳞状上皮癌细胞系,对EGCG的体外抗NSCLC作用进行探索性研究,分析其对肿瘤细胞增殖、凋亡的影响及其可能的作用机制。
1 材料与方法
1.1材料与试剂 EGCG购于美国Sigma公司,胎牛血清(FBS)RPMI 1640和Opti-MEM培养基购于美国Gibco公司,NCI-H1975和NCI-H520细胞系购于美国模式培养物保藏所(American Type Culture Collection,ATCC)。脂质体LipofectamineTM3000、cDNA 合成试剂盒购于美国Thermo 公司,蛋白酶抑制剂cocktail、磷酸化酶抑制剂、RIPA裂解、Cell Counting Kit-8(CCK-8)试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂、RNase A购自碧云天生物有限公司),抗CyclinD1、CyclinE、CDK4、CDK6购自美国Cell Signaling Technology公司,cleaver-caspase 3、cleaver-caspase 9、Bax、Bcl2购自武汉proteintech 公司,p65、phospho-p65、EGFR、phospho-EGFR(Tyr845)、phospho-AKT(Ser473)、AKT、phospho-ERK、ERK购自于武汉Abclonal公司。EGFR siRNA由广州锐博生物设计合成(EGFR siRNA序列:CAC AGU GGA GCG AAU UCC U,Control siRNA序列:GGA CUU GGA UGA AG AAA UC),其他试剂均为分析纯。
1.2方法
1.2.1细胞培养及siRNA转染 NCI-H1975和NCI-H520细胞以10% FBS的RPMI 1640培养基在5% CO2,37 ℃条件下培养传代。细胞经消化计数后,以2×104个/孔的数量接种到12孔培养板中,37 ℃ 5% CO2培养6 h。实验分为Control siRNA组、EGFR siRNA组和EGFR siRNA+EGCG组。依照脂质体LipofectamineTM3000使用说明书,各孔加入相应Control siRNA 50 ng/μL、EGFR siRNA 50 ng/μL和EGFR siRNA 50 ng/μL+EGCG 20 μmol/L后孵育24 h,收集细胞做蛋白质印迹检测。
1.2.2CCK-8比色法检测细胞增殖 细胞增殖实验采用CCK-8比色法检测,参照CCK-8试剂盒说明书,细胞经消化计数后,以2×103个/孔接种到96孔培养板中,37 ℃ 5% CO2培养6 h后,更换2% FBS培养基培养6 h同步化,依次加入0、20、40、80、160、320 μmol/L EGCG处理24、48、72 h的EGCG组。每孔加入10 L的CCK-8溶液,混匀后培养2 h后于450 nm处检测各孔光密度(A)值,绘制细胞增殖统计图,同时以2×104个/孔接种到24孔培养板中,经相同处理后收集细胞做蛋白质印迹检测和q-PCR检测。
1.2.3Annexin V/PI双染色法流式细胞仪检测凋亡 对数生长期的细胞经消化计数后,1×105个/孔的数量接种到6孔培养板中,37℃ 5% CO2培养6 h后,更换2% FBS培养基培养6 h同步化,依次加入0、20、40、80、160、320 μmol/L EGCG处理24 h的EGCG组。每孔细胞以乙二胺四乙酸(EDTA)消化液消化收集细胞,冷PBS漂洗2次,依照Annexin V/PI细胞凋亡检测试剂说明操作。采用FACS Calibur型流式细胞仪检测细胞周期。
1.2.4流式细胞术检测细胞周期 对数生长期的细胞经消化计数后,1×105个/孔的数量接种到6孔培养板中,按照“1.2.1”实验方法处理。每孔细胞以EDTA消化液消化收集细胞,加入75%冷乙醇后4 ℃固定过夜,冷PBS漂洗两次,加入300 μL PBS,10 mg/mL RNase A溶液15 L混匀后,37 ℃孵育30 min,加入1 mg/mL 碘化丙啶(PI)染料溶液混匀后,闭光孵育30 min,PBS漂洗2次,加入200 μL PBS重悬细胞。采用FACS Calibur型流式细胞仪检测细胞周期。
1.2.5蛋白质印迹法检测EGFR及相关蛋白的表达 EGCG和EGFR siRNA处理后的NCI-H1975和NCI-H520细胞用细胞总蛋白提取、BCA蛋白浓度监测方法收集细胞裂解上清。加入5×loading buffer于95 ℃干热变性10 min。制作4%的浓缩胶和12%的分离胶,电泳后湿法转膜2 h至聚偏二氟乙烯膜(PVDF),然后使用含5%脱脂奶粉的TBST溶液室温封闭2 h,AKT、CyclinD1、CyclinE、CDK4、CDK6、Bax、Bcl2、P65和EGFR、ERK抗体按1∶1 000比例稀释,cleaver-caspase 3、cleaver-caspase 9、phospho-p65、phospho-EGFR、phospho-AKT、phospho-ERK抗体按1∶800比例稀释,内参b-actin抗体按1∶5 000比例稀释,4 ℃摇床孵育16 h后,TBST漂洗后孵育相应种属的辣根过氧化物酶(HRP)标记的二抗,按1:8 000比例稀释,室温轻摇孵育2 h,采用ECL法显影。

2 结 果
2.1EGCG诱导NCI-H520和NCI-H1975细胞凋亡 EGCG在不同剂量和作用时间上明显诱导NCI-H520和NCI-H1975细胞凋亡(P<0.05),但是,相同浓度的EGCG作用NCI-H520和NCI-H1975细胞24 h与作用48、72 h相比,凋亡率相当,不同浓度的EGCG作用(0、20、40、80、160、320 μmol/L)NCI-H520和NCI-H1975细胞相同时间(24、48、72 h)相比,差异均无统计学意义(P>0.05),见图1。

图1 EGCG抑制NCI-H520和NCI-H1975细胞凋亡
2.2EGCG抑制细胞周期及其相关蛋白的表达 与0 μmol/L EGCG组比,20、40、80、160、320 μmol/L的EGCG组NCI-H520和NCI-H1975细胞G1/G0期细胞比率明显增加,G1/S明显减少,G2/M起没有明显的变化。蛋白质印迹法检测结果发现,EGCG作用NCI-H520和NCI-H1975细胞24 h可以明显抑制Cyclin D1、Cyclin E和CDK4/6的表达,并且随着浓度增大蛋白水平逐渐降低,见图2。
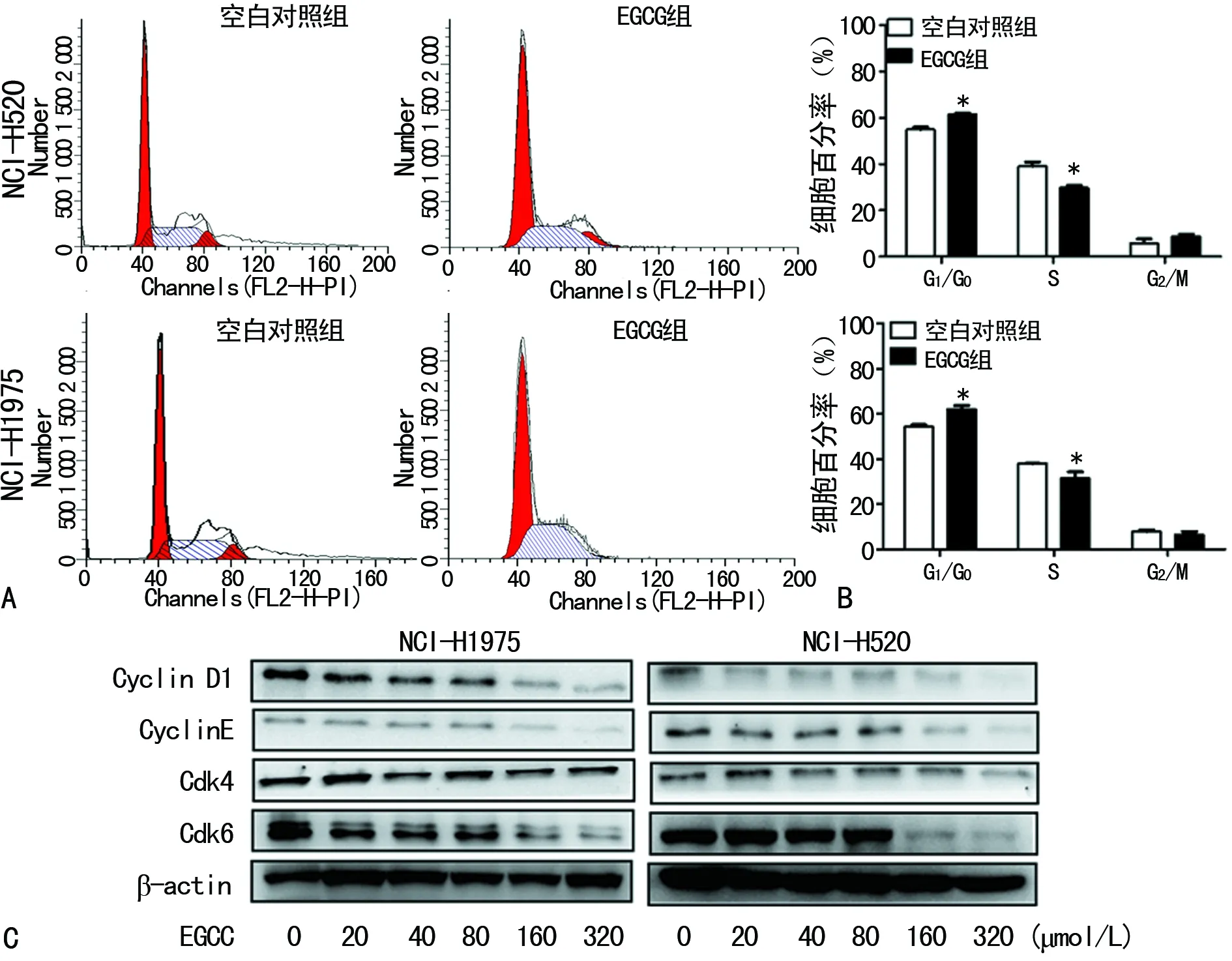
A:流式细胞术检测细胞周期;B:NCI-H520和NCI-H1975细胞周期G1/G0、S和G2/M期统计分析;C:Western blot检测蛋白水平;*:P<0.05,与空白对照组比较
图2 EGCG抑制细胞周期相关蛋白的表达
2.3EGCG对NCI-H520和NCI-H1975细胞凋亡的影响 与0 μmol/L EGCG组比,以20、40、80、160、320 μmol/L的EGCG处理NCI-H520和NCI-H1975细胞24 h明显增加凋亡细胞的数量。蛋白免疫印迹实验证实,EGCG明显升高NCI-H520和NCI-H1975细胞的cleaved-caspase 3和cleaved-caspase 9蛋白水平,且呈现剂量依赖性增加,见图3。

A:流式细胞术检测细胞凋亡;B:Western blot检测蛋白水平
图3 EGCG诱导NCI-H520和NCI-H1975细胞
凋亡及相关蛋白表达
2.4EGCG对NCI-H520和NCI-H1975细胞NF-kB/Bcl2信号通路的影响 phospho-p65和Bcl2在EGCG组明显降低,Bax水平明显增加,且均呈现剂量依赖性。EGCG通过下调phospho-p65和下游Bcl2蛋白表达诱导NCI-H520和NCI-H1975细胞凋亡,见图4。
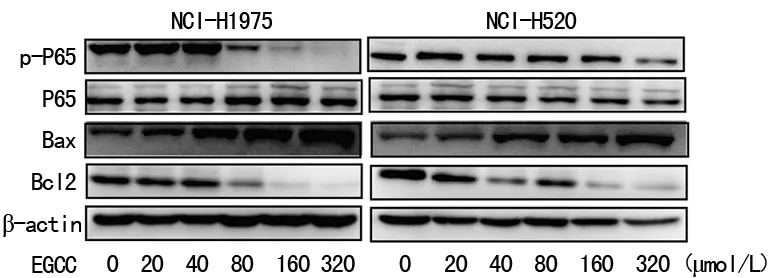
图4 EGCG对NCI-H520和NCI-H1975细胞NF-κB/Bcl-2的影响
2.5EGCG对NCI-H520和NCI-H1975细胞EGFR/ERK/AKT信号通路的影响 本研究实验结果证明,EGCG抑制EGFR蛋白Tyr845位点磷酸化,同时下调下游因子phospho-AKT,但phospho-ERK没有明显的变化,见图5。

图5 EGCG调节NCI-H520和NCI-H1975细胞EGFR/ERK/AKT信号通路
2.6下调EGFR促进EGCG对NCI-H520和NCI-H1975细胞凋亡诱导效应 与Control siRNA组相比,EGFR siRNA组EGFR蛋白明显降低(P<0.05)。同时,EGFR siRNA抑制EGFR蛋白Tyr845位点磷酸化表达后,下游因子phospho-ERK和phospho-AKT亦明显下调,见图6。与EGFR siRNA组比较,EGCG siRNA+EGFR组中EGFR(Tyr845)蛋白的表达明显更低(P<0.05),同时,下游phospho-ERK和phospho-AKT亦明显下调(P<0.05)。
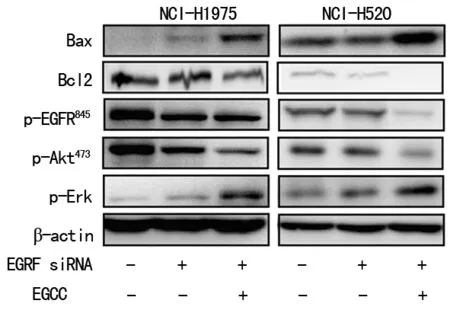
图6 下调EGFR促进EGCG对NCI-H520和NCI-H1975细胞凋亡诱导效应
3 讨 论
肿瘤细胞增殖与凋亡的发生、发展涉及多种癌基因和抑癌基因表达或功能失常[16]。研究报道:EGFR作为增殖和凋亡调节型受体蛋白,参与多种肿瘤的增殖与凋亡的多个环节[17-18]。它能降低多种肿瘤细胞的迁移,同时抑制细胞增殖[19]。临床研究发现,肺癌越重,EGFR蛋白表达越高[20]。然而,EGFR的突变与临床药物的敏感性降低有关,这说明EGFR在肺癌的发生于发展中具有重要作用[19,21]。同时有报道称,EGCG可以通过调节EGFR的表达影响顺铂等药物对肿瘤的敏感性。因此,EGCG可能成为新型的治疗肿瘤与改善肿瘤耐受性的药物。
本研究中,借助公认的人肺腺癌细胞NCI-H1975细胞和人肺鳞状上皮癌细胞NCI-H520细胞,EGCG明显抑制NCI-H1975和NCI-H520细胞的增殖,且具有剂量依赖性和时间依赖性。而且,EGCG明显升高NCI-H520和NCI-H1975细胞G1/G0期细胞比率,降低G1/S细胞比率,同时,EGCG明显抑制cyclinD1、cyclinE、CDK4/6的表达,继而影响细胞的增殖。再者,Annexin V/IP染色法表明:EGCG促进NCI-H520和NCI-H1975凋亡,并且与升高cleaved-caspase 3和cleaved-caspase 9蛋白有关。
EGFR/AKT/ERK信号通路和NF-kB/Bcl2信号通路是细胞内重要的参与细胞增殖、凋亡的信号转导途径。本研究中EGCG明显下调EGFR/AKT/ERK和NF-kB/Bcl2信号通路相关蛋白。因此,EGCG的抑制NCI-H1975和NCI-H520细胞增殖效应可能与此两条信号通路有关,并且在EGFR siRNA转染后,相比于只用EGFR siRNA转染的细胞,EGCG可以更加明显的抑制EGFR/AKT/ERK和NF-kB/Bcl2信号通路相关蛋白。由此可知,下调EGFR促进EGCG对NCI-H520和NCI-H1975细胞凋亡诱导效应。
综上所述,EGCG可以通过下调EGFR/AKT/ERK和NF-kB/Bcl2信号通路促进NCI-H520和NCI-H1975细胞凋亡,并抑制细胞增殖。
