G-CSF增加三氧化二砷对骨髓增生异常综合征细胞系SKM-1的细胞毒作用
2018-08-29雷美清罗贤生王智明孙令凤杨晓阳陈晓霞
雷美清,罗贤生,王智明,孙令凤,杨晓阳,余 锋,陈晓霞
(中南大学湘雅医学院附属海口市人民医院血液科 570208)
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一种异质性很强的造血干细胞水平的恶性肿瘤,它属于髓系恶性肿瘤的一个分支[1]。其临床特征有无效造血所致的血细胞减少,高风险向急性白血病转化。MDS 发病率呈逐年上升趋势。由于绝大多数患者发病年龄较大,因此传统化疗方案和异基因造血干细胞移植并非广泛适用[2]。早期临床研究报道了三氧化二砷(As2O3)可以明显改善MDS患者的血液学反应[3],鉴于单纯使用As2O3治疗的浓度偏高,不良反应大,易形成耐药性。一些以As2O3为基础的联合治疗用于MDS的尝试也在不断地探索中[4-6]。事实上,大多数化疗药主要杀灭处于增殖期白血病细胞。最近有文献报道重组人粒细胞集落刺激因子(G-CSF)能动员休眠期的白血病干细胞进入细胞周期,从而增加它们对化疗药物的敏感性。事实上,As2O3皆有诱导肿瘤细胞进入周期和诱导肿瘤细胞凋亡的作用,但其具体作用机制未明[7-8]。由此推测G-CSF联合As2O3可能对MDS细胞有一定的协同效应。本研究以难治性贫血伴有原始细胞增多类型(MDS-RAEB)的细胞系SKM-1细胞为研究对象,比较As2O3联合或不联合G-CSF对SKM-1细胞的抑制增殖和诱导凋亡作用及其可能的机制,现报道如下。

A:各组细胞周期的分布,B:各组对应的S期细胞比例;a:P<0.05;b:P<0.01
图1不同浓度G-CSF作用48 h对SKM-1细胞周期的影响
1 材料与方法
1.1细胞株 SKM-1属于MDS-RAEB型细胞株,由江苏省血液研究所保存。细胞用含10%胎牛血清的RPMI 1640培养液培养,培养基在37 ℃、5% CO2饱和湿度孵育箱内培养,每2至3天传代1次,取对数生长期细胞进行药物干预实验。
1.2药物和试剂 G-CSF(150 μg/支)购自齐鲁制药有限公司,用PBS配制成浓度为10、20、40 ng/mL。注射用As2O3购自北京双鹭药业股份有限公司,先用PBS配制药物浓度5×103μmol/L(母液),使用前再稀释至所需As2O3浓度(2.5、5.0、10.0 μmol/L)。RPMI 1640培养液、胎牛血清购自HyClone公司。
1.3方法
1.3.1细胞周期分析 取对数生长期的SKM-1细胞,调整细胞密度至2×105/mL,置于48孔培养板(每孔1 mL),分别加入不同浓度的G-CSF(10、20、40 ng/mL)为预处理实验组,以不加G-CSF为空白对照组,作用48 h后收集细胞,PBS洗涤1次后70%乙醇固定过夜。参考细胞周期与细胞凋亡检测试剂盒说明书处理细胞,用FC500流式细胞仪检测。采用MultiCycle软件分析细胞周期。实验重复3次。
1.3.2CCK-8法检测细胞增殖抑制率 取对数生长期的SKM-1细胞,调整细胞密度至2×105/mL后接种于96孔培养板(每孔90 μL),分为实验组、对照组、空白组,实验组采用20 ng/mL G-CSF预处理24 h,以不加G-CSF为对照组,对照组和实验组分别加入不同浓度的As2O3(2.5、5.0、10.0 μmol/L)10 μ L,空白组(仅有SKM-1细胞)加等体积的RPMI 1640培养液,继续培养48 h后,每孔加入10 μL CCK-8试剂,于37 ℃、5%CO2孵育箱内培养3 h,用酶标仪检测450 nm波长处吸光度(A)值。每组设3个平行孔,实验重复3次,并按下列公式计算As2O3对细胞增殖抑制率=(对照孔-实验孔)/(对照孔-空白孔)×100%。
1.3.3细胞凋亡的检测 细胞处理方法类似于细胞增殖实验,实验孔和对照孔在加入不同浓度As2O3作用48 h后,用PBS洗涤2次,按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作,进行流式细胞检测。总凋亡率=早期凋亡率(右下象限)+晚期凋亡率(右上象限)。

2 结 果
2.1细胞周期分析 不同浓度G-CSF分别作用于SKM-1细胞株48 h,S期细胞比例呈现随G-CSF浓度增加而升高的趋势;尽管S期比例在10 ng/mL G-CSF预处理实验组与空白对照组之间的差异无统计学意义,但是20、40 ng/mL G-CSF预处理实验组与空白对照组相比,S期细胞比例差异均有统计学意义(P<0.05),见图1。选择20 ng/mL G-CSF预处理作为联合As2O3实验的基础。
2.2不同浓度As2O3和G-CSF联合对SKM-1细胞增殖抑制作用 采用CCK-8法测定不同浓度As2O3作用48 h后SKM-1细胞增殖抑制率,结果显示2.5、5.0、10.0 μmol/L As2O3实验组细胞增殖抑制率均显著高于对照组(P<0.05),见图2。
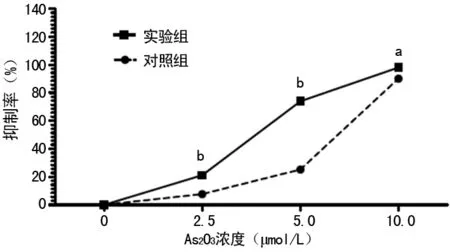
a:P<0.05;b:P<0.01
图2各组组对SKM-1细胞增殖作用比较
2.3G-CSF联合不同浓度As2O3对SKM-1细胞凋亡的影响 2.5、5.0、10.0 μmol/L As2O3对照组细胞凋亡率分别为3.22%、9.33%、39.22%,对应浓度的实验组细胞凋亡率分别为17.67%、46.09%、65.51%;同一浓度As2O3的实验组细胞凋亡率均显著高于对照组(P<0.05),见图3。
A:空白组,2.5、5.0、10.0 μmol/L As2O3浓度对照组(上排)和实验组(下排)的细胞凋亡图;B:各组对应的凋亡的比例;a:P<0.05
图3各组对SKM-1细胞凋亡作用的影响
3 讨 论
MDS的发病机制目前尚未被阐明,可能与分子遗传、造血微环境改变、造血干/祖细胞增殖和凋亡紊乱及抑癌基因甲基化等多因素有关[9]。研究发现细胞凋亡及增殖的失调被认为是MDS 发病机制中重要组成部分,到晚期则以异常克隆增殖为主,骨髓造血以高增殖低凋亡为主要表现[10]。作为治疗急性早幼粒细胞白血病的经典药物As2O3,低浓度As2O3(0.1~0.5 μmol/L)只引起细胞分化,继续增加浓度则发挥诱导细胞凋亡作用[11]。由于As2O3在细胞内代谢时既消耗了甲基化所需的原料同时又降低了甲基化转移酶的数量和活性,有可能也发挥着去甲基化作用。因此,基于As2O3单药或者As2O3联合其他药用于MDS的治疗应运而生,有研究表明:G-CSF可以增强低浓度As2O3对APL细胞系的诱导分化作用[12]。为进一步探讨G-CSF与As2O3在MDS细胞株SKM-1中是否也具有协同效应,因此本实验选择2.5~10.0 μmol/L As2O3为作用于SKM-1细胞的药物浓度,从而为临床上治疗MDS提供新的思路和方法。
在细胞周期实验中,本研究采用FCM检测G-CSF作用SKM-1细胞后周期的变化,与对照组相比。结果显示,G-CSF作用48 h显示S期细胞的比例明显增高,并随着药物浓度的增加这种作用会越来越明显,对照组和实验组之间差异具有统计学意义(P<0.05)。值得注意的是以往的文献报道G-CSF诱导白血病细胞S期比例增加时,G0/G1期比例减少[13],而本研究的结果提示G-CSF动员S期比例增多时,G2/M期比例减少,这可能与细胞株和作用时间不同等因素有关。而G-CSF与As2O3两者联合作用的结果又将如何? 与对照组相比,实验组对SKM-1的增殖抑制率和诱导凋亡率明显高于对照组,并呈浓度依赖性,同一浓度的实验组和对照组比较差异有统计学意义(P<0.05)。尽管As2O3对肿瘤细胞有诱导分化和凋亡的双重作用。而本研究采用As2O3属于高浓度范围,所以本实验的流式检测范围主要针对其对SKM-1的诱导凋亡作用,而未进行分化指标的相关检测。本研究的As2O3单药诱导的凋亡作用类似于以往用As2O3单药作用SKM-1的研究[14],并且,在同一浓度As2O3作用下,联合20 ng/mL的G-CSF所产生的抑制增殖和诱导凋亡作用均较单独使用同浓度As2O3明显增强(P<0.05)。由此推断,G-CSF联合As2O3可能是通过招募静息期的白血病细胞进入S期,从而增加SKM-1细胞对As2O3治疗的敏感性。
临床上,G-CSF或者As2O3在MDS患者中的应用具有较好的耐受性。由于MDS疾病具有极大的异质性,包括MDS的不同分型白血病细胞表达G-CSF受体存在差异[15],因此,本实验的结果还需要在MDS的不同细胞株中进行验证。此外,临床上关于预激的时间不完全统一,在本实验中,尽管G-CSF对SKM-1细胞的S期转化的最佳时间是48 h, 考虑到后续G-CSF和As2O3共同作用的时间还有48 h,所以本实验选择G-CSF预激作用24 h的基础上加As2O3继续作用48 h,这样的序贯加药的时间与以往文献报道的预激方案相似[16]。最后,本实验只涉及As2O3联合G-CSF对SKM-1对增殖和凋亡的影响,其实As2O3本身也影响白血病干细胞的细胞周期[8],而且相互作用的分子和信号通路尚不明确。所以关于G-CSF和As2O3对SKM-1的协同作用还需要在体外实验和临床应用中进一步探讨[17]。
综上所述,20 ng/mL的G-CSF可以增强高浓度As2O3对MDS细胞系SKM-1的诱导凋亡作用。机制可能与G-CSF转化细胞周期有关,提高白血病细胞对As2O3抑制增殖和诱导凋亡的敏感性。当然,这还需要进一步研究加以证实。同时,这也是中药现代化的重要内容,具有重要的理论意义和潜在的临床应用价值。
