组氨酸对DNA电荷逆转和凝聚的影响
2018-08-28芦洁坪王艳伟杨光参
芦洁坪,王艳伟,杨光参
(温州大学数理与电子信息工程学院,浙江 温州 325035)
DNA作为生命遗传信息的携带者和传递者,是许多药品的关键作用靶点[1]。研究药品或者小分子配合物同DNA之类生物大分子之间的相互作用,是如今生命科学领域最重视的课题之一[2]。因为细胞中的DNA必须凝聚成特定结构装载到细胞核中,因此,了解DNA的凝聚并分析其形成的动力学机制,对了解DNA复制乃至生命的繁殖等过程都有十分重要的意义[3]。能够使DNA凝聚的药剂或者配合物有很多,例如各类多价离子、乙醇、中性聚合物、阳离子脂质体和一些蛋白质等,在其作用下DNA会凝聚成多种形态[4]。
DNA在良溶液中显示为自由伸展的形态,而其折叠聚集成紧密有序的形态的过程就被称为DNA的凝聚。从Manning平衡离子凝聚理论可知,平衡离子能中和DNA上的大部分电荷,但DNA上还有部分未被中和的电荷,DNA分子之间还存在着静电排斥力[5]。如何克服这个剩余静电排斥力,Wong等[6]提出了一种新的理论解释。他们认为,由于强的横向排斥效应,平衡离子在DNA表面形成了一种类似Wigner晶体结构的强关联流体结构,吸附在DNA表面的平衡离子屏蔽了DNA的电荷,从而使得DNA间的排斥力减小,当DNA之间的静电排斥力小于静电吸引力时,DNA发生凝聚。
对于DNA的电荷逆转,指的是带电物质表面的电荷被中和为电中性后又继续显示为与原先相反电荷的性质[7]。实际操作中,通常使用动态光散射设备来进行电荷逆转的观察。同时,溶液中平衡离子对于带电物质表面电荷补偿的情况也可以通过此种方法来进行讨论研究[8]。
本文以动态光散射(dynamic light scattering,DLS)和单分子原子力显微镜(atomic force microscope,AFM)为主要手段,详细地研究了不同浓度的组氨酸溶液中的DNA的电泳迁移率,以及在相应浓度下的DNA的凝聚现象,发现了组氨酸浓度的增加可以诱导DNA的电荷逆转。同时,随着组氨酸浓度的增加,DNA可以发生凝聚现象。
1 实验方法
1.1 动态光散射
DLS也称光子相关光谱(photon correlation spectroscopy,PCS),因为光照射到被测物质后会出现散射光,DLS就是通过观察散射光各项参数的变化来研究物质的大小和电位情况[9]。DLS仪器测量所用的实验药品制作比较简便,测量的时候不会影响到溶液中的样品本身的属性,所以可以对溶液中所测药品的动态变化进行实时监测,利用Malvern Zetasizer Nano-ZS90装置测量DNA-Histidine复合物尺寸和电位[10]。图1是该装置的测量示意图,入射激光是波长约为633 nm的He-Ne激光。
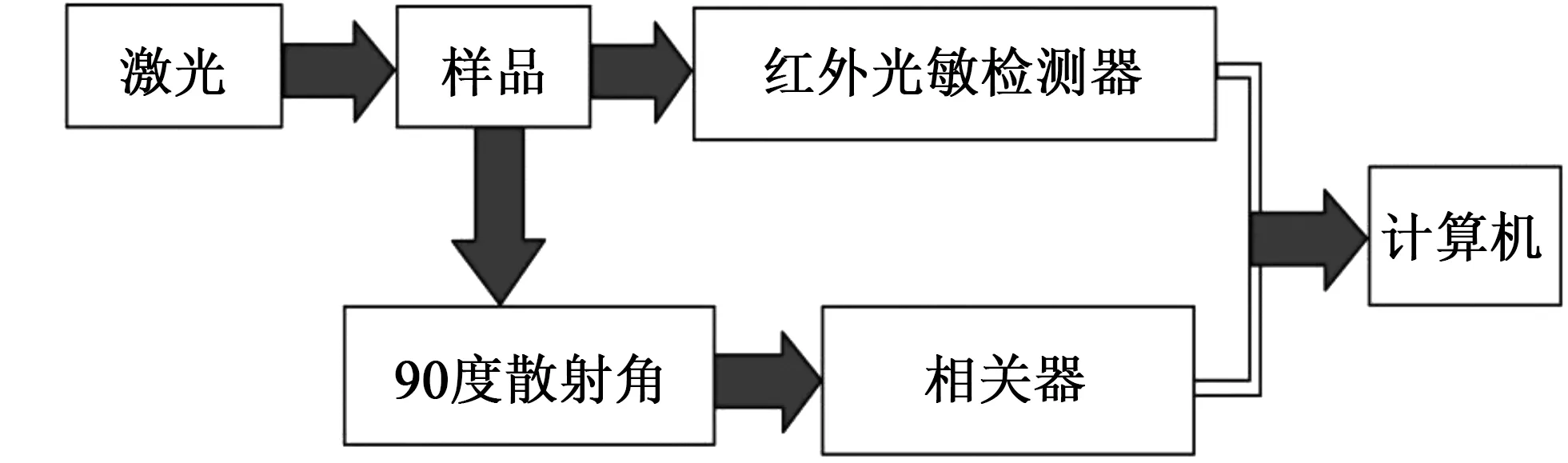
图1 动态光散射装置结构示意图Fig.1 The diagram of dynamic light scattering installment
DLS可测量样品的电泳迁移率,所谓的电泳意味着聚电解质在存在施加的电场的情况下沿与电荷相反的方向转移,同介质中的平衡离子作相对运动的现象。我们假设聚电解质所含电量大小为q,外加电场大小为E,在此影响下进行运动,则其所受的静电力大小为qE。当聚电解质在介质中运动的时候,还会受到摩擦力的作用,摩擦力的大小与聚电解质的迁移速度v成正比,运动方向则截然相反,即摩擦力是-f阻v,其中阻力系数为f阻。对于球型的聚电解质,按照Stokes定律
f阻=6πηr,
(1)
其中,r为半径,η为介质的粘度系数,则摩擦力为-6πηrv。当聚电解质在介质中匀速迁移时,静电力应与摩擦力的大小一致,即
qE=6πηrv。
(2)
根据静电学理论我们可以知道,对于球型的粒子,可以近似将其视为在其扩散层中所含有的电量q和切动面上所含有的电量-q构成一个共用同一圆心的电容器,ζ就是该电容器的电势,所以
(3)
其中,ε是介质的介电常数,k-1是扩散层的厚度。
当粒子的半径与扩散层的厚度比kr≤0.1时,式(3)可表示为
(4)
将上式代入(2)中可得
(5)
上式称为Hückel公式,其中μ是粒子的电泳迁移率。式(5)是用于得出kr<0.1的球型粒子的ζ电势。但是随着kr的增大,式(5)不再适用。Henry把外加电场和粒子双电层的电场整合到一起进行分析处理,从而得到了一个公式,相当于在式(5)的右侧乘以一个校正系数F(kr),使其变为
(6)
其中,F(kr)是kr的函数,称为Henry函数,当kr很小时,F(kr)趋近于1,此时,式(6)就退变为式(5)。然而当kr很大时,F(kr)趋近于1.5,此时式(6)变为
(7)
这个公式最先由Smoluchowski得到的,故称为Smoluchowski公式。
对于zeta电位的测量,目前可以利用的方法有很多,比如电泳法、流动电位法、电渗法等等。其中以电泳法的应用最为广泛。DLS技术就是通过电泳法来测量观察被测粒子的zeta电位,其原理为当一束激光通过衰减器进入样品池,由于在外加电场的作用下粒子开始进行定向运动,散射光的频率因此发生了一定程度的偏移,这样就形成了一个频率很小的调制光源,这束调制光源的频率为参考光和散射光的频率之差,该频率差Δf与被测粒子的运动速度有关:
Δf=2vsin (θ/2)/λ,
(8)
其中,v为被测粒子的运动速度,λ为入射激光的波长,θ为散射角。检测器通过检测光强随时间的波动的信息,从而得到拍频,然后通过拍频信息就可以得出被测粒子的速度,进而就可以知道所测量物质的电泳迁移率,再利用式(6)就能够得出被测物质的zeta电位。
1.2 原子力显微镜
AFM自被研发以来就在物理学、生物学、医学等各科研领域得到了广泛的应用。AFM的功能很广泛,不仅仅可以直观地得到DNA、蛋白质的形貌特征,而且还可以在一些高水准的实验中起到重要的作用,比如进行直观下的分子剪辑以及DNA特殊定位等。AFM具有成像清晰、分辨率高的优点,因此经常在操作单分子DNA等实验中得到应用。
AFM的工作过程是通过内部悬臂一端的极小针尖和被测样品之间极微弱的原子间作用力,得到取样品表面的形貌信息[11]。如图2所示,由二极管激光器发出的一束激光经过一系列光学器件,然后聚焦到镀有优良反射性质金属膜的探针的微悬臂背面,经过微型悬臂梁的反面反射到光点探测器的光电二极管结构上。当仪器进行扫描工作时,由于针尖与被测样品表面间的微弱作用力,使得微悬臂沿着被测药品表面进行起伏运动,然后反射光束也有微弱的位置偏移和强度变化,所以,可以通过检测器上光斑的位置变化,进行信号转换,最终得到所测药品表面的形态轮廓[12]。在这样的成像过程中,针尖与被测样品表面的距离始终保持在纳米级,从而这也要求有一个反馈回路来到达这样的效果。这个反馈回路就是通过检测针尖与云母片表面的互相作用大小,来控制加载样品扫描器上垂直方向的电压,进而控制它们之间的距离始终保持在纳米级。这个可以反馈的回路控制系统可以说是AFM核心机制之一。在软件操作中,主要依靠积分增益(IGain值)和比例增益(PGain值)以及参考电流这几个参数的设置来实现此反馈系统的控制。
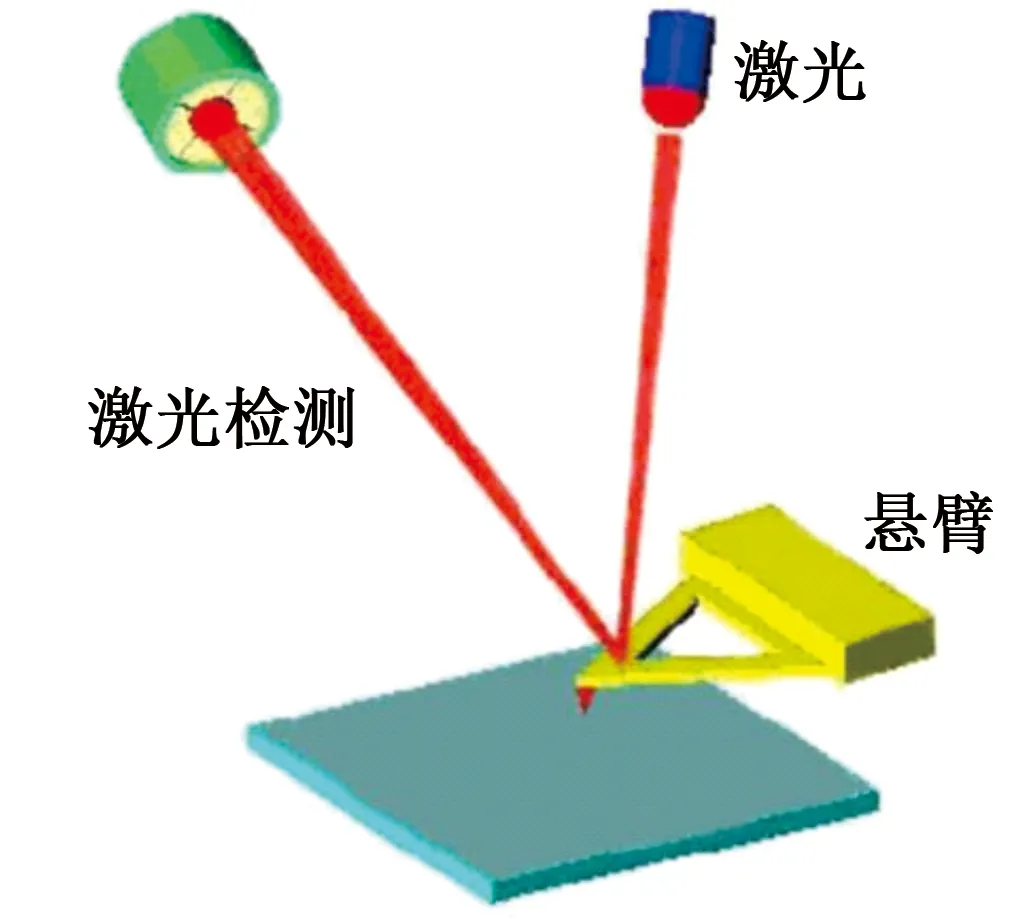
图2 激光检测原子力显微镜探针工作示意图Fig.2 Laser detection of AFM probe
本文所用到的NanoWizardⅢ AFM购于德国JPK,其内部设有自动机器人和一架控制装置,还有一个BioScience控温系统和NanoScience系统。小针头是NanoWorld的NCHR-50探针,其具体数据为悬臂长125 μm,宽度30 μm,厚度4 μm,弹性系数2 N/m,共振频率为320 kHz,镀有铝的硅探针。我们将准备的药品,放置在AFM平台上,保持室内温度为25 ℃,用AC mode进行图像扫描。扫描时选用的尺寸为5 μm ×5 μm,扫描线率为1.0 Hz。对于每块被测样品,我们都选择多处位置来扫描,这样可以降低因溶液不够平均造成的误差。最后扫描获得的图片像素为512×512,利用自带的4.2版本的JPK Data Processing软件对图片采取合适且相同的处理[13]。
2实验材料及样品制备
2.1 实验材料
2.1.1 λ-DNA
DNA上储存有大多数生物的遗传信息,大部分正常的DNA通常都是B型的右手双螺旋结构。λ-DNA就是这样一种标准的双螺旋分子,链长大概是48 kbp,研究者最开始就是用此DNA作为克隆的载体。本实验中用的λ-DNA购于New England Biolabs,原始浓度为0.5 μg/μL(10 mmol/L Tris-HCl,pH 8.0),储存在-20 ℃冰箱中待用[14]。
2.1.2 组氨酸简介
组氨酸是配位能力最强的氨基酸之一,分子结构如图3所示。在组氨酸残基中有一个咪唑环结构,我们可以看到里面有2个N原子,其中一个在pH范围6~ 7时实现去质子化[15]。当组氨酸是蛋白质结构中的一部分时,这个咪唑基就是其和一些过渡离子进行作用的主要靶点。本文中所用组氨酸(H8)购于上海强耀生物科技有限公司,配置纯度为95%。

图3 组氨酸分子结构图Fig.3 The Molecular structure of Histidine
2.1.3 溶液及其他实验材料
(1)缓冲液Tris(10 mmol/L,pH 8.0)。
(2)超纯水,取自Milli-Q系统(美国Millipore)。
(3)配置1 mmol/L的MgCl2·6H2O。
2.2 样品制备
2.2.1 DLS实验样品制备
DLS样品制备步骤如下:
(1)用10 mmol/L的Tris配置不同浓度的组氨酸液体1 000 μL于离心管内;
(2)用离心管中加入2μL λ-DNA,用手指轻弹,使之混合均匀后室温下培育10 min;
(3)最后用移液器将步骤(2)中的混合液体移出,转移到Zeta电位毛细管样品池(图4)中,然后放在动态光散射样品槽中进行实验[16]。
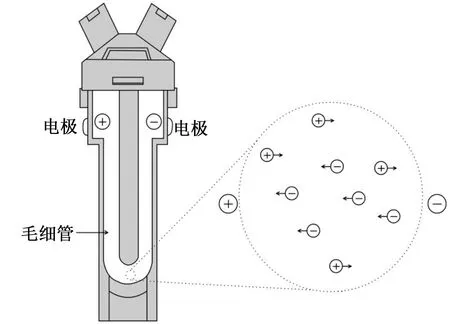
图4 Zeta电位毛细管样品池Fig.4 Zeta potential capillary sample pool
2.2.2 AFM实验样品制备
AFM样品制备方法如下(图5):
(1)剪取合适大小的双面胶,利用其将事先切割好的1 cm×1 cm大小的云母片平整地贴到载玻片中间;
(2)用磨砂胶带仔细解离云母直至表层平滑完整;
(3)用移液器移取50 μL待测溶液,轻轻滴在刚刚解离好的云母表面,室温下培育5 min,将玻璃皿盖在载玻片上方,防止样品被污染;
(4)沉积完成后,将云母片表面余液吸走,用约50 μL去离子水清洗10次左右,用氮气轻轻吹干,置于干燥箱里约1 h待扫描。

图5 原子力样品制备步骤示意图Fig.5 Procedure of the sample preparation for AFM
3 实验结果
3.1 DNA电泳迁移率测量结果
从B.I.Shklovskii研究小组的理论可知,当多价抗衡离子的浓度达到一个临界值时,结合在DNA表面的抗衡离子的总电荷大于DNA的表面电荷,使得DNA的净电荷的符号发生了逆转,这种现象就叫做DNA的电荷逆转。
通过DLS实验,DNA的电泳迁移率测量结果如表1和图6所示。表1是DNA在不同浓度组氨酸溶液中的电泳迁移率,图6是根据表1中数值所画出的曲线图。可以看出,随着组氨酸浓度的改变,DNA的电泳迁移率逐渐变大然后趋于稳定达到饱和状态,当组氨酸浓度为0.1 mg/mL时,DNA的电泳迁移率为-0.62×10-4cm2·V-1·S-1左右,而当组氨酸浓度为1 mg/mL时,DNA的电泳迁移率变为0.51×10-4cm2·V-1·S-1左右,这是因为随着组氨酸浓度的升高,溶液中正电荷增多,中和了DNA表面的负电荷,增强静电相互作用,所以迁移率由负变为正,DNA发生电荷逆转。
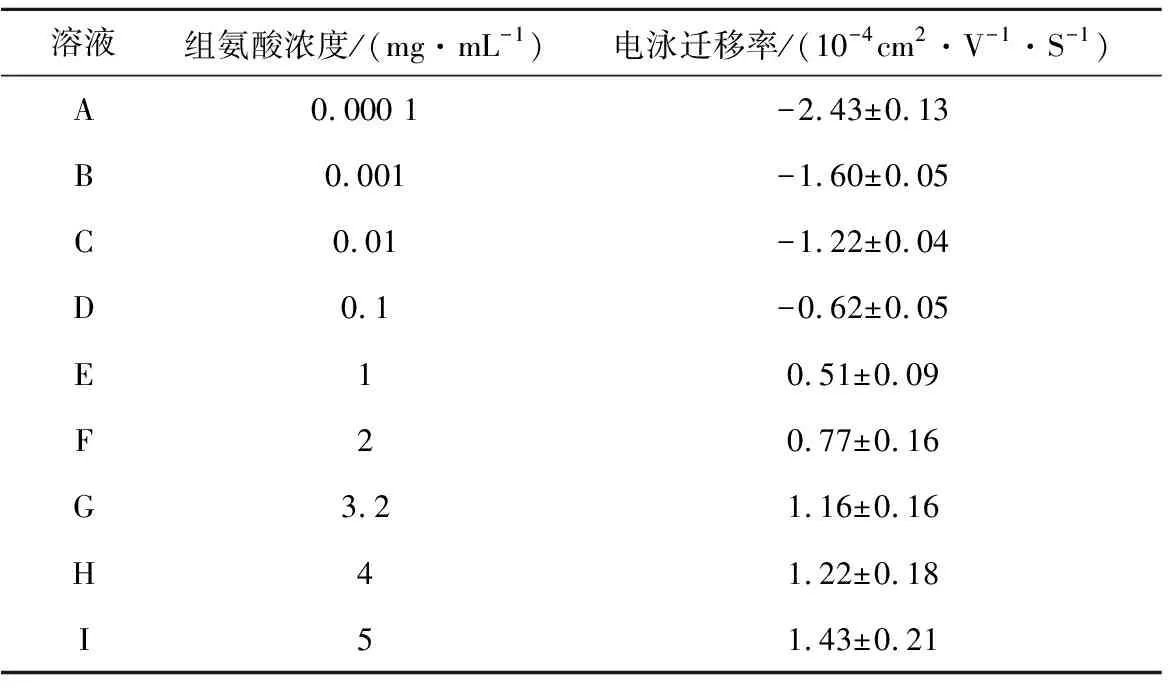
表1 DNA在不同浓度组氨酸溶液中的电泳迁移率Table 1 The electrophoresis mobility of DNA in Histidine solution with different concentrations

图6 不同浓度的组氨酸对DNA电泳迁移率的影响Fig.6 Electrophoretic mobility of DNA as a function of the concentration of Histidine
3.2 AFM观察结果
改变组氨酸的浓度,观察到DNA呈现出如图7的形貌特征(实验时,混合溶液中添加的1 mmol/L Mg2+是为了使DNA更好地吸附到云母表面上,对实验结果不会产生影响)。
从图7中可以看出,随着组氨酸浓度的升高,DNA的形貌变的越来越紧密。图7a中组氨酸浓度为0.01 mg/mL,DNA呈自由松散的线状,图7b中组氨酸浓度为0.1 mg/mL,DNA的形状相较于图7a已有明显的折叠聚集现象,图7c中组氨酸浓度为1 mg/mL,DNA已经凝聚成紧凑的球状。

图7 不同浓度的组氨酸与1 mmol/L Mg2+混合溶液中的DNA构象Fig.7 DNA conformations at different concentrations of Histidine and in 1 mmol/L Mg2+ buffer
由于AFM扫描得到的是干燥状态下的DNA结构,这也许会与溶液中DNA的实际形貌有所不同,但是,根据AFM所扫描出的图像可以得出,吸附在云母表面上的DNA只是高度会被压缩,横向的尺寸并不会有所改变,因此AFM只是将体系中的DNA压扁,结构不会发生变化。由于组氨酸溶液显酸性,所以根据组氨酸的化学结构,我们推测,随着组氨酸浓度的升高,其携带的正电荷越来越多,质子化能力加强,中和了DNA表面的负电荷,导致DNA凝聚。
4 结论
本文主要通过DLS和AFM两种实验方法,研究了组氨酸对DNA凝聚及电荷逆转的作用。首先用DLS技术对DNA的电泳迁移率进行测量,观察到当组氨酸浓度升高至1 mg/mL时,电泳迁移率由负变为正,DNA发生电荷逆转。同时,AFM实验结果显示,随着组氨酸浓度的升高,DNA分子逐渐堆积折叠,直至在组氨酸浓度为1 mg/mL时凝聚成球,说明了组氨酸可以导致DNA凝聚和电荷逆转。由于组氨酸的等电位点为7.59,组氨酸残基中的咪唑环包含两个N原子,其中一个在具有重要生物学意义的pH范围6~7时质子化,所以可以相信组氨酸侧链的质子化和去质子化对其带电状态起调节作用。像组氨酸这样的聚胺类试剂对于DNA凝聚的作用,在生命体内具有较高的借鉴意义,这对DNA凝聚的理论解释进行了实验上的补充,也为研究组蛋白与DNA之间的相互作用提供了参考。在实验中我们发现溶液pH的变化也能够对DNA凝聚的形貌产生影响,这将是今后的研究方向。
