大黄酸增强低氧环境中效应T细胞的抗结肠癌活性
2018-08-27袁向飞田文聪谢俊木子
袁向飞,田文聪,谢俊木子,王 丰
作为一种过继免疫疗法,CD19嵌合抗原受体T细胞 CAR-T (chimeric antigen receptor T cell,CAR-T)在治疗B淋巴细胞白血病方面取得了举世瞩目的成功,被认为是CAR-T治疗技术的里程碑;由此,CAR-T在治疗实体肿瘤领域中的应用也成为了新近的肿瘤免疫治疗研究的热点[1]。Katz等[2-4]利用以癌胚抗原为靶点的CAR-T(CEA CAR-T)开展了一系列针对结肠癌肝转移和腹膜转移的临床前研究工作,特别是对于肝转移的治疗已经进入临床Ⅰ期试验阶段;然而,他们也同时指出肿瘤固有的免疫抑制微环境是限制CAR-T疗效的重要原因之一。
实体肿瘤的免疫抑制微环境与其瘤内的低氧状态密切相关,许多研究业已证实:在低氧环境中,肿瘤细胞往往会上调诸多免疫抑制分子,比如程序性死亡受体-配体1(PD-L1)[5-6]、半乳糖凝集素-1(galectin-1)[7]、环氧合酶 -2(COX-2)[8]和血管内皮生长因子(VEGF)[9]等。而低氧诱导因子-1(HIF-1)作为低氧环境的重要响应元件,直接调控着上述免疫抑制分子的转录。
大黄酸又名1,8-二羟基-3-羧基蒽醌,是中药大黄的主要有效成分之一。在我们的前期研究工作中发现大黄酸能够下调胰腺癌细胞中HIF-1α(HIF-1的亚基)的水平,从而降低其下游分子的表达水平[10]。据此我们认为:在低氧环境下,大黄酸能够通过降低结肠癌中HIF-1α的水平致使其免疫抑制分子的表达下调,从而有助于效应T细胞对肿瘤细胞的杀伤。
1 材料与方法
1.1 细胞培养 人结肠癌细胞系HT29和HCT116,以及人胚肾来源的细胞系293 T用含10%胎牛血清(FBS)的DMEM培养基培养。低氧条件培养在低氧罐进行,步骤如下[11-12]:用N2(95%) 和CO2(5%)的混合气体充满罐体,待罐内O2水平降为1%时,密封并置于37 ℃。常氧条件培养在37 ℃、5% CO2的恒温培养箱中常规进行。
将健康成人志愿者的外周血用淋巴细胞分离液(Ficoll)分离出单个核细胞。分离出的细胞用含10%FBS和100 U/mL重组人白介素-2的RPMI-1640培养基于37 ℃、5% CO2的恒温培养箱中常规培养,隔天换液一次。
1.2 细胞生存率实验 各细胞以1×104个/孔的密度接种于96孔板,经不同浓度的大黄酸处理48 h后,用CCK-8试剂检测细胞的生存率。实验重复3次,每次设3个平行复孔。
1.3 实时定量PCR(qPCR) 收集不同处理后的细胞,加入Trizol试剂,提取总RNA。将4 μg总RNA用SuperScript™ First-Strand Synthesis System逆 转 录 成 cDNA。 用 SYBR®Premix Ex Taq™kit进行PCR,步骤如下:95℃变性5 s;60 ℃退火34 s;40个循环。β-actin作为内参基因。各基因引物序列见表1。结果用ΔΔCt法分析,实验重复3次,每次设3个平行复孔。
1.4 外周血淋巴细胞(PBL)特异识别细胞系的建立 mCD3scfv的序列由中国医学科学院血液学研究所熊冬生教授馈赠,该序列包括信号肽、HA标签、柔性肽链、CD3抗体轻链可变区、CD3抗体重链可变区和血小板衍生生长因子受体跨膜区等序列元件(图1)。
将mCD3scfv序列通过EcoR I和BamH I限制性酶切位点插入慢病毒质粒pCDH1-CMV-MSCEF1-Puro后,与慢病毒骨架质粒共转染293T细胞,包装慢病毒,方法见参考文献[13]。用该慢病毒感染HT29细胞48 h后,加30 μg/mL的嘌呤霉素连续筛选2周。最终获得稳定表达mCD3scfv的HT29细胞系,命名为HT29-CD3scfv。

图1 mCD3scfv编码序列结构示意图
1.5 Western blot 用细胞裂解液RIPA裂解细胞后,将蛋白行SDS-PAGE电泳,然后电转移至PVDF膜。PVDF膜用5%脱脂奶4 ℃封闭过夜,加一抗室温孵育1 h,用TBS-T清洗3遍后,再加HRP标记的二抗室温孵育1 h,再用TBS-T清洗3遍后,ECL发光试剂盒检测目的蛋白条带。β-tubulin为内参对照。
1.6 流式细胞术与免疫荧光 细胞用PBS清洗2遍后,与APC标记的抗HA-Tag单抗共孵育30 min,用流式细胞仪进行检测。将细胞用甩片机甩至玻片,经4%多聚甲醛固定后,用1%BSA封闭1 h。用APC标记的抗HA-Tag单抗孵育1 h后,再用DAPI染核5 min,随后用激光共聚焦显微镜拍照。
1.7 PBL的细胞毒性检测 将PBL与肿瘤细胞按不同效靶比(E:T)混合培养16 h后,用CytoTox96® Non-Radioactive Cytotoxicity Assay Kit检测肿瘤细胞被杀伤的百分率,具体方法参照试剂盒说明。实验重复3次,每次设3个平行复孔。1.8 统计方法 应用EXCEL软件进行统计学分析。数据为计量资料,以均数±标准差()表示。多组间均数采用单因素方差分析,进一步的两两比较采用Dunnettt检验,P<0.05为差异有统计学意义。
2 结果
2.1 大黄酸对结肠癌细胞系和人PBL的细胞毒性 CCK-8检测结果显示(图2):大黄酸对人结肠癌细胞系HT29和HCT116的细胞生存率都有抑制效果。本研究着重关注大黄酸对免疫抑制分子的调节功能,故而选择对结肠癌细胞生存影响非常小的两个浓度(25 μM和50 μM)作为后续工作的研究剂量。此外,在此两个浓度的大黄酸作用下,PBL的细胞生存率并没有受到明显抑制。这提示我们可以将低浓度的大黄酸与PBL联合用于抗结肠癌的研究。

图2 CCK-8检测大黄酸对结肠癌细胞系和PBL的细胞毒性
2.2 大黄酸在低氧条件下下调HIF-1α和免疫抑制分子PD-L1和galectin-1 HT29细胞分别在常氧、低氧、低氧+25 μM大黄酸和低氧+50 μM大黄酸条件下处理16 h后,用Western blot和qPCR检测细胞中HIF-1α的水平以及PD-L1和galectin-1的转录水平。Western blot结果显示(图3A):低氧条件使HIF-1α的水平较明显升高;而在低氧条件下加入25 μM或者50 μM大黄酸后,细胞中HIF-1α的水平显著降低;特别是加入50 μM大黄酸后,细胞HIF-1α水平甚至低于常氧培养组。PD-L1和galectin-1是肿瘤细胞表面表达的能够直接诱导效应T细胞发生凋亡的免疫抑制分子。用qPCR检测上述各处理组细胞中PD-L1和galectin-1的mRNA,结果与HIF-1α水平的变化趋势相似(图3B):与常氧对照组相比,低氧组、低氧+25 μM大黄酸组和低氧+50 μM大黄酸组细胞中PD-L1 mRNA的相对量分别为 1.63±0.29、0.80±0.17和0.47±0.12;galectin-1mRNA的相对量分别为4.42±0.73、0.47±0.11和0.24±0.11。低氧使它们转录增多;在低氧条件下加入大黄酸后,它们的转录水平显著下降,但大黄酸两个浓度处理组之间没有显著性差异(a代表P<0.05;b代表P<0.01)。提示大黄酸可以阻断由低氧引起的PD-L1和galectin-1表达增高所导致的效应T细胞凋亡。

图3 Western blot和qPCR检测大黄酸对HIF-1α、PD-L1和galectin-1的抑制作用
2.3 PBL特异识别的结肠癌细胞系的建立和鉴定 为了验证大黄酸能够增强效应T细胞的肿瘤杀伤能力,我们建立了一株能够被PBL特异识别并杀伤的结肠癌细胞系HT29-CD3scfv。该细胞系是通过慢病毒感染HT29细胞,并经过嘌呤霉素筛选出的能够稳定表达膜结合型抗CD3单链抗体(mCD3scfv)的细胞系,它可以通过膜表面的单链抗体与淋巴细胞表面的CD3结合,从而激活T淋巴细胞,实现特异的识别和杀伤。
首先,利用mCD3scfv中的HA标签鉴定该融合蛋白在HT29-CD3scfv中的表达和定位,以HT29-control细胞为对照。Western blot结果显示 HT29-CD3scfv成功表达mCD3scfv蛋白(图4A)。激光共聚焦显微镜结果显示mCD3scfv定位在细胞膜(红色,蓝色为细胞核,图4B)。然后,依然用APC标记的抗HA标签抗体标记细胞,做流式细胞术分析,结果显示HT29-CD3scfv中表达融合蛋白的细胞比例为96.8%,而HT29-control细胞的阳性率只有0.2%(图4C)。最后,将PBL分别与HT29-CD3scfv或者HT29-control按不同效靶比(5:1~20:1)混合培养16 h后,用CytoTox96®Non-Radioactive Cytotoxicity Assay Kit检测肿瘤细胞死亡率。结果显示(图4D):PBL对HT29-CD3scfv有显著杀伤,并且随着效靶比的增加,杀伤效率也升高;而对HT29-control,PBL在不同效靶比下的杀伤效率都非常低。说明PBL对HT29-CD3scfv能够特异性识别并杀伤。
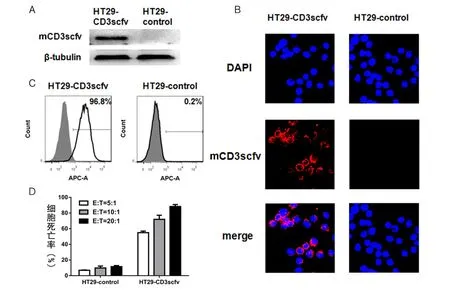
图4 HT29-CD3scfv细胞的鉴定
2.4 大黄酸逆转由低氧造成的PBL对结肠癌细胞杀伤能力降低 对HT29-CD3scfv细胞分别进行3种不同处理:(1)常氧培养8 h后,按不同效靶比加入PBL,继续常氧培养16 h;(2)低氧培养8 h后,按不同效靶比加入PBL,继续低氧培养16 h;(3)加50 μM大黄酸低氧培养8 h,按不同效靶比加入PBL,继续低氧培养16 h(含50 μM大黄酸)。用 CytoTox96®Non-Radioactive Cytotoxicity Assay Kit检测肿瘤细胞死亡率。结果显示:当效靶比为1:1、2:1和4:1时,T细胞对肿瘤细胞的杀伤百分率分别为(27.32±3.05)%、(42.68±3.69)%和(54.02±1.82)%;而 低 氧 条 件 下, PBL的杀伤能力分别下降至(21.53±3.74)%、(33.55±1.51)%和(45.20±2.27)%,与相应的常氧条件培养组相比有显著性差异;在低氧条件下加入50 μM大黄酸,杀伤百分率又分别被恢复升高至(32.70±2.37)%、(47.01±3.15)%和(57.26±1.12)%,与相应的单纯低氧条件培养组相比存在统计学差异(图5,a代表P<0.05;b代表P<0.01)。

图5 PBL在不同条件下对肿瘤细胞的杀伤能力
3 讨论
诸多研究结果已经表明:实体瘤内的低氧状态与其免疫抑制微环境密切相关,而免疫抑制微环境又是T细胞免疫治疗实体瘤的巨大障碍[14-15]。在低氧的环境中干扰肿瘤细胞中HIF-1α的表达可以提高T细胞对其的杀伤能力[5]。鉴于在早先研究工作中我们发现中药有效成分大黄酸能够使胰腺癌细胞在低氧条件下的HIF-1α水平下降[10],故而我们推测大黄酸有望增强T细胞在低氧时抗肿瘤活性。
在本研究工作中,我们以结肠癌细胞为实验对象,首先确定了大黄酸在体外实验研究中的使用浓度(25 μ M和50 μM)。在上述浓度作用下,胰腺癌细胞系和PBL的生长都没有受到显著影响。随后又验证了在这两个浓度的大黄酸作用下,结肠癌细胞系中由低氧条件引起的HIF-1α水平升高被逆转。进而,我们又以两个明确受HIF-1α调控的免疫抑制分子(PD-L1和galectin-1,二者可以直接引起T细胞凋亡)为检测指标[5,9]。在低氧条件下,上述两个分子的转录水平均有升高;而在加入大黄酸之后,其转录水平被显著下调。为了能够在体外验证大黄酸对低氧条件下T细胞抗肿瘤活性的影响,我们建立了能够被PBL特异识别杀伤的结肠癌细胞系。最后在此细胞系上,我们验证了大黄酸可以逆转低氧造成的PBL杀伤肿瘤活力下降。这些结果预示了大黄酸与免疫细胞疗法联合使用可以增强免疫细胞抗肿瘤活力的可能性。
在现有的工作基础之上,还有更多的研究内容亟待我们去探索。(1)虽然我们发现大黄酸对PBL的生长没有产生影响,但是它对PBL其它功能的影响还需要进一步的了解。实际上HIF-1α对T淋巴细胞的作用目前仍存在争议:一部分人认为在肿瘤内的T细胞需要HIF-1α的水平升高来提供能量[16-17];另一部分人则证明了抑制HIF-1α能够促进T细胞分化为记忆性T细胞,甚至增强瘤苗的疗效[18-20]。(2)肿瘤的免疫抑制微环境构成复杂,包括免疫抑制分子和免疫抑制细胞。实际上,除了PD-L1和galectin-1之外,我们还检测了其它免疫抑制分子(比如COX-2、VEGF等)在大黄酸作用下的转录水平变化,其趋势均与PD-L1和galectin-1非常类似。而免疫抑制细胞诸如TAM、MDSC、Treg等是免疫抑制微环境的重要组分,它们的免疫抑制功能在很大程度上依赖于各种免疫抑制分子和HIF-1[21-23]。因此,在动物体内研究大黄酸对各种免疫抑制细胞比例的调控作用将是下一步工作的重点。
