辣椒茸毛性状的遗传研究和基因定位
2015-08-08刘晓丹严景日王平勇张建盈沈火林
刘晓丹 严景日 王平勇 张建盈 沈火林
(中国农业大学农学与生物技术学院,设施蔬菜生长发育调控北京市重点实验室,北京 100193)
茸毛是很多植物器官表面的毛状体,植物表面茸毛状物常与抗虫、耐干旱、耐盐、抗病及防御紫外线辐射等有着直接或间接的关系。棉花茎和叶片多茸毛性状对棉蚜及其他刺吸式口器害虫有较强的抗性,能有效减轻害虫危害(郭香墨 等,1994)。多茸毛番茄对蚜虫、烟粉虱、飞虱和美洲斑潜蝇等具有较好的驱避作用(郑贵彬和郁和平,1986;Kennedy,2003;王志民 等,2006;高建昌 等,2007),可以显著减少病毒病的发生,而且具有较好的耐涝性和耐高温能力(郑积荣 等,2010)。多毛番茄的腺毛还可以分泌甲基酮类物质、倍半萜烯类物质以及酰基糖类物质(Burke et al.,1987),这些次生代谢物是主要的抗虫性分泌物(Dimock & Kennedy,1983;Lin et al.,1987;Carter et al.,1989;Kenndy,2003)。辣椒主茎和叶片表面茸毛状物的分布被认为与烟粉虱、疫病抗性有关(Egea-Gilabert et al.,2008;Syarifin et al.,2011),辣椒表皮茸毛可以通过减轻蚜虫的危害来提高辣椒的抗病毒能力(尚宏芹,2004b),所以在辣椒抗性育种中茸毛有着重要的潜在利用价值。
刘金兵等(1998)研究表明,辣椒多茸毛对无毛茸为显性遗传。杜锋(2004)研究发现辣椒茸毛性状由1对显性基因控制且具有不完全显性特征,并筛选出了1个与茸毛基因连锁的RAPD标记S1513,遗传距离为3.98 cM。Kim等(2010)通过BAC文库克隆找到1个控制辣椒茸毛的位点Ptl1,将其定位于10号染色体,开发了2个分子标记Tco和Tsca,离位点Ptl1的遗传距离分别为0.33 cM和0.75 cM。
本试验利用多茸毛和无茸毛材料及其F2群体,研究辣椒茸毛的形态特征和遗传规律;并利用群体分离分析法(BSA)对F2群体进行基因分型,期望获得与辣椒茸毛性状紧密连锁的分子标记,实现对茸毛性状的基因定位,为进一步克隆辣椒茸毛基因并应用于辣椒抗性育种提供科学依据。?
1 材料与方法
1.1 试验材料
供试辣椒无茸毛材料为编号1788W的高代自交系,表现为茎、叶光滑无茸毛;多茸毛材料为编号1789M的高代自交系,表现为茎、叶多茸毛;1788W和1789M正反交产生F1,F1(1788W×1789M)自交产生F2群体;所有材料均由中国农业大学辣椒课题组提供。
试验材料均于2014年8月1日播种,其中1788W、1789M 各 50株,正反交 F180株,F2480 株,9月3日定植于中国农业大学科学园温室内。
1.2 辣椒茸毛性状观察与遗传分析
定植30 d后,开始对1788W、1789M、F1及F2群体各单株的植株茸毛有无情况进行田间调查,并对调查结果进行卡方检测。
定植45 d后,选取生长状况一致的1788W、1789M植株各10株,分别在幼茎(靠近生长点的茎段)、成熟茎(自上而下第5茎节的茎段)、幼叶(离生长点最近的茎节上的叶片)、成熟叶片(自上而下第5茎节上的叶片)等4个不同部位取样(尚宏芹,2009),徒手制片,每个部位观察3个视野,在Olympus显微镜下观察茸毛显微结构,并结合Lecia体视显微镜测定茸毛密度及长度。
1.3 辣椒茸毛性状的基因定位
1.3.1 基因组DNA的提取 采用改良的CTAB法(Kabelka et al.,2002) 提 取 1788W、1789M、F1及F2群体各单株幼嫩叶片的基因组DNA,采用1%琼脂糖凝胶电泳检测;并将每个样品提取的DNA浓度统一稀释成 50 ng·μL–1。
1.3.2 分子标记开发与基因定位 通过辣椒基因组网站(http://pepper sequence.genomics.cn)下载辣椒基因组信息,采用Misa结合Primer3批量设计SSR引物。一般开发利用重复次数在10次以上的简单重复序列结构位,所用的SSR标记由北京三博引物合成公司合成。PCR扩增反应体系(12 μL)包括:Mix 4.5 μL、ddH2O 5.5 μL、DNA 模 板 1.0 μL,R/F引物各0.5 μL。反应程序为:94 ℃预变性5 min;94 ℃ 50 s,53 ℃ 45 s,72 ℃ 50 s,35 个循环;72 ℃延伸 10 min;4 ℃保存。采用 8.0%非变性聚丙烯酰胺凝胶电泳对扩增产物进行分离和检测(郑钊,2009)。
1.3.3 连锁分析方法 对所有群体田间调查结果的分离比进行卡方测验,并对所有分子标记在群体上的分离模式进行卡方检测。共显性标记数据记录时结果与1788W基因型表现一致的记录为“a”,与1789M基因型一致的记录为“b”,杂合型记录为 “h”;显性标记统计结果则是与1788W基因型表现一致的记录为“a”,其他记录为“c”,缺失的记录为“-”。采用 JoinMap 4.0 软件(van Ooijen,2006)进行标记连锁分析。
2 结果与分析
2.1 辣椒茸毛形态特征
2.1.1 辣椒茸毛显微形态观察 田间观察结果显示,辣椒的茸毛性状在植株的整个生育期都可以观察到。
显微观察结果表明(图1),茎和叶表皮茸毛由部分表皮细胞向上突起形成(图1-a),每根表皮茸毛均由多个细胞串联形成,细胞数量在2~30个之间,茸毛长度一般在0.2~1.0 mm之间,大多数集中在0.8 mm左右,且其长短取决于细胞数量的多少。茸毛上排列的细胞体积大小不等,弯曲部位的细胞体积小于其他细胞。茸毛上每个细胞都是生活细胞,可以观察到有明显的细胞核(图1-b)。茸毛可分为两种:一种为直立不分杈型,从基部细胞上直接生出1根茸毛,大多细长、顶端尖锐,辣椒茎和叶表皮茸毛绝大多数为此种;另一些茸毛在基部或者中部发生分杈,形成分杈茸毛(图1-c),并且大多与单茸毛交织在一起,形成覆盖在表皮表面的茸毛层。

图1 辣椒茸毛细胞显微结构
2.1.2 辣椒茸毛分布特点 以无茸毛辣椒材料1788W作为对照进行田间观测,多茸毛辣椒材料1789M的茎、叶片正反面、叶缘、叶脉均密布白色茸毛,植株上部茸毛多于下部。
在体视显微镜下观察,多茸毛辣椒材料1789M靠近生长点的幼茎、成熟茎段、幼叶叶片正面及背面均着生大量茸毛;而无茸毛辣椒材料1788W不论幼叶还是茎,基本无茸毛着生(图2)。
对多茸毛辣椒材料1789M不同部位上的茸毛进行田间观察,发现不同部位茸毛密度不同:一般叶片背面比叶片正面多,靠近生长点的幼茎比下部成熟茎多,越靠近生长点茸毛越多。
由表1可知,无茸毛辣椒材料1788W的茎、叶基本无茸毛着生,密度约为0;而多茸毛辣椒材料1789M的茎、叶均密布茸毛,且不同部位的茸毛密度存在极显著差异,以幼茎上的茸毛密度最大(约67.7根·cm-2),其次是成熟茎、叶片背面主脉,叶片正面主脉的茸毛密度最小(约18.5根·cm-2)。

图2 1789M和1788W不同部位茸毛对比
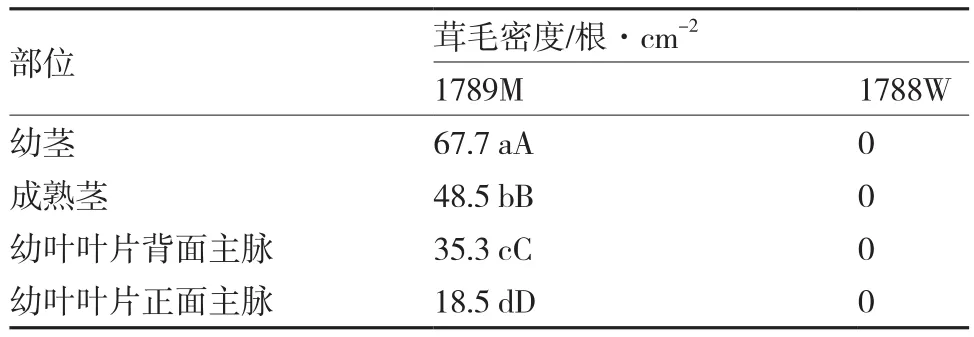
表1 辣椒不同部位的茸毛密度
2.2 辣椒茸毛性状的遗传分析
田间调查结果显示,F1(1788W×1789M)中有茸毛株数与无茸毛株数的表型分离比为75∶0,反交Fl(1789M×1788W)中有茸毛株数与无茸毛株数的表型分离比为78∶0,由此可知有茸毛性状对无茸毛性状为显性,且该性状的遗传是由细胞核控制的;F2群体的茸毛性状的分离结果为有茸毛株数∶无茸毛株数=350∶130,经卡方测验χ2为0.056,小于 χ2(0.05,1)=3.841,符合 3∶1 的预期分离比,说明辣椒茸毛性状是由1对显性基因控制的。
2.3 辣椒茸毛性状的基因定位
从F2分离群体中随机选择10株有茸毛单株和10株无茸毛单株,将其稀释后的DNA分别等量混合构成有茸毛基因池和无茸毛基因池(曾跃辉 等,2013)。用均匀分布于辣椒12条染色体上的120对SSR标记对1788W、1789M、F1及有茸毛基因池和无茸毛基因池进行多态性分析,结果30%(36条)的随机引物在1788W、1789M中表现出多态性;在有茸毛基因池和无茸毛基因池之间表现出多态性的引物有8对,其中3对位于辣椒10号染色体上,并且在1788W、1789M、F1及两基因池之间表现出稳定的多态性。同时用这3对SSR引物对F2群体单株进行检测,确定其标记与辣椒茸毛性状连锁,初步将控制辣椒茸毛基因锚定于10号染色体上。
进一步利用基因组信息,在10号染色体上开发了200对SSR引物。采用PCR扩增和电泳检测,发现仅有13对SSR标记表现出稳定的多态性。结合分离群体分析法(BSA)对所有F2单株进行检测和分析,采用Joinmap 4.0软件对所有SSR标记(表2)和茸毛基因的连锁关系进行分析,最后将茸毛基因定位在辣椒10号染色体上(图3),位于标记ssr10-19和ssr10-21之间,且两标记与该茸毛基因的相对遗传距离分别为5.3 cM和13.3 cM。

表2 与辣椒茸毛基因连锁的分子标记
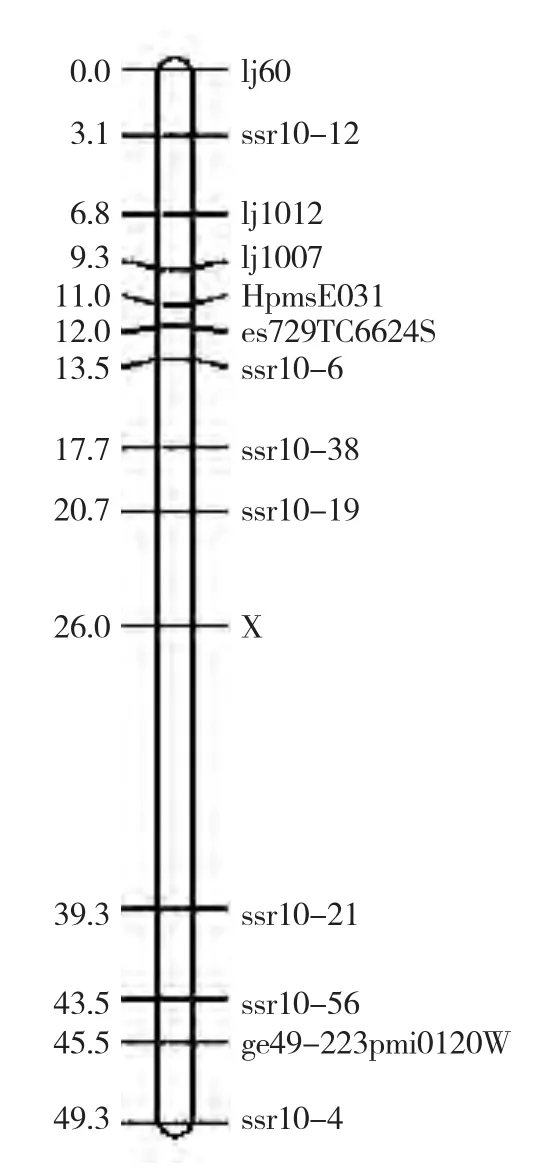
图3 辣椒茸毛性状的分子标记连锁图
3 结论与讨论
本试验结果表明,辣椒茎和叶片表皮茸毛的分布与番茄相似(柴敏和丁云花,2002b),都是体表密生白色茸毛,在各个器官均有分布;不同部位的茸毛密度不同,在辣椒上以幼茎的密度最大,其次是成熟茎,再次是叶片背面主脉、叶片正面主脉,这与前人(尚宏芹,2009;胡能兵 等,2010)在辣椒上的研究结论相符。番茄上的茸毛分为有腺体茸毛和无腺体茸毛(Luckwill,1943),控制番茄茸毛表达的基因不同,形态有所差异,Ln、Womz基因控制形成的茸毛以单茸毛为主,有少数二杈或三杈毛(柴敏和丁云花,2002a);而Wo基因所产生的茸毛以分杈毛为主,常能观察到似鹿角状的多杈毛(柴敏和丁云花,2002b)。而本试验未在辣椒上观察到腺体茸毛,且辣椒的茸毛大多是以直立不分杈的单茸毛状态存在,分杈毛很少。
本试验结果表明,辣椒茸毛性状属于质量性状,受1对显性核基因控制,而杜锋(2004)的研究则认为辣椒茸毛性状由1对显性基因控制且具有不完全显性特征。杜峰(2004)在田间等级划分时发现了茸毛分离的连续性;张晓芬等(2013)同样发现辣椒叶片与主茎茸毛存在密度差异。而本试验中未出现密度明显的连续性分离,F1、F2群体有茸毛植株的茎上茸毛密度大多集中在30~50根·cm-2之间,成熟叶片上的茸毛密度大多集中在15~25根·cm-2之间,因此笔者简单地将其归结为有 茸毛。
本试验利用480株F2单株,结合群体分离分析法(BSA),将辣椒茸毛基因定位于10号染色体末端端粒处,这与Kim等(2010)的研究结果相符。本试验找到的SSR标记ssr10-19与该茸毛基因的相对遗传距离为5.3 cM,与杜锋(2004)找到的RAPD标记S1315相比较,S1315虽然与辣椒茸毛基因的遗传距离更近,但是该RAPD标记需要经过PCR、酶切等相对复杂的过程,而本试验根据基因组设计出的SSR标记只需要经过PCR即可,简化了检测过程。Kim等(2010)通过构建BCA文库发现了1个控制茸毛形成的位点Ptl1,HpmsE031位于此位点之中,并开发了2个标记Tco和Tsca,离位点Ptl1的相对遗传距离分别为0.33 cM和0.75 cM。本试验在最初确定辣椒茸毛基因位于10号染色体后,就先用Tco和Tsca在父母本材料上进行扩增,结果无明显差异;标记HpmsE03在本试验中虽有差异但也不是紧密连锁,可能是材料来源不同、群体大小不同、遗传背景不同造成的。遗传模式植物拟南芥中控制茸毛形成及生长的基因 远 不 止 一 个(H ü lskamp et al.,1994;Szymanski et al.,2000;Walker et al.,2000;Schellmann et al.,2002),茄科植物番茄中控制茸毛性状的基因已报道的就有Wo/Womz、Ln等,所以本试验中控制辣椒茸毛的基因与Kim等(2010)报道的茸毛基因是否相同还有待深入研究。
柴敏,丁云花.2002a.番茄多茸毛基因Womz的遗传表现及其利用价值.园艺学报,29(2):133-136.
柴敏,丁云花.2002b.番茄多茸毛基因Ln的遗传研究.华北农学报,17(4):18-21.
杜锋.2004.辣椒茸毛性状的初步研究〔博士论文〕.长沙:湖南农业大学.
高建昌,杜永臣,王孝宣,国艳梅.2007.番茄抗虫育种研究进展. 中国蔬菜,(3):38-42.
郭香墨,丰嵘,刘海涛,汪若海,陈秀芳.1994.棉花多茸毛性状的引进和利用.中国棉花,22(9):4-5.
胡能兵,隋益虎,张子学,何克勤.2010.辣椒9024苗期茸毛性状测定及其光合性能比较.华北农学报,25(s):144-147.
刘金兵,孙洁波,赵华仑,丁犁平,钱芝龙.1998.辣椒紫花花丝花柱和茸毛性状纯系的选育初报.中国蔬菜,(3):36.
尚宏芹,高昌勇,刘建萍.2004a.不同植物体表茸毛的研究进 展.安徽农业科学,32(5):1009-1012.
尚宏芹,刘建萍,戴洪义,高昌勇,赵丽兰,孙显明.2004b.辣椒体表茸毛与抗蚜虫关系的研究.莱阳农学院学报,21(4):293-295.
尚宏芹.2009.辣椒体表茸毛的形态结构与分布特点研究.安徽农业科学,37(1):124-125.
王志民,柴敏,姜立纲,John C S.2006.从多毛野生番茄中初步鉴定出一个抗美洲斑潜蝇的显性基因.分子植物育种,4(3):399-403.
张晓芬,陈晓慧,陈斌,韩华丽,耿三省.2013.野生辣椒重组自交系群体主茎和叶片表面茸毛密度的遗传分析.农业生物技术学报,21(4):407-412.
曾跃辉,朱永生,连玲,谢鸿光,张建福,谢华安.2013.水稻茸毛基因GL6的遗传学分析与精细定位.科学通报,58(11):1027-1035.
郑贵彬,郁和平.1986.茸毛番茄新品系一代杂交种的避蚜防病(CMV)效果的初步探讨.中国农业科学,(4):57-61.
郑积荣,汪炳良,王慧俐.2010.番茄多茸毛性状的遗传研究及其利用价值.江西农业学报,22(6):61-64.
郑钊.2009.粳稻云引稻瘟病抗性基因的遗传学分析及精细定位 〔硕士论文〕.福州:福建师范大学.
Burke B A,Goldsby G,Mudd J B.1987.Polar epicuticular lipids ofLycopersiconpennellii.Phytochemistry,26(9):2567-2571.
Carter C D,Gianfagna T J,Sacalis J N.1989.Sesquiterpenes in glandular trichomes of a wild tomato species and toxicity to the Colorado potato beetle.J Agric Food Chem,37(5):1425-1428.Dimock M B,Kennedy G G.1983.The role of glandular trichomes in the resistance ofLycopersicon hirsutum.f. glabratumtoHeliothis zea.Entomol Exp Appl,33:263-268.
Egea-Gilabert C,Bilotti G,Requena M E,Ezziyyani M,Vivo-Molina J M,Candela M E.2008.Pepper morphological traits related with resistance toPhytophthoracapsici.Biologia Plantarum,52(1):105-109.
H ü lskamp M,Misera S,Gerd J G.1994.Genetic dissection of trichome cell development inArabidopsis.Cell,76(3):555-566.
Kabelka E,Franchino B,Francis D M.2002.Two Loci fromLycopersicon hirsutumLA407 confer resistance to strains ofClavibacter michiganensissubsp.michiganensis. Phytopathology,92:504-510.
Kennedy G G.2003.Tomato,pests,parasitoids and predators:tritrophic interactions involving the GenusLycopersicon.Ann Rev Entomol,48:51-72.
Kim H J,Han J H,Kwon J K,Park M,Kim B D,Choi D.2010. Fine mapping of pepper trichome locus 1 controlling trichome foration inCapsicum annuumL. CM334.Theoretical and Applied Genetics,120(6):1099-1106.
Lin S Y H,Trumble J T,Kumamoto J.1987.Activity of volatile compounds in glandular trichomes ofLycopersiconspecies against two insect herbivores.Journal of Chemical Ecology,13(4):837-859.
Luckwill L C.1943.The genusLycopersicon:an historical,biological and taxanomic survey of the wild and cultivated tomatoes.Aberdeen University Studies,120:44.
Schellmann S,Schnittger A,Kirik V,Wada T,Okada K,Beermann A,Thumfahrt J,J ü rgens G,H ü lskamp M.2002.TRIPTYCHONandCAPRICEmediate lateral inhibition during trichome and root hair patterning inArabidopsis.EMBO J,21:5036.
Sugita T,Sem Y,Sawada H,Utoyama Y,Hosomi Y,Yoshimoto E,Maehata Y,Fukuoka H,Nagata R,Ohyama A.2013.Development of simple sequence repeat markers and construction of a high-density linkage map ofCapsicum annuum.Mol Breeding,31:909-920.
Szymanski D B,Lloyd A M,Marks M D.2000.Progress in the molecular genetic analysis of trichome initiation and morphogenesis inArabidopsis.Trends Plant Sci,5:214-219.
Syarifin F,Adriaan V,Asep H,Enced J.2011.Identification of silver leaf whitefly resistance in pepper.Plant Breeding,130(6):708-714.
van Ooijen J W.2006.JoinMap 4.0,Software for the calculation of genetic linkage maps in experimental populations.Netherland: Wageningen:56.
Walker J D,Oppenheimer D G,Concienne J,Larkin J C.2000.SIAMESE,a gene controlling the endoreduplication cell cycle inArabidopsisthalianatrichomes.Development,18:3931-3940.
Yi G,Lee J M,Lee S,Choi D,Kim B D.2006.Exploitation of pepper EST-SSRs and an SSR-based linkage map.Theor Appl Genet,114:113-130.
