红花檵木离体快繁技术的研究*
2018-08-25刘真华曹灿景
刘真华,曹灿景
(1.山东农业工程学院,山东 济南250100;2.山东工艺美术学院,山东 济南250014)
红花檵木 (Loropetalum chinense var.rubrum)又名红檵木,是檵木 (Loropetalum chinense Oliv.)的变种[1],金缕梅科 (Hamamelidaceae)檵木属(Loropetalum R.Br.)植物[2]。红花檵木花叶色彩绚丽,四季景观变化丰富,兼具适应性强、耐修剪与易造型等优点,是园林绿化广泛应用的彩叶树种之一。红花檵木的坐果率低,且用其种子繁殖易出现返祖现象,而扦插是其当前繁殖的主要手段。但红花檵木是木本植物,与草本植物比较,其扦插生根难,生长速度慢、费工多、成本高,另外,扦插还受到包括环境、土壤、季节等在多种因素的影响[3],从而降低了红花檵木的繁殖系数,使其难以进行工厂化、批量生产,不能满足不断扩大的市场需求[4]。试管内微型繁殖 (micro propagation)不受季节和气候的影响,不仅可以在短时间内培养出大量长势基本一致的优质脱毒试管苗,还可以实现苗木的周年生产供应,有利于珍稀品种和新品种在生产上的迅速推广应用[5]。当前,有关红花檵木繁殖方面的报道主要集中在嫩梢枝条扦插[6]、短枝接穗扦插[7]和嫁接[8]等方面,而在微体高效快繁方面虽有报道,但尚不多见或不成体系。因此,本研究选取红花檵木的茎段作外植体,从外植体丛芽诱导、丛芽继代增殖、生根诱导和驯化移栽4个方面深入探讨不同浓度和配比的激素、培养基类型对红花檵木离体快繁的影响,以期为红花檵木微体快繁体系的建立、种质离体保存提供数据参考,为其工厂化批量生产供应提供理论依据。
1 材料与方法
1.1 试验材料
红花檵木当年生幼嫩枝条,取自山东农业工程学院试验站,其母树株龄约6年,用其茎段做外植体。
1.2 试验方法
1.2.1 外植体消毒
将外植体放置于加有2滴洗洁精的水中浸泡30min,用清水冲洗5min,蒸馏水漂洗3-5次。在超净工作台上,用75%的酒精消毒10s,再用无菌水漂洗3-5次;利用0.2%的HgCl2消毒10min,再用无菌水漂洗3-5次,无菌滤纸吸干外植体表面水分。将幼嫩枝条剪切成1.5-2cm的带节茎段,放入培养皿备用。
1.2.2 丛芽诱导试验
以MS为基本培养基,pH值5.8,设置浓度和配比不同的6-BA与NAA处理9组,其中6-BA浓度依次为0.7mg/L、1.4mg/L和2.1mg/L,NAA浓度依次为0.1mg/L、0.4mg/L和0.7mg/L。以每枝条的第2、3、4节位的茎段作外植体,利于丛芽诱导。将外植体按顶端优势方向斜插入MS培养基中,茎节距培养基表面0.1-0.4cm,接种瓶内分3排,前3中4后3总计10个茎段。每瓶接种10个茎段,每处理10瓶,每处理重复3次,放置于光照培养箱中培养,30d后观察并统计出芽情况。培养箱中温度设置为23-25℃,光照强度1 800-2 000Lx,光照时间为12h/d。
1.2.3 丛芽增殖试验
在丛芽诱导培养基中选取并切割长度为2-2.5cm的丛生芽,接种到增殖培养基上。增殖培养基的制备方法为,以 MS为基本培养基,pH值5.8。设置浓度和配比不同的6-BA与NAA处理6组,其中6-BA浓度依次为0.6mg/L、1.3mg/L和2.0mg/L,NAA浓度依次为0.1mg/L和0.2mg/L。每瓶接种10个丛芽,每处理5瓶,每处理重复3次,放置于光照培养箱中培养,25d后观察并统计出芽情况。培养箱中温度设置为23-25℃,光强1 800-2 000Lx,光照时间为12h/d。
1.2.4 生根培养试验设计
在增殖培养基中,选取并切割长度为3-4cm的单个芽苗,接种到生根培养基上后,先在黑暗中培养2-3d,再转入光照条件下培养。生根培养基的制备方法为,以MS或1/2MS为基本培养基,pH值5.8,设置浓度和配比不同的NAA和IAA处理8组,其中NAA浓度依次为0.4mg/L和0.8mg/L,IAA浓度依次为2mg/L和3mg/L。每瓶接种10个芽苗,每处理5瓶,每处理重复3次,放置于光照培养箱中培养,30d后观察并统计生根情况。培养箱中温度设置为23-25℃,光强1 800-2 000Lx,光照时间为12h/d。
1.2.5 炼苗移栽试验
提高红花檵木组培苗成活率的关键是栽前炼苗,其次是移栽时避免伤根和药液浸根杀菌消毒,再次是栽后水肥管理。其具体做法为:选取组培瓶内高3-4cm的带根健壮试管苗进行移栽。移栽前将组培瓶移至室外,前2d松动瓶盖,后5d打开瓶盖。1周后取出试管苗,用清水洗去附着在根部的琼脂,注意避免伤根,将根在1 000倍的多菌灵溶液中浸泡2min,取出栽植于事先高温消毒的基质中,每处理1张穴盘,每盘50株,每处理重复3次。移栽后组培苗异常脆弱,叶片易失水造成植株死亡,要及时补充肥水以提高成活率。移栽30d后调查组培苗的成活率。
1.3 数据分析与处理
利用Microsoft excel 2003进行数据图表处理。
2 结果与分析
2.1 不同激素配比对外植体丛芽诱导的影响
不同激素浓度配比对红花檵木当年生幼嫩茎段外植体丛芽诱导的影响不同 (表1)。在6-BA浓度一定时,丛芽诱导率随NAA浓度 (0.1-0.7mg/L)的增加表现出逐渐降低的趋势;在NAA浓度一定时,丛芽诱导率随6-BA浓度 (0.7-2.1mg/L)的增加呈现出先增加后降低的趋势。丛芽诱导率以培养基配方MS+6-BA 1.4mg/L+NAA 0.1mg/L条件下最大,达到90%,其次是MS+6-BA 1.4mg/L+NAA 0.4mg/L处理,诱导率达到77%。在6-BA 2.1mg/L+NAA 0.1mg/L处理和6-BA浓度1.4mg/L的3个处理下,丛芽生长致密,其他处理下生长稀疏。
2.2 不同激素配比对丛芽增殖的影响
不同激素浓度配比对红花檵木丛芽增殖效果影响存在差异 (表2)。在NAA浓度一定时,丛芽增殖数、增殖系数、玻璃化数和玻璃化率均随6-BA浓度 (0.6-2.0mg/L)的增加表现出逐渐升高的趋势,且均在培养基中6-BA 2.0mg/L+NAA 0.2mg/L时达到最大值。在6-BA浓度相同条件下,0.1mg/L的NAA处理与0.2mg/L的NAA处理在丛芽数和增殖系数上差异较为明显,而在玻璃化数和玻璃化率方面差异不明显,这说明NAA对丛芽增殖的影响较大,对玻璃化的影响不明显,进而表明造成处理间玻璃化差异显著的主要因素是6-BA。虽然在6-BA 2.0mg/L+NAA 0.2mg/L处理下,红花檵木丛芽增殖数及增殖系数最大,但此时丛芽玻璃化数与玻璃化率也最高,所以综合比较得出丛芽增殖最佳培养基为MS+6-BA 1.3mg/L+NAA 0.2mg/L。
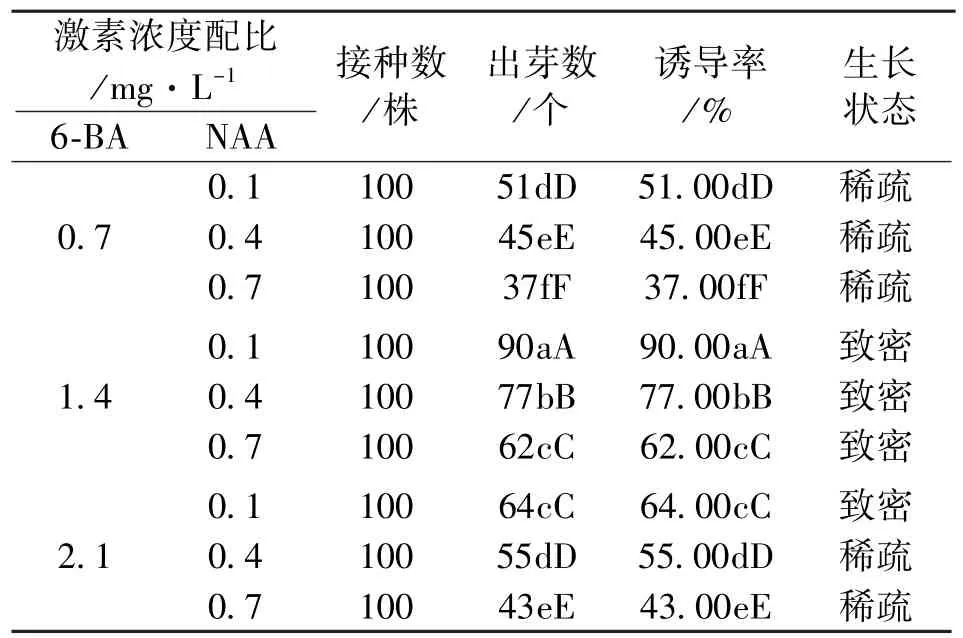
表1 两种激素及其配比对外植体丛芽诱导的影响Tab.1 Effects of different hormonal formulas on inducing differentiation

表2 两种激素及其配比对丛芽增殖的影响Tab.2 Effects of different hormonal formulas on proliferation of cluster buds
2.3 不同浓度激素配比和培养基对红花檵木生根诱导的影响
不同浓度、不同激素及不同培养基的处理,红花檵木诱导生根数与生根率调查结果见表3。由表3可知,在IBA与IAA浓度相同的MS培养基和1/2 MS培养基上,红花檵木诱导生根数与生根率以1/2 MS培养基高于MS培养基,这表明1/2MS培养基更利于红花檵木的生根诱导。在IAA浓度相同时,NAA 0.4mg/L处理下生根数和生根率均大于NAA 0.8mg/L处理,表明NAA浓度0.4mg/L较0.8mg/L更利于红花檵木生根诱导。在培养基相同条件下,红花檵木生根数与生根率均以NAA 0.4mg/L+IAA 3mg/L处理最大,根系长、粗壮且直接来源于茎的根系多,有利于红花檵木生根诱导及后期的炼苗移栽。由此可知,红花檵木生根诱导最佳培养基配方为1/2MS+NAA 0.4mg/L+IAA 3mg/L。

表3 两种激素的不同浓度配比和培养基对红花檵木生根诱导的影响Tab.3 Effects of different medium and hormonal formulas on rooting performance
2.4 不同基质对红花檵木组培苗移栽成活率的影响
不同基质上,红花檵木组培苗移栽成活率调查结果见表4。由表4可知,不同基质对红花檵木组培苗炼苗移栽成活株数和成活率影响不同。c处理下红花檵木组培苗移栽成活株数和成活率较其他处理高,分别为42株和84%,且植株生长健壮,叶片较为舒展,新根萌发数量多;其次是d处理,移栽成活株数和成活率分别为41株和82%,与c处理差异不显著;a处理移栽成活株数和成活率均高于b处理,由此说明,腐殖土较泥炭更适宜于红花檵木组培苗移栽成活。
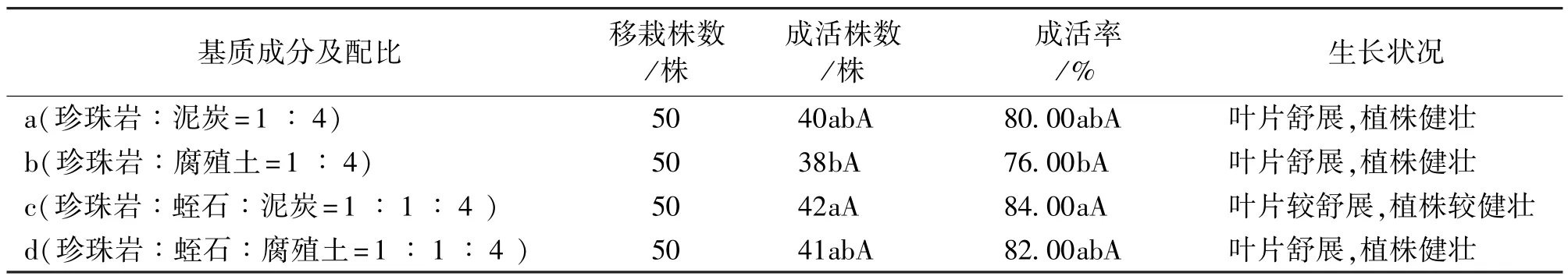
表4 不同基质对红花檵木组培苗移栽成活率的影响Tab.4 Effects of different substrates on the transplant survival rate of tissue cultured plantlets
3 结论与讨论
以当年生红花檵木幼嫩枝条茎段为外植体,研究外源激素及培养基类型对其丛芽诱导、丛芽增殖、生根培养的影响和不同基质对炼苗移栽的影响。研究结果表明:红花檵木幼嫩带节茎段作外植体能够实现微体快繁。丛芽诱导率最佳培养基配方为MS+6-BA 1.4mg/L+NAA 0.1mg/L,出芽数和诱导率分别为90个和90%;丛芽增殖培养基最佳为MS+6-BA 1.3mg/L+NAA 0.2mg/L,丛芽数和增殖系数分别为170株和3.4,MS+6-BA 2.0mg/L+NAA 0.2mg/L处理下丛芽数和增殖系数虽然最高,但丛芽玻璃化数及玻璃化率也最高,分别到达18个和36%;生根诱导最佳培养基配方为1/2MS+NAA 0.4mg/L+IAA 3mg/L,生根数和生根率最高,分别为45条和90%,且此时生根量多、根长且健壮;驯化移栽最适宜的基质配比为珍珠岩∶蛭石∶泥炭=1∶1∶4,成活株数为42株,成活率达到84%,幼苗叶片舒展,生长健壮,新根萌发数量多。
外源激素的是影响木本植物芽诱导效果的最主要因素之一[9],其种类、浓度及配比的不同对芽诱导的效果亦存在差异。叶添谋等[10]研究认为,B5+6-BA 1.0mg/L+蛋白胨0.1mg/L处理下红檵木丛芽诱导效果最好,诱导率达到70%。而本研究表明,在MS+6-BA 1.4mg/L+NAA 0.1mg/L条件下红檵木丛芽诱导效果最好,诱导率达到90%,这表明培养基中激素及浓度的不同对其丛芽诱导的效果存在差异。另外,还可以看出6-BA浓度1.4 mg/L的3个处理丛芽诱导率总体较高,这是因为6-BA是丛芽诱导的主要外源激素;而6-BA浓度一定时,低浓度的NAA处理下,丛芽诱导率相对较高,这可能是因为低浓度的NAA与6-BA的协同作用更佳[11]。
培养基中细胞分裂素类物质易使组培苗产生玻璃化现象[12]。尹恒等[13]研究认为,培养基中6-BA浓度大于2mg/L时红檵木玻璃化苗大量产生。本研究结果表明,在6-BA 2.0mg/L+NAA 0.1mg/L处理和6-BA 2.0mg/L+NAA 0.2mg/L处理下,丛芽顶部玻璃化现象最严重,玻璃化数量较其他处理高,本试验结果与前人一致。
吲哚乙酸 (IAA)是植物体内最常见的生长素类物质,根尖和茎尖产生的IAA运输到生根区,可以促进不定根和侧根的形成,因此IAA对不定根的形成有重要作用[14]。本试验条件下,在NAA浓度相同时,IAA 3.0mg/L的处理不定根发生数量均高于IAA 2.0mg/L的处理,证明IAA对不定根的形成有重要影响,其原因可能是IAA加快了呼吸链的转运速度,为茎基部生根提供了足够的能量[15],因而在一定浓度范围内,IAA浓度越高越有利于红花檵木诱导生根。文清岚等[16]研究指出,NAA与IAA合理组合较使用一种激素 (NAA或IAA)更利于杉木 (Cunninghamia lanceolata)组培苗生根,并认为杉木生根诱导以NAA 0.4mg/L+IAA 0.6mg/L处理效果最好。本研究结果表明,红花檵木生根诱导最佳配方为1/2MS+NAA 0.4mg/L+IAA 3.0mg/L,与文清岚等人在杉木组培苗生根诱导上使用的激素浓度不完全相同,应该是因为不同植物对生根诱导所需激素浓度存在差异所致。
组培苗移栽成活率和后期生长势是衡量组培快繁能否规模化生产的关键因素。本试验条件下,珍珠岩∶蛭石∶泥炭配比为1∶1∶4的处理红花檵木组培苗成活率达到84%,且组培苗生长健壮,能够实现红花檵木离体高效快繁,并用于红花檵木苗的规模化生产。另外,c处理和d处理均高于a处理和b处理,这可能是因为蛭石是硅酸盐材料经高温加热膨胀而成,具有较强的透气性和保水能力,有利于植物根系的萌发和生长。
