噬菌体文库与计算机模拟筛选H1N1流感病毒血凝素结合位点的比较①
2018-08-24李慧瑾连媛媛孙丽君孙晶莹曹慧玲
李慧瑾 连媛媛 孙丽君 孙晶莹 李 元 胡 军 曹慧玲
(陕西省缺血性心血管疾病重点实验室,西安医学院基础与转化医学研究所,西安 710021)
流行性感冒是一种由流感病毒感染引起的急性呼吸道传染病。在甲、乙、丙三种流感中以甲型流感的危害最为严重[1,2]。目前,流感的预防是一个全球性难题,疫苗接种仍是甲型流感的主要预防手段。流感病毒表面的糖蛋白血凝素(Hemagglutinin,HA),具有较强的免疫原性,可以刺激机体产生保护性抗体[3-5]。抗原表位的变异,使得机体先前获得的免疫无法对新的流感病毒发挥中和作用,是流感难以预防的重要原因[6,7]。因此,研究甲型流感病毒HA的结合位点,有助于为防控流感病毒的感染提供理论依据。
抗原表位的研究方法有多种[8-10],如:计算机模拟表位,噬菌体展示技术筛选多肽小分子,但每种方法都有它的局限性,目前尚无一种准确有效的方法取得公认的规范标准和实验证实。本研究以4株单克隆抗体作为研究对象,通过对噬菌体文库与计算机模拟筛选的H1N1流感病毒HA结合位点比较分析,旨在为H1亚型流感病毒的诊防治提供研究基础。
1 材料与方法
1.1实验材料、试剂 2009年甲型H1N1流感病毒裂解疫苗购自华兰生物疫苗有限公司;季节性H1N1流感病毒由大连雅利峰生物技术有限公司馈赠;4株单克隆抗体由本实验室制备;Ph.D.-12噬菌体展示肽库试剂盒购自NEB公司;HRP标记的山羊抗小鼠二抗由中杉金桥公司提供;总RNA提取试剂盒和cDNA第一链合成试剂盒由北京天根生物公司提供;PCR聚合酶、pMD19-T载体和DNA Marker购自大连TaKaRa公司;引物合成及测序由上海生物工程有限公司和北京华大六合基因有限公司完成。
1.2方法
1.2.1噬菌体展示文库的筛选 噬菌体展示文库的筛选根据试剂盒说明书(#E8110SC)操作。用前期制备的A1-8和H1-13单克隆抗体与其文库分别作用,将筛选获得的序列送公司测序并翻译为对应的氨基酸序列。
1.2.2抗体的制备 将合成的多肽分别与弗氏佐剂乳化混合均匀,皮下免疫BALB/c小鼠,每只注射量为20~25 μg。3周后,用同初次免疫完全相同的剂量和方法加强免疫1~2次,融合前的3 d用不含佐剂的抗原腹腔追加免疫1次。细胞融合方法见文献[11,12],间接ELISA法筛选分泌抗体的阳性细胞,有限稀释法进行亚克隆,建立稳定的杂交瘤细胞系。
1.2.3抗体的鉴定 抗体的Ig亚类鉴定采用SBA Clonotyping System/HRP抗体亚类鉴定试剂盒测定,具体操作同说明书。
1.2.4计算机模拟抗体结合位点 首先扩增并克隆获得单克隆抗体的轻链和重链可变区序列,通过Ig Blast翻译找出对应的氨基酸序列。根据获得的氨基酸序列与中科院生物物理研究所生物信息学研究组获得的HA的晶体结构,预测抗原抗体结合位点,具体的预测方法参见文献[13]。
2 结果
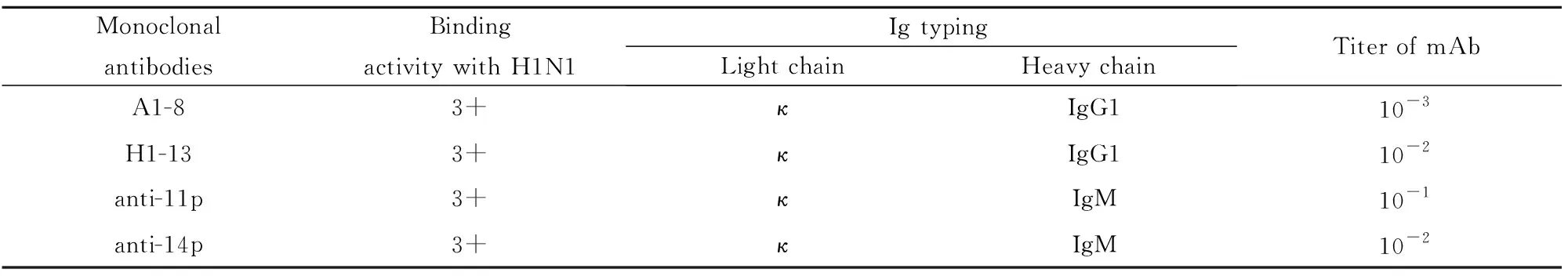
2.1抗体特性鉴定 从之前制备的84株H1N1单克隆抗体中,选取抗H1N1-HA的特异性单克隆抗体A1-8和具有交叉反应的代表性抗体H1-13,进行后续的分析。为了验证抗体与抗原的结合,根据2009年H1N1的HA序列,合成两段短肽(11p:包含WGIHH序列;14p:包含WYGYHH序列),并制备其抗小鼠的单克隆抗体,分别将其命名为anti-11p和anti-14p。对制备的单克隆抗体进行了与2009年H1N1流感病毒的结合活性、Ig亚类及抗体效价的测定,结果如表1所示。其中抗体Ig亚类鉴定结果显示,4株抗体的轻链均为κ链,A1-8和H1-13重链均为IgG1,anti-11p 和anti-14p 重链均为IgM。A1-8的抗体效价为10-3,anti-11p的抗体效价为10-1,anti-14p和H1-13的抗体效价为10-2。
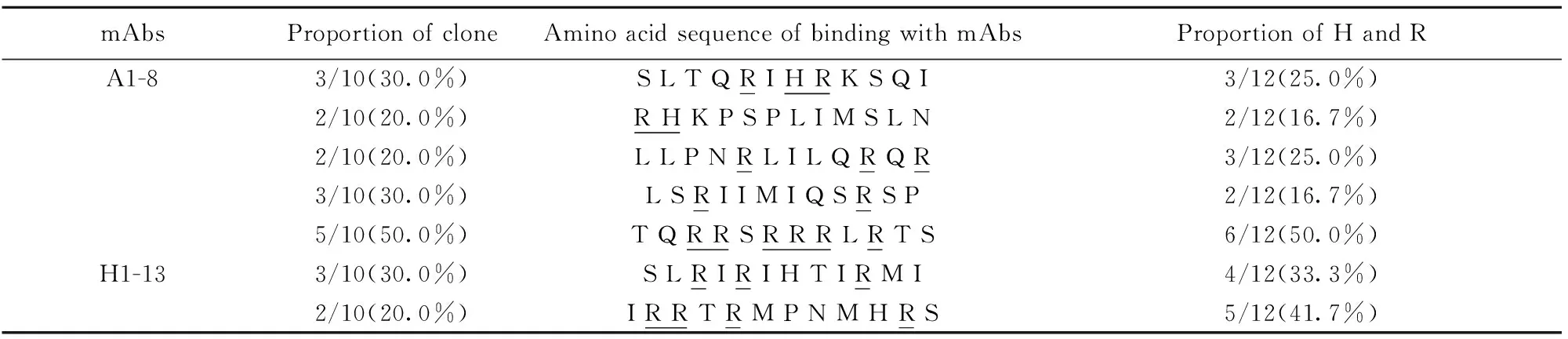
2.2噬菌体文库筛选获得抗体结合的氨基酸位点 通过12肽的噬菌体展示文库对抗体结合的序列进行筛选,每组抗体筛选10个克隆。并且对序列中的组氨酸(Histone,H)及精氨酸(Arginine,R)所占的比例进行分析。结果如表2所示,A1-8抗体结合的序列中H和R所占比例分别为25.0%、16.7%、25.0%和16.7%;H1-13抗体结合序列中H和R所占比例分别为50.0%、33.3%和41.7%(下划线示碱性氨基酸)。并且TQRRSRRRLRTS序列克隆数占总克隆数的比例高达50.0%。该筛选结果提示,H1-13与多种抗原产生的交叉反应性可能与其结合的R和H的比例较高有关。这和我们课题组预测的该抗体与多种含卟啉环结构的分子可发生反应的结果相吻合(数据未发表)。
2.34株流感病毒单克隆抗体的轻链和重链可变区氨基酸序列的克隆 合成11p和14p序列,免疫制备单克隆抗体,制备方法参考[11,12]。并且对4株抗体A1-8、H1-13、anti-11p和anti-14p的轻链和重链可变区序列进行了克隆,获得序列见表3。
表1H1N1-HA和短肽的抗体特征
Tab.1CharacterizationofantibodiesagainstH1N1-HAortwopeptides
MonoclonalantibodiesBindingactivity with H1N1Ig typingLight chainHeavy chainTiter of mAbA1-83+κIgG110-3H1-133+κIgG110-2anti-11p3+κIgM10-1anti-14p3+κIgM10-2
对4株抗体轻链和重链可变区序列的相似性进行比对分析,结果(图1)显示:4株单克隆抗体轻链可变区的相似性为72.32%;重链可变区的相似性为71.22%。
2.4计算机模拟HA抗原上与抗体或多肽的结合位点 用计算机模拟分析抗体与1918年H1N1,2008年H1N1及2009年H1N1的血凝素结合的氨基酸位点。预测的抗体A1-8和anti-11p与HA结合位点完全一致;预测的H1-13和anti-14p与HA结合位点完全一致。对两组抗体与1918年H1N1-HA的结合位点比较得出,如表4所示,A1-8组结合的HA位点(49-K,51-I,58-K,70-E,87-S,88-N,143-A,144-G,273-D,274-A,275-P,276-V)包含H1-13组结合的所有抗原位点(51-I,87-S,88-N,143-A,144-G);H1-13组结合的所有抗原位点(48-G,49-V,57-C,69-C,70-E,86-S,273-P,274-V)包含A1-8组结合的HA位点(48-G,49-V,67-P,271-D,273-P,274-V)中的48-G、49-V、273-P和274-V共4个位点。
表2噬菌体文库筛选的抗体结合位点
Tab.2Bindingsitesofantibodiesbyphagedisplay
mAbsProportion of clone Amino acid sequence of binding with mAbsProportion of H and R A1-83/10(30.0%)S L T Q R I H R K S Q I3/12(25.0%)2/10(20.0%)R H K P S P L I M S L N2/12(16.7%)2/10(20.0%)L L P N R L I L Q R Q R3/12(25.0%)3/10(30.0%)L S R I I M I Q S R S P2/12(16.7%)5/10(50.0%)T Q R R S R R R L R T S6/12(50.0%)H1-133/10(30.0%)S L R I R I H T I R M I4/12(33.3%)2/10(20.0%)I R R T R M P N M H R S5/12(41.7%)
Note:The underlining represents basic amino acids.
表34株流感H1N1抗体的可变区序列
Tab.3AminoacidsequenceoffourmAbsvaribleregionsagainstH1N1-HA
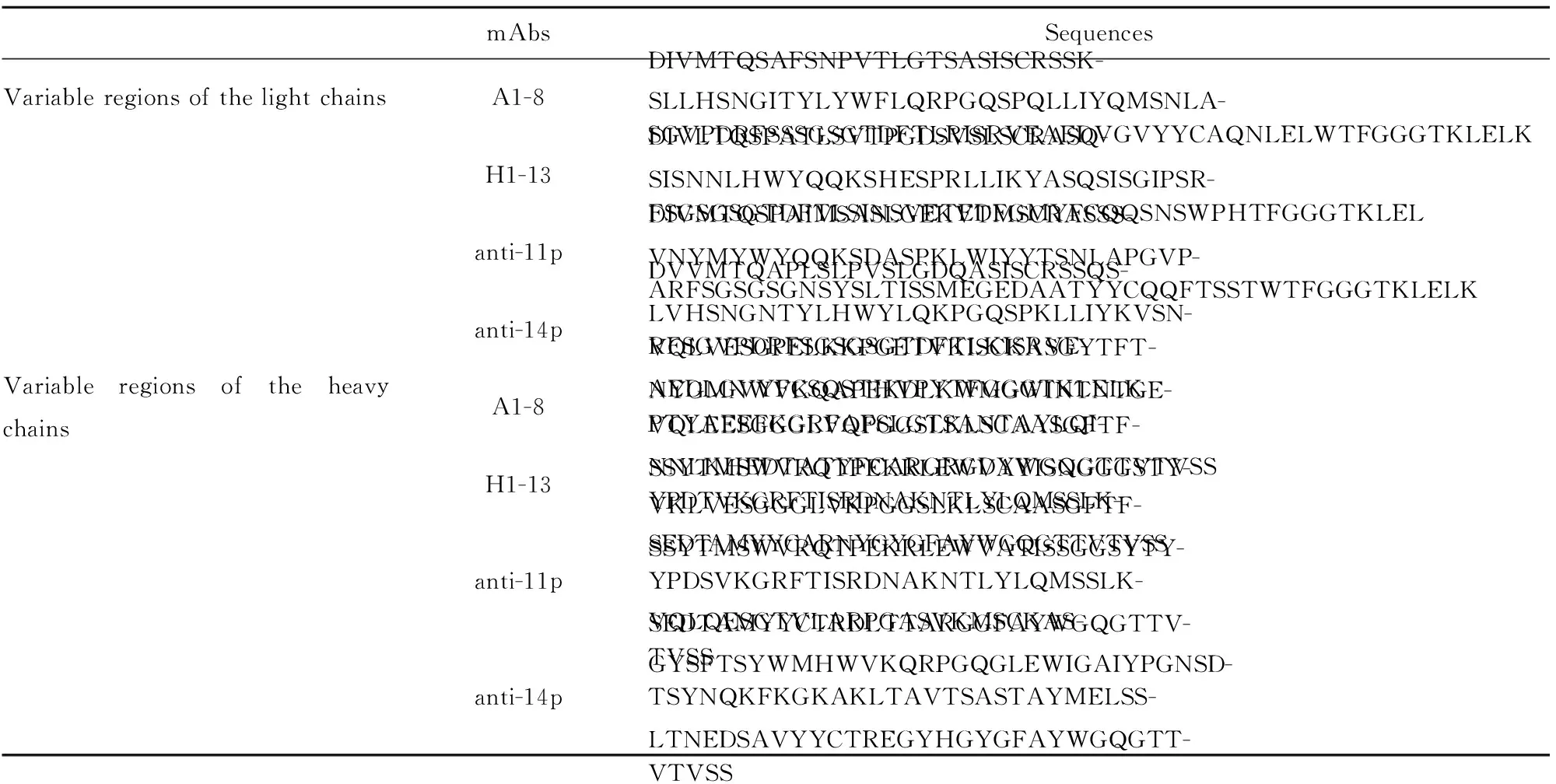
mAbsSequencesVariable regions of the light chainsA1-8 DIVMTQSAFSNPVTLGTSASISCRSSK-SLLHSNGITYLYWFLQRPGQSPQLLIYQMSNLA-SGVPDRFSSSGSGTDFTLRISRVEAEDVGVYYCAQNLELWTFGGGTKLELKH1-13DIVLTQSPATLSVTPGDSVSLSCRASQ-SISNNLHWYQQKSHESPRLLIKYASQSISGIPSR-FSGSGSGTDFTLSINSVETEDFGMYFCQQSNSWPHTFGGGTKLELanti-11p DIVMTQSPAIMSASLGEKVTMSCRASSS-VNYMYWYQQKSDASPKLWIYYTSNLAPGVP-ARFSGSGSGNSYSLTISSMEGEDAATYYCQQFTSSTWTFGGGTKLELKanti-14pDVVMTQAPLSLPVSLGDQASISCRSSQS-LVHSNGNTYLHWYLQKPGQSPKLLIYKVSN-RFSGVPDRFSGSGSGTDFTLKISRVE-AEDLGVYFCSQSTHVPYTFGGGTKLELKVariable regions of the heavy chainsA1-8 VQLVESGPELKKPGETVKISCKASGYTFT-NYGMNWVKQAPEKDLKWMGWINTNTGE-PTYAEEFKGRFAFSLGTSANTAYLQI-NNLKHEDTATYFCARGRGDYWGQGTTVTVSSH1-13VQLEESGGGLVQPGGSLKLSCAASGFTF-SSYTMSWVRQTPEKRLEWVAYISNGGGSTY-YPDTVKGRFTISRDNAKNTLYLQMSSLK-SEDTAMYYCARNYGYGFAYWGQGTTVTVSSanti-11p VKLVESGGGLVKPGGSLKLSCAASGFTF-SSYTMSWVRQTPEKRLEWVATISSGGSYTY-YPDSVKGRFTISRDNAKNTLYLQMSSLK-SEDTAMYYCTRDLTTARGGFAYWGQGTTV-TVSSanti-14pVQLQESGTVLARPGASVKMSCKAS-GYSFTSYWMHWVKQRPGQGLEWIGAIYPGNSD-TSYNQKFKGKAKLTAVTSASTAYMELSS-LTNEDSAVYYCTREGYHGYGFAYWGQGTT-VTVSS

图1 4株单克隆抗体的氨基酸序列的相似性分析Fig.1 Similarity of amino acid sequences among four mAbsNote:A.Light chain of variable region;B.Heavy chain of variable region.
表4计算机模拟HA抗原上与抗体或多肽的结合位点
Tab.4BindingsitesofthreeantibodiesonHAantigenbycomputermodeling
mAbsHA binding epitopes1918 H1N12009 H1N1A1-849-K,51-I,58-K,70-E,87-S,88-N,143-A,144-G,273-D,274-A,275-P,276-V48-G,49-V,67-P,271-D,273-P,274-VH1-1351-I,87-S,88-N,143-A,144-G48-G,49-V,57-C,69-C,70-E,86-S,273-P,274-Vanti-11p51-I,87-S,88-N,143-A,144-G48-G,49-V,57-C,69-C,70-E,86-S,273-P,274-Vanti-14p49-K,51-I,58-K,70-E,87-S,88-N,143-A,144-G,273-D,274-A,275-P,276-V48-G,49-V,67-P,271-D,273-P,274-V
3 讨论
接种流感疫苗是预防流感病毒流行的最主要手段[14-16],甲型流感疫苗的有效性已得到证实,安全性却受到质疑[17,18],从而影响了它的广泛推广及应用。计算机抗原表位预测是依据抗原包含的氨基酸的物理性质和空间结构来进行预测,但其预测出的抗原表位能否刺激机体产生抗体,与抗原本身的空间结构和机体的免疫状态等多种因素有关[19],所以该方法预测出的抗原表位有一定的局限性。模拟表位可作为抗原的小分子模拟物,其具有分子量小、稳定性强及无内毒素等优点[20],可以在一定程度上诱导产生天然抗原引起的特异性体液免疫,这为疫苗的设计制备提供了新的思路。噬菌体展示文库技术由于其具有容量大、作用体积小、可多次扩增等优点,从而在模拟表位的初步筛选中被广泛采用[21]。用制备的抗体作为筛选配体,对噬菌体展示文库进行特异性筛选,有望从中获得目标蛋白的模拟表位。但噬菌体展示文库也存在缺点,如:在筛选模拟表位时,由于少数多肽的疏水性过强从而导致噬菌体表面展示的不足;肽库容量不够高等缺点。因此,本文通过结合噬菌体展示技术和计算机模拟筛选技术,对4株抗体结合的抗原表位进行比较,取得了较为理想的预测结果。首先,对前期制备的单克隆抗体进行了筛选,选取了一株针对H1N1-HA的特异性单克隆抗体A1-8,与多种HA结合的有交叉反应性的单克隆抗体H1-13。通过噬菌体展示技术对两株抗体结合的多肽进行淘选,结果显示与A1-8结合的10个克隆中多肽的氨基酸没有典型的特征,而与H1-13结合的10个克隆的多肽中H和R所占的比例较高,并且富含H和R最多的一组多肽TQRRSRRRLRTS的克隆数占总克隆数的比例高达50.0%,提示,H1-13与多种抗原产生的交叉反应性可能与其结合的R和H的比例较高有关。并且该结果提示和我们课题组预测的该抗体与多种含卟啉环结构的分子可发生反应的结果相吻合(数据未发表)。其次,我们根据此段序列的氨基酸特征,并结合2009年H1N1流感病毒的血凝素HA序列,合成了两段多肽,分别为富含组氨酸H的两段序列(11p:包含WGIHH序列;14p:包含WYGYHH序列)。将合成的多肽分别免疫小鼠制备单克隆抗体,并对两株抗体的特性进行分析,结果提示anti-14p相比anti-11p抗体效价,H1-13相比A1-8的效价均低一个数量级,这可能和抗体的交叉反应性有关。相对于其他两株并对A1-8、H1-13、anti-11p和anti-14p共4株单克隆抗体的轻链和重链可变区序列进行克隆。最后,考虑到2009年H1N1流感与1918年H1N1流感的相似性[22],我们采用计算机模拟技术,对4株单克隆抗体的轻重链可变区的氨基酸序列分别与2009年H1N1和1918年H1N1的HA的晶体结构分析,得出结论,A1-8和anti-14p结合的HA抗原序列相一致,H1-13和anti-11p结合的HA抗原序列相一致。此结果提示噬菌体展示技术和计算机模拟筛选的抗原表位,在一定程度上是重合的。
综上所述,本研究通过将噬菌体展示文库技术和计算机模拟技术相结合筛选抗体抗原结合位点,为后期研究抗原致病机理提供了实验基础。
