FGF2人源化单抗E12及其联合顺铂/紫杉醇体外抑制乳腺癌细胞增殖作用的研究①
2018-08-24黄建芳向军俭
张 宇 黄建芳 徐 萌 王 宏 向军俭
(暨南大学抗体工程研究中心,生命科学技术学院生物工程学系,广东省分子免疫与抗体工程重点实验室,广州 510632)
FGF2即bFGF(Basic fibroblast growth factor,碱性成纤维细胞生长因子),是生理和病理条件下细胞生长和分化的重要调节因子,在胚胎发育,组织再生,伤口修复和造血中发挥重要作用[1-3]。FGF2以低分子量和高分子量同种型存在[4]。低分子量FGF2是约18 kD蛋白质[5]。FGF2可由靶细胞分泌[6]。FGF2在由FGF2、FGFR和HSPG组成的三元复合物中相互作用,导致下游信号传导途径的激活[7]。目前已经确定了五种FGFRs[8],FGF2主要与FGFR1(Ⅲc)结合,而与其他FGFR结合则较弱[9]。
FGF2和FGFR在正常细胞中的表达受到高度调控,然而FGF2/FGFR的扩增和/或上调发生在许多肿瘤中[10]。FGF2/FGFR上调与多种肿瘤类型患者预后不良有关[11]。由基质成纤维细胞分泌的FGF2通过FGFR旁分泌信号传导诱导肿瘤细胞增殖,肿瘤内的成纤维细胞也可被内皮细胞和肿瘤细胞分泌的FGF2激活[12,13]。同时FGF2也是一种有效的促血管生成生长因子[14]。
目前研究表明,FGF2可作为有效的肿瘤治疗靶标,Anouma等[15]第一次发现并报道了FGF2单抗在体内和体外实验中对肿瘤的生长抑制作用。本实验室多年前获得的FGF2单抗MabF7对B16细胞的体外抑制作用呈剂量及时间累计效应,抑制率为(39±4.12)%,P<0.01[16]。向军俭等[17]也证明了FGF2单抗MabF7的抗肿瘤以及抗血管新生作用。此后罗镇明[18]成功筛选出了能稳定分泌靶向FGF2-FGFR1结合位点单抗,在体内外抑制了Lewis′肺癌的增殖。陈文慧等[19]发现FGF2 mAb能抑制MCF-7/ADM细胞增殖并逆转其多药耐药。除了FGF2抗体的单独使用,本实验室研究还发现了顺铂联合FGF2单抗对黑色素瘤细胞B16和Colo细胞有明显的联合抑制效应[20]。张国军等[21]则发现FGF2单抗MabF7与替吉奥S-1两者联合作用具有联合诱导凋亡的作用。除了抗体与化疗联用,曾世彬等[22]证实了FGF2mAb联合放疗对B16移植瘤具有协同抑瘤效应,提高放疗敏感性。除了抗体与放化疗联合使用,胡鹏辉等[23]发现125I-FGF2mAb能显著抑制肝癌移植瘤的生长,标记125I的FGF2mAb对肝癌的抑瘤效果强于联合运用125I和FGF2mAb。
本研究旨在由项目组中山生物医药有限公司对鼠源FGF2单抗运用3D技术进行人源化改造,获得人源化FGF2单抗。本研究拟进行人源化FGF2单抗E12及其联合顺铂和紫杉醇对人源乳腺癌细胞株MDA-MB453以及MCF-7的细胞增殖抑制以及促凋亡作用;并运用生物信息学的方法对抗体进行表位分析,探究E12生物学活性分子机制,为FGF2抗体药物研发提供前期基础。
1 材料与方法
1.1材料
1.1.1主要试剂 胎牛血清(Gemini);0.25%胰蛋白酶、DMEM培养液(Gibco);CCK-8试剂盒、流式细胞凋亡检测试剂盒(上海同仁化学研究所);MTT、二甲基亚砜、紫杉醇(ASGENE);顺铂(江苏豪森药业);鼠源FGF2单抗(本实验室制备并保存);重组人FGF2、兔抗鼠IgG-HRP、兔抗人IgG-HRP(北京鼎国生物技术有限公司)。
1.1.2细胞株 MCF-7,MDA-MB453肿瘤细胞株为本实验室传代保存。
1.2方法
1.2.1FGF2单抗人源化改造情况分析 使用IMGT数据库进行序列比对来计算抗体可变区人源氨基酸来源比率。
1.2.2人源化单抗E12的纯度鉴定 制备SDS-PAGE分离胶,再在其上方配置浓缩胶,待浓缩胶凝固之后,将胶板置于电泳缓冲液中,将人源化单抗加入适量的Loading Buffer,煮样后上样。纯化的人源化单抗E12、BSA和蛋白Marker分别加入到泳道中进行电泳,电泳完成之后取下分离胶放置于染色液中染色过夜。之后放入加有脱色液的脱色盒中,待可以清晰地看到蛋白条带,利用凝胶成像仪进行图像采集。
1.2.3间接ELISA检测E12与FGF2的结合活性 使用包被液将浓度为1.81 mg/ml的FGF2抗原稀释至400 ng/ml,向ELISA板条中每孔加入100 μl液体,4℃包被过夜。除包被液,PBS-T洗涤3次,3 min/次(下同),加入5%脱脂奶粉溶液,于37℃条件下,封闭1 h。除封闭液,PBS-T洗涤3次,用PBS倍比稀释人源化抗体E12和鼠源抗体E12,浓度依次为1、0.33、0.11、0.037、0.012、0.004 1和0.001 3 μg/ml,分别取100 μl加入ELISA酶标板中,37℃恒温箱中孵育1 h。除一抗液体,PBS-T洗涤3次。抗FGF2人源性单抗E12组每孔加入100 μl兔抗人IgG二抗稀释液,鼠抗FGF2单抗E12组每孔加入100 μl兔抗鼠二抗稀释液,置于37℃恒温箱,孵育45 min。除二抗液体,PBS-T,洗涤5次后每孔加入100 μl的TMB显色底物,避光反应10 min,每孔加入50 μl终止液,并立即于酶标仪中测定OD450 nm 处的吸光值为最终的结果。
1.2.4BCA法检测E12的蛋白浓度 配置标准工作液,设置BCA浓度分别为0、0.025、0.05、0.1、0.2、0.4、0.6和0.8 mg/ml。在ELISA板孔中按照25 μl/孔的量向孔中依次加入预先配置好的标准液以及不同稀释比例的目的蛋白液。根据BCA要求将试剂盒中的AB液按照A∶B=50∶1的配置比例配置工作液,将配置好的AB混合液加入到ELISA板中每孔200 μl,然后置于37℃的恒温箱中避光反应30 min,测570 nm的OD值,设置不含BCA的组为空白对照。
1.2.5CCK-8法检测E12对乳腺癌细胞株的细胞增殖抑制作用 取生长良好的细胞铺板,24 h之后更换低血清浓度维持培养基,使用维持培养基稀释抗体药物进行加药,加入人源化抗体的浓度设置为500、250、125和 62.5 μg/ml,同时加入鼠源的FGF2单抗500 μg/ml作为阳性对照。于加药后72 h 在450 nm吸光度下进行检测。并将OD值转换为抑制率,计算公式为:抑制率=(空白组OD值-实验组OD值)/空白组OD值×100%,然后使用Prism7软件进行绘图。
1.2.6CCK-8法检测E12联合化疗药物对乳腺癌细胞株的细胞增殖抑制作用 取生长良好的细胞铺板,24 h之后更换低血清浓度维持培养基,使用低血清浓度维持培养基稀释药物进行加药,对于顺铂来说,两株细胞的顺铂浓度相同,设置单独加入顺铂组:浓度为0、0.625、2.5和10 μg/ml,单独加单抗组:单抗药物浓度设置为150 μg/ml,顺铂和单抗联合组:单抗药物浓度设置为150 μg/ml,化疗药物浓度设置为0、0.625、2.5、10 μg/ml。MCF-7单独加紫杉醇组:浓度调整为0、1.0、0.1、和0.01 μg/ml;单独加单抗组:单抗药物浓度设置为150 μg/ml,紫杉醇和单抗联合组:单抗药物浓度设置为150 μg/ml,化疗药物浓度设置为0、1.0、0.1和0.01 μg/ml。MDA-MB453细胞株设置单独加紫杉醇组:浓度调整为0、0.1、0.01、0.001 μg/ml,单独加单抗组,单抗药物浓度设置为150 μg/ml;紫杉醇和单抗联合组:单抗药物浓度设置为150 μg/ml化疗药物浓度设置为0、0.1、0.01和0.001 μg/ml。于加药后72 h在450 nm吸光度下进行检测。并将OD值转换为抑制率,计算公式为:抑制率=(空白组OD450 nm-实验组OD450 nm)/空白组OD450 nm×100%,然后使用Prism7进行绘图。
1.2.7流式细胞术检测E12联合化疗药物诱导乳腺癌细胞株的凋亡 取生长良好的细胞铺板,铺板24 h之后,使用10%FBS的DMEM完全培养基稀释药物进行加药,加药设置:对于MCF-7细胞株来说,FGF2单抗单独组为150 μg/ml,顺铂单独组为0.5 μg/ml,单抗顺铂联合组为单抗150 μg/ml+顺铂0.5 μg/ml,紫杉醇单独组为0.1 μg/ml,单抗紫杉醇联合组为单抗150 μg/ml+紫杉醇0.1 μg/ml;对于MDA-MB453细胞株来说,FGF2单抗单独组为150 μg/ml,顺铂单独组为3 μg/ml,单抗顺铂联合组为单抗150 μg/ml+顺铂3 μg/ml,紫杉醇单独组为0.01 μg/ml,单抗紫杉醇联合组为单抗150 μg/ml+紫杉醇0.01 μg/ml;实验均设置空白对照,加药后置于细胞培养箱中继续培养 48 h。药物处理48 h后消化细胞,加入到流式管中,然后加入PBS洗涤,条件为1 000 r/min离心5 min,离心同时配制流式凋亡检测Buffer和FITC-PI流式双染工作液,每只管分别加入100 μl FITC-PI流式双染工作液,混匀后避光染色15 min,上机前每只管再补充100 μl的流式凋亡检测Buffer,混匀后立即检测,使用FlowJo X 10.0.7r2软件分析数据并绘图。
1.2.8E12的生物信息学表位分析 使用Discovery Studio 4.5的Create Homology Models模块对FGF2进行同源建模。使用Model Antibody进行抗体可变区的同源建模,选择DOPE Score最低的结构作为下一步使用。使用Dock and Analyze Protein Complexes模块进行抗原抗体的分子对接,最终使用打分最靠前的POSE作为最终的结果。使用Analyze Protein Interface模块来对抗原表位进行分析。使用Analyze Protein Interface模块分析FGF2-FGFR1-肝素三元复合物结构的X-射线衍射晶体结构,来鉴定FGF2的生物活性部位。最终使用R语言对FGF2抗体表位氨基酸与FGF2分子生物活性部位取交集并绘制韦恩图,确定抗体是否封闭了FGF2的生物活性部位,来对抗体的生物学活性的机理进行解释。
1.3统计学分析 采用 Graph Pad Prism 7.0 软件进行t检验,分析不同组别数据间统计学差异,P<0.05为差异有统计学意义。
2 结果
2.1FGF2单抗E12人源化改造情况统计 人源化抗体改造情况统计见表1,与抗人FGF2鼠源抗体相比,人源化抗体的重链可变区与轻链可变区分别进行了26个和15个氨基酸突变,仅在抗体重链可变区残留一个非人源胚系基因的氨基酸位点,重链和轻链的CDR区分别为32和17个氨基酸。最终得到的人源化抗体的人类序列来源比率为重链达到98.89%,轻链达到了100.00%,结果显示最终得到的是高度的人源化抗体,非常接近全人源抗体。
2.2人源化单抗E12的纯度鉴定 使用SDS-PAGE和HPLC对抗体的纯度鉴定结果可以看出人源化抗体E12在还原条件下经过SDS-PAGE后,分开成两条清晰的条带,分子量分别在50 kD和25 kD附近,并且没有明显的杂带(见图1A),这说明前期实验成功纯化得到了抗体,并且抗体的纯度与完整性良好。使用HPLC技术对人源化FGF2单克隆抗体E12的纯度进行了分析,根据峰图结果显示,抗体的纯度为99.02%(见图1B),结果显示抗体的纯度较高。
表1FGF2单抗可变区人源化改造情况统计
Tab.1Statisticsofanti-humanFGF2monoclonalantibodyE12variableregion’shumanization
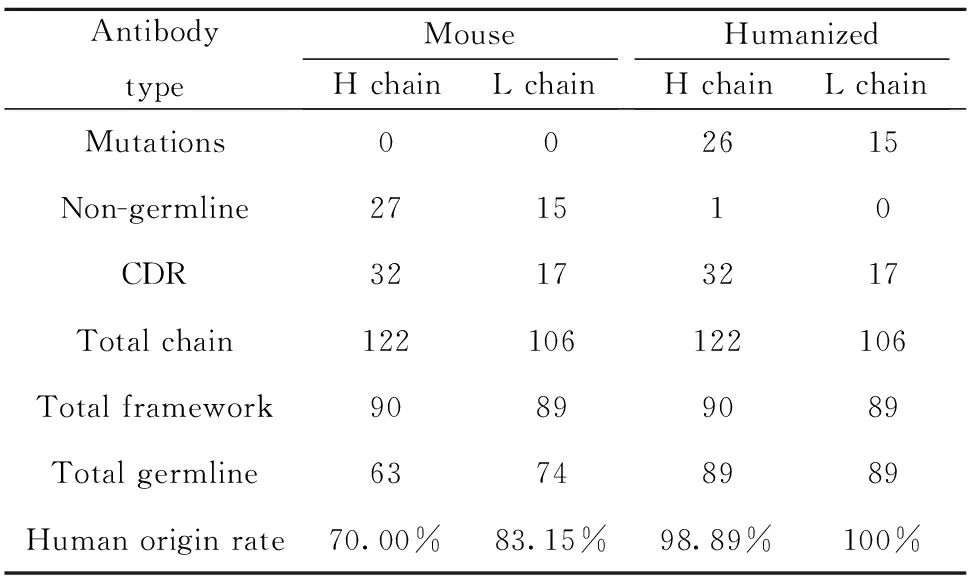
AntibodytypeMouseH chainL chainHumanizedH chainL chainMutations002615Non-germline271510CDR32173217Total chain122106122106Total framework90899089Total germline63748989Human origin rate70.00%83.15%98.89%100%
2.3间接ELISA检测FGF2人源化单抗E12与FGF2的结合活性 图2表明使用ELISA测定FGF2人源化单抗与鼠源单抗的效价,人源化的FGF2单抗在稀释到浓度为0.004 μg/ml时,OD450 nm值还处在1左右,效价约为1/243 000,说明了人源化抗体E12可以与FGF2进行很好的结合,保留了鼠源抗体的绝大多数活性。
2.4BCA法测定人源化FGF2单抗E12的蛋白浓度 通过BCA法建立的蛋白浓度标准曲线如图3所示,计算得标准曲线的R2为0.992,显示所建立的标准曲线良好,经检测并带入方程计算,得到人源化FGF2单抗的蛋白浓度为8.74 mg/ml,蛋白浓度较高。

图1 人源化FGF2抗体E12的纯度鉴定Fig.1 Purity identification of humanized FGF2 antib-ody E12Note:A.SDS-PAGE of antibody;1.BSA;M.Marker;2.Humanized antibody E12;B.Result of HPLC.
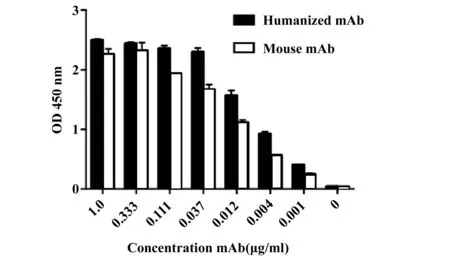
图2 ELISA检测FGF2单克隆抗体的效价Fig.2 Detection of titer of FGF2 monoclonal antibody by ELISA
2.5CCK-8法检测E12对乳腺癌细胞株的细胞增殖抑制作用 使用CCK-8法检测FGF2单抗对两株肿瘤细胞的抑制作用,如图4所示,发现FGF2人源化单抗E12对两株肿瘤细胞均有抑制作用,并发现抑制率呈浓度依赖性增长。在加入人源抗体为500 μg/ml的浓度时,抗体对乳腺癌细胞MCF-7的抑制率约为32%,抗体对乳腺癌细胞MDA-MB453的抑制率约为37%,同时人源抗体与设置的鼠源抗体阳性对照与具有相似的抑制率,在加入鼠源抗体阳性对照为500 μg/ml时,抗体对乳腺癌细胞MCF-7的抑制率约为33%,抗体对乳腺癌细胞MDA-MB453的抑制率约为38%,表明抗体在进行人源化改造以后,其生物学活性得到了绝大部分的保留。
2.6CCK-8法检测FGF2单抗E12联合化疗药物对乳腺癌细胞株的细胞增殖抑制作用 使用CCK-8法检测FGF2单抗E12与顺铂联合对两株肿瘤细胞的抑制作用,如图5所示,发现首先单抗(150 μg/ml)单独对两株肿瘤细胞均有抑制作用,其次化疗药物单独对两株肿瘤细胞也均有抑制作用,而且抑制率呈浓度依赖增长。
在顺铂浓度分别为0.625、2.5、5、10 μg/ml 的时候,单抗和顺铂联合组比顺铂单独组对MCF-7细胞的抑制率分别提高了14.5%、10.4%、1.5%和0.5%。对MDA-MB453细胞的抑制率分别提高了15.5%、14.8%、13.0%和6.8%。在紫杉醇浓度分别为1.0、0.1和0.01 μg/ml时,单抗和紫杉醇联合组比紫杉醇单独组对MCF-7细胞的抑制率的分别提高了约14.5%、11.1%和9.3%。在紫杉醇浓度分别为0.1、0.01和0.001 μg/ml时,单抗和紫杉醇联合组比紫杉醇单独组对MDA-MB468细胞的抑制率分别提高了约18.6%、19.9%和6.8%。

图3 BCA法检测人源化FGF2单抗E12的蛋白浓度Fig.3 Detection of protein concentration of humanized FGF2 monoclonal antibody by BCA
本研究发现FGF2单抗E12与化疗药物联合组比化疗药物单独组有更强的抑制作用,经过t检验,两组之间差异具有统计学意义(P<0.05),即FGF2单抗和化疗药物对肿瘤细胞的抑制具有联合增效作用。
2.7流式细胞术检测FGF2单抗E12联合化疗药物诱导乳腺癌细胞株的凋亡 用流式细胞仪检测,对于MCF-7细胞株,如图6A,空白对照组晚期凋亡率为1.97%,FGF2单抗处理组为8.10%,顺铂单独处理组为9.33%,FGF2单抗+顺铂的联合组为14.80%,与空白对照组相比,使用FGF2单抗,顺铂单独处理以及FGF2单抗+顺铂的联合组处理的MCF-7细胞在Annexin V/PI双阳性区域所占比例有明显提高,其中以联合组最为明显。
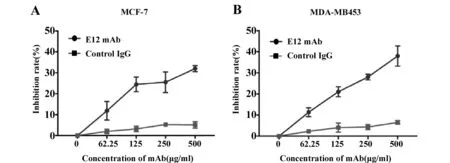
图4 FGF2单抗E12单独抑制肿瘤细胞MCF-7、MDA-MB453的细胞增殖Fig.4 FGF2 antibody alone inhibits cell proliferation of tumor cells MCF-7,MDA-MB453
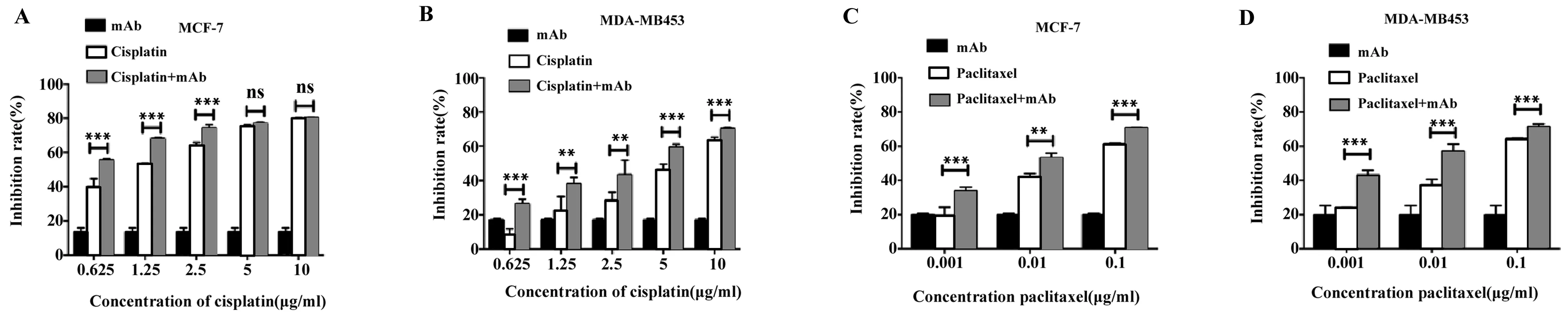
图5 FGF2单抗E12与顺铂联合化疗药物抑制乳腺癌肿瘤细胞的细胞增殖Fig.5 FGF2 monoclonal antibody combined with chemotherapy drugs inhibits cell proliferation of breast cancer cell-lines
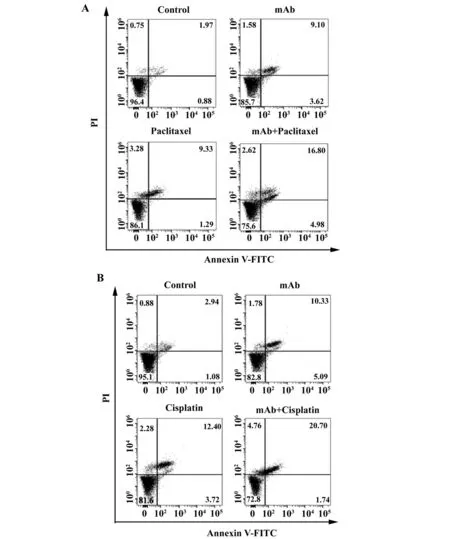
图6 流式细胞仪检测FGF2单抗联合化疗药物诱导MCF-7细胞株凋亡Fig.6 Detection of apoptosis of MCF-7 cell line induced by FGF2 monoclonal antibody and chemotherapy by flow cytometry
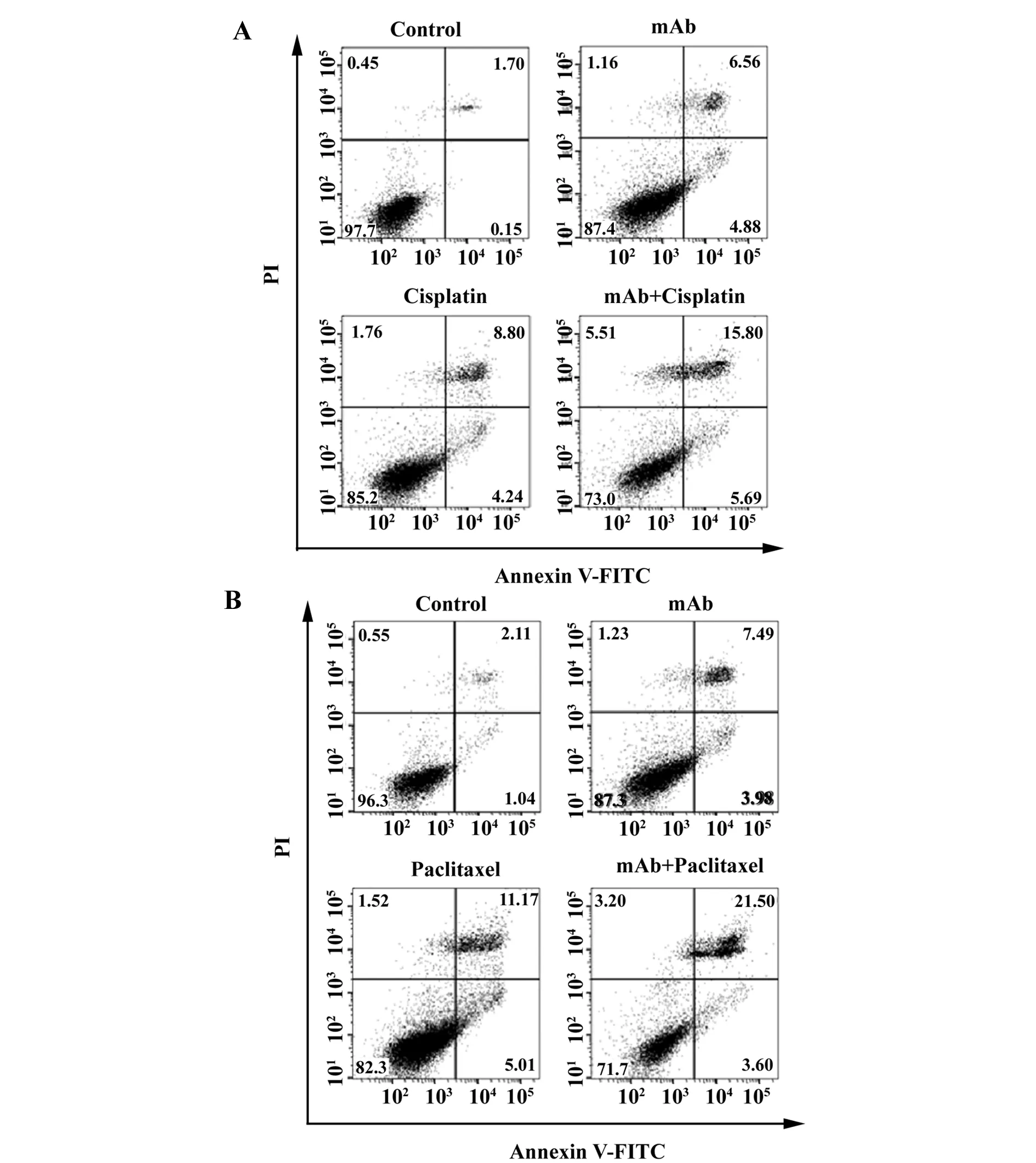
图7 流式细胞仪检测FGF2单抗联合化疗药物诱导MDA-MB453细胞株凋亡Fig.7 Detection of apoptosis of MDA-MB453 cell line induced by FGF2 monoclonal antibody and chemotherapy by flow cytometry

图8 抗原抗体分子对接以及表位分析Fig.8 Antigen-antibody docking and epitope analysis
同理,对于MCF-7细胞株,如图6B,空白对照组晚期凋亡率为2.94%,FGF2单抗处理组为9.33%,紫杉醇单独处理组为12.40%,FGF2单抗+紫杉醇的联合组为20.70%,与空白对照组相比,使用FGF2单抗,紫杉醇单独处理以及FGF2单抗+紫杉醇的联合组处理的MCF-7细胞在Annexin V/PI双阳性区域所占比例有明显提高,其中以联合组最为明显。
用流式细胞仪检测,对于MDA-MB453细胞株,如图7A,空白对照组晚期凋亡率为1.7%,FGF2单抗处理组为6.56%,顺铂单独处理组为8.8%,FGF2单抗+顺铂的联合组为15.8%,与空白对照组相比,使用FGF2单抗,顺铂单独处理以及FGF2单抗+顺铂的联合组处理的MDA-MB453细胞在Annexin V/PI双阳性区域所占比例有明显提高,其中以联合组最为明显。
同理,对于MDA-MB453细胞株,如图7B,空白对照组Annexin V/PI双阳性区域所占比例(晚期凋亡率)为2.11%,FGF2单抗处理组为7.49%,紫杉醇单独处理组为11.17%,FGF2单抗+紫杉醇的联合组为21.5%,与空白对照组相比,使用FGF2单抗,紫杉醇单独处理以及FGF2单抗+紫杉醇的联合组处理的MDA-MB453细胞在Annexin V/PI双阳性区域所占比例有明显提高,其中以联合组最为明显。
2.8FGF2人源化单抗E12的生物信息学表位分析 根据分子对接的结果如图8所示,可见抗原抗体形成的是氨基酸序列上不连续的构象表位。分析抗原抗体结合界面上的表位,显示L:ASN28,H:VAL38等氨基酸为结合界面上抗体的表位,包括轻链的7个氨基酸和重链的13个氨基酸。FGF2:HIS16等氨基酸为结合界面上FGF2的表位。共21个氨基酸。根据从PDB数据库获取的FGF2-HSPG-FGFR1三元复合物的晶体结构,分析FGF2分子的生物活性部位,显示FGF2:HIS16等氨基酸为FGF2分子的生物活性部位。
通过对抗体表位与FGF2生物学活性位点进行比较,本研究发现了抗体结合到FGF2上面的位置共21个氨基酸,其中有9个氨基酸是处于FGF2的生物活性位点的部位,即抗体部分封闭了FGF2的生物活性部位,从而部分阻止了FGF2和FGFR以及HSPG的结合,起到了中和FGF2生物学活性的作用。
3 讨论
鼠源性可引发HAMA反应,对于鼠源抗体来说,人源化是其一个非常重要的步骤。本研究表明,已获人源化FGF2单抗抗体可变区人类抗体氨基酸序列来源比率为重链达到98.89%,轻链达到了100.00%,人源化程度高,可有效降低HAMA反应,与鼠源抗体相比具有较明显的优势。
本实验室多年以来应用制备FGF2鼠源性单抗,发现在体内外均可有效抑制肿瘤细胞的生长。在后续的研究中,本实验室也尝试了化疗药物联合FGF2鼠源性单抗的研究,发现于体内外化疗药物联合FGF2单抗可以获得联合增效作用。因此在本研究中利用已获FGF2高度人源化单抗,使用了均为人体来源的MCF-7和MDA-MB453肿瘤细胞株,证实了单抗联合化疗药物顺铂和紫杉醇,具有抑制肿瘤细胞的增殖并促进肿瘤细胞凋亡的联合增效作用,这为联合用药增效机制的研究提供了基础。
本研究后续通过生物信息学方法对单抗表位进行分析,通过抗体表位于生物活性部位相比较,发现抗体部分封闭了FGF2的生物学活性位点,解释了抗体的生物活性机理。
本研究初步证实了人源化FGF2单抗联合化疗药物可有效抑制乳腺癌细胞株MCF-7和MDA-MB453的细胞增殖并促进细胞凋亡,后续研究可进行抗体联合化疗药物对肿瘤细胞株抑制的体内实验,并进一步探究抗体联合化疗药物对肿瘤细胞株抑制联合增强作用的信号通路机制。
