光照强度CO2体积分数和氮源质量浓度对小球藻干质量积累的影响
2018-08-24黄冬丽王福彬吴柳芬
黄冬丽,王福彬,吴柳芬
(西北民族大学生命科学与工程学院,甘肃兰州 730124)
0 引言
小球藻 (Chlorella spp) 为绿藻门 (Chlorop Hyta) 小球藻属(Chlorella) 球形单细胞淡水藻类,是地球上最早的生命之一,其细胞内光合作用色素丰富,因此具有较强的光合作用生产能力[1]。已有研究表明,小球藻细胞内含有丰富的多糖、蛋白质、色素、维生素、矿物质等,被广泛应用于食品加工、医疗保健、环境保护、基因工程等行业,一直以来都是研究热点。胡月薇[2]在研究中发现蛋白核小球藻粉对小鼠吞噬细胞活性有重要影响;纪雁[3]在研究中发现小球藻通过光合作用在味精废水处理中发挥重要功能;魏文志[4]在研究中发现小球藻蛋白在预防肿瘤中发挥重要作用。
多种环境因素,如光照强度、温度、pH值、CO2体积分数、氮源质量浓度等都能对小球藻的生长产生影响,其中光照强度、氮源质量浓度和CO2体积分数对小球藻生长起着尤为重要的作用[5-6]。光照强度和CO2体积分数主要影响小球藻的光合作用,而氮源主要影响小球藻生物量的积累[2]。试验通过设置不同梯度的光照强度、氮源质量浓度和CO2体积分数,并采用标准曲线法求出藻细胞干质量,通过藻细胞干质量的积累量对小球藻的生长效果进行评估,以期为小球藻培养条件的优化研究提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 主要材料与试剂
蛋白核小球藻(Chlorella pyrenoidosa),购自中国科学院武汉水生生物研究所,所选用的培养基是经过改良的f/2培养基。
f/2培养基的配方:CH4N2O(尿素) 0.5 g/L,K2HPO40.04 g/L,MgSO4·7H2O 0.075 g/L,FeCl3·6H2O 0.036g/L,Na2CO30.02g/L,EDTA0.001g/L,C6H8FeNO7(柠檬酸铁铵) 0.006 g/L,微量元素A5溶液1 mL,pH值7.5。
A5 溶液:H3BO42.86 g/L,MnCl2·4H2O 1.81 g/L,ZnSO40.222 g/L, Na2MoO40.39 g/L, CuSO4·5H2O 0.079 g/L,CO(NO3)2·6H2O 0.049 g/L,所有试剂均购自国药集团化学试剂有限公司。
1.1.2 主要仪器
YXQ-LS-100SII-01-00型立式压力蒸汽灭菌器,上海博迅医疗生物仪器股份有限公司产品;GEN10S型紫外可见分光光度计,赛摩飞世尔科技(中国)有限公司产品;AR224CN型电子天平,常州奥豪斯仪器有限公司产品;DG-9146A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司产品;SW-CJ-1F型超净工作台,苏州安泰空气技术有限公司产品;TES 1332A型照度计(中国台湾);MD-SYJ型照明设备,中山市欧普照明有限公司产品;气体质量流量计,北京首科实华自动化设备有限公司产品。
1.2 试验方法
1.2.1 培养基的配制
根据培养基的配方准确称取试验药品,先配制成母液,待试验时将母液混合稀释后经高压灭菌即可制成微藻培养基。
1.2.2 培养条件
培养温度25±1℃,光暗周期12 h/12 h,CO2体积分数用气体流量计控制。
1.2.3 标准曲线的绘制
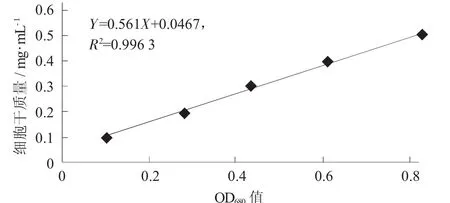
取指数生长末期的藻液1 L,稀释至5个不同质量浓度后于波长680 nm处测OD值,然后将每个质量浓度的样品平均分成3份,用真空抽滤泵将其抽滤到玻璃纤维膜上,然后放入电热鼓风干燥箱中于105℃条件下烘干至恒质量。称质量后减去玻璃纤维膜的质量即得样品干质量。取3份样品的平均值即为该质量浓度下样品的干质量,并结合样品体积,计算其细胞干质量(mg/mL)。以OD680为X轴、藻细胞干质量为Y轴,绘制藻细胞干质量标准曲线。
(1)小球藻细胞干质量的标准曲线。
蛋白核小球藻细胞干质量-OD680标准曲线见图1。
2 结果与分析
2.1 光照强度对小球藻细胞干质量积累的影响
在培养温度25℃,CO2体积分数15%,氮源质量浓度0.5 g/L的条件下,只改变光照强度为2.5×103,5.0×103,7.5×103lx,对小球藻进行光照培养。每隔24 h对小球藻进行取样测吸光度并通过标准曲线求出其细胞干质量,并对结果进行分析。
光照强度对小球藻细胞干质量积累的影响见图2。
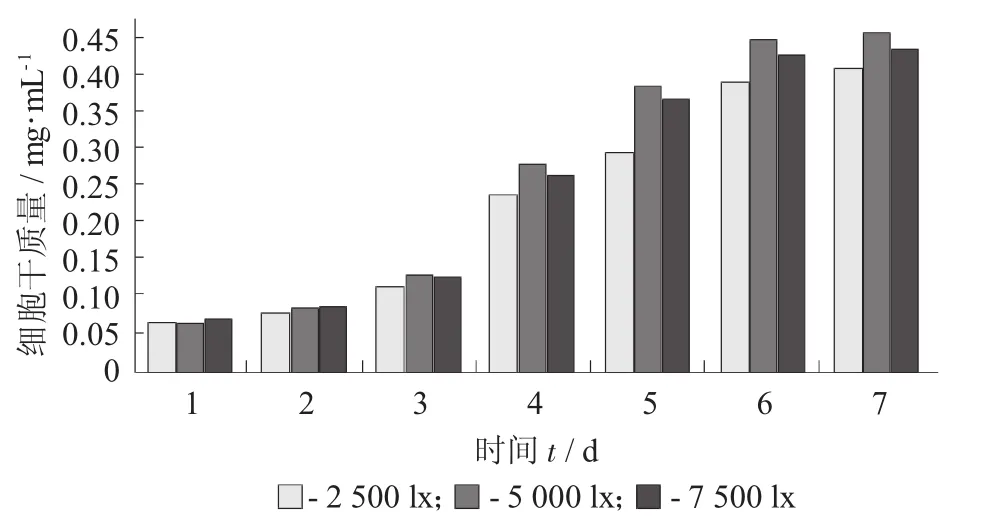
图2 光照强度对小球藻细胞干质量积累的影响
在光照强度为5×103lx时,小球藻的细胞干质量积累量最高。由图2可知,在小球藻生长前期,光照强度对小球藻干质量的积累影响不明显,不同强度光照下的小球藻细胞干质量差距不明显;随着细胞生长进入对数生长期,光照强度对小球藻细胞干质量的积累的影响显著增加,不同强度光照下的小球藻细胞干质量差距明显拉大[8]。对比图2中数据可以发现,小球藻在光照强度为7.5×103lx时的生长状况没有光照强度为5.0×103lx时好,表明过强的光照反而会抑制小球藻的生长。
2.2 CO2体积分数对小球藻细胞干质量积累的影响
在培养温度25℃,光照强度5.0×103lx,氮源质量浓度0.5 g/L的条件下,通过气体流量计控制CO2体积分数为5%,10%,15%,20%,对小球藻进行光照培养。每隔24 h对小球藻进行取样测吸光度,并通过标准曲线求出其细胞干质量,并对结果进行分析。
CO2体积分数对小球藻细胞干质量积累的影响见图3。

图3 CO2体积分数对小球藻细胞干质量积累的影响
在CO2体积分数为15%时,小球藻的细胞干质量积累量最高。由图3可知,4种不同体积分数的CO2条件下,CO2体积分数15%时生长的小球藻干物质积累量显著高于其他3种。初始3 d内,4种培养条件下的小球藻干质量积累增长较慢,此时小球藻可能处于潜伏生长期[9]。在4~6 d时,小球藻生长旺盛,干质量迅速积累,CO2体积分数15%培养条件下的小球藻细胞干质量积累量明显高于其他3种。当CO2体积分数达到20%,小球藻在对数生长期的细胞干质量积累量明显低于其他3种,说明CO2体积分数过高反而会抑制小球藻的生长。
2.3 氮源质量浓度对小球藻细胞干质量积累的影响
在控制培养温度为25℃,CO2体积分数为15%,光照强度为5.0×103lx,只改变氮源质量浓度为0.5,1.0,1.5 g/L,对小球藻进行光照培养。每隔24 h对小球藻进行取样测吸光度,通过标准曲线求出其细胞干质量,并对结果进行分析。
氮源质量浓度对小球藻细胞干质量积累的影响见图4。
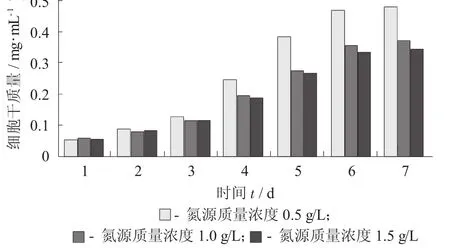
图4 氮源质量浓度对小球藻细胞干质量积累的影响
在氮源质量浓度为0.5 g/L时,小球藻的细胞干质量积累量最高。由图4可知,随着氮源质量浓度的升高,小球藻的细胞干质量的积累逐渐减少,这表明氮源质量浓度过高不利于小球藻的生长。在初始的3 d内,3种氮源质量浓度下的小球藻细胞干质量相差不大,说明氮源浓度对处于潜伏生长期的小球藻干重积累影响不大[10];在4~6 d时,小球藻进入对数生长期,此时需要合成大量蛋白质,故此时氮源质量浓度对小球藻的生长影响较大,在氮源质量浓度为0.5 g/L时的小球藻干质量积累量要明显高于其他2种条件。
3 讨论
光照强度、氮源质量浓度和CO2体积分数对小球藻的生长具有重要影响。其中光照强度和CO2体积分数主要影响小球藻的光合作用,而氮源质量浓度主要影响小球藻蛋白质的合成,这些因素的改变都会引起细胞干质量发生变化,因此研究利用细胞干质量的变化来反映小球藻的生长状况。
光照不仅是小球藻光合作用所必须的条件,而且调节小球藻的整个生长发育过程,以便小球藻能更好地适应外界环境。光照强度通过影响小球藻对无机碳的亲和力间接对小球藻的生长发挥作用,而藻类细胞中无机碳的积累和运输都需要能量的驱动,能量的来源与光系统Ⅰ中的电子流密切相关。研究中通过对光照条件的控制,来探讨光照强度对小球藻细胞生长的影响。结果表明,在一定的范围内,适当地增加光照强度对小球藻的生长有促进作用;但当光照强度达到最适值5.0×103lx后,再增加光照强度,反而会引起小球藻细胞内无机碳的相对耗竭,从而抑制微藻的生长[10]。
CO2参与小球藻的光合作用过程,通过碳同化途径变成有机物,从而使小球藻细胞干质量增加。CO2体积分数主要通过影响小球藻光合作用过程CO2浓缩机制中对无机碳的利用间接影响小球藻生长发育。研究中通过控制CO2的体积分数来对小球藻的生长条件进行探讨。结果表明,在合适的范围内,适当增加CO2体积分数有利于小球藻生物量的积累,导致藻细胞干质量明显增加;但是当CO2体积分数达到最适值15%时,再提高CO2体积分数反而会导致小球藻对无机碳的亲和力下降,对小球藻的生长不利[12]。
氮源是小球藻蛋白质合成过程中的重要原料,不同质量浓度的氮源会影响小球藻的蛋白质合成,间接影响小球藻的生长发育。研究中选用尿素作为氮源,通过控制尿素的质量浓度来对小球藻的生长条件进行探讨。结果表明,在3种氮源培养条件下,氮源质量浓度为0.5 g/L时最利于小球藻生物量的积累,而高质量浓度的氮源会导致培养基的pH值升高,从而会抑制小球藻的生长[13]。
4 结论
在小球藻的培养过程中,光照强度5.0×103lx,CO2体积分数15%,氮源质量浓度0.5 g/L时有利于促进小球藻的生长和对无机碳的利用,使小球藻细胞干质量的积累量增加。研究通过对不同培养条件下小球藻细胞干质量的测量,从而对小球藻的生长状况进行评估,并从中选出合适的光照强度、CO2体积分数和氮源质量浓度,以期为今后小球藻培养条件优化的相关研究提供参考依据。
[参]考文献:
[1]孔维宝,李龙囡,张继,等. 小球藻的营养保健功能及其在食品工业中的应用[J] .食品科学,2010,31(9):323-328.
[3]胡月薇.异养蛋白核小球藻营养成分分析和免疫活性功能评价 [D].武汉:华中农业大学,2003.
[4]纪雁.利用味精废水培养普通小球藻以及养藻废水的生物强化处理 [D].济南:山东大学,2014.
[5]魏文志.小球藻糖蛋白的分离纯化与体外预防肿瘤作用筛选的研究 [D].无锡:江南大学,2008.沈佳,李亚鹤,张琳,等.蛋白核小球藻生长和无机碳
[6]利用对不同光照强度和CO2浓度的响应 [J].植物生态学报,2016,40(9):933-941.
[7]郎筱宇.小球藻油脂积累的环境调控及生理机制研究 [D].海口:海南大学,2017.刘加慧,杨洪帅,王辉.温度、盐度和pH对小球藻生长
[8]率的联合效应 [J].水生生物学报,2014,38(3):446-453.卢碧林,祁亮,李明习.光温培养条件对小球藻
[9]Chlorella sp.生长及产物的影响 [J].可再生能源,2014,32 (10):1 527-1 533.陆贻超,王丽丽,刘双,等.CO2浓度对小球藻生长和
[10]生化组成的影响 [J].可再生能源,2013,31(7):64-68.Dhert P,Lavens P,Duray M,et al.Improved larval survival at metamorphosis of Asian seabass(Lates calcarife)r
[11]using ω -3-HUFA-enriched live food[J].Aquaculture,1990(1):63-74.欧阳峥嵘,温小斌,耿亚红,等.光照强度、温度、pH、
[12]盐度对小球藻(Chlorella) 光合作用的影响 [J].植物科学学报,2010,28(1):49-55.Schenk P M, Thomas-Hall S R, Stephens E, et al.Second generation biofuels:high-efficiency microalgae for
[13]biodiesel production[J].Bioenergy Research,2008 (1):20-43.朱义平,宋东辉,杨国兰.不同氮源对异养小球藻生物量
