猪伪狂犬病病毒和猪圆环病毒2型混合感染对仔猪肝肾损伤的研究
2018-08-23宋春莲谢相悦吴常月刘永波舒相华
张 雪,宋春莲,谢相悦,吴常月,刘永波,李 鑫,舒相华
(云南农业大学动物医学院,云南昆明 650201)
猪圆环病毒病是由猪圆环病毒2型(Porcine circovirus2,PCV2)引起的一种以体质下降、消瘦、贫血、黄疸及内脏器官、皮肤的广泛病理变化的综合征。2001年我国首次报道后,该病在我国的流行呈逐年上升趋势[1-2]。PCV2致病性较强,引起仔猪多种疾病,主要引起断奶仔猪多系统衰弱综合征(Post-weaning multisystemic wasting syndrome,PMWS)、皮炎和肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、增生性坏死性间质性肺炎和繁殖障碍[1]。猪伪狂犬病是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种以发热和脑脊髓炎为特征的急性传染病[1]。主要危害新生仔猪的呼吸系统、神经系统和消化系统,导致母猪繁殖障碍。我国猪群普遍存在PRV野毒感染,并呈散发性流行。近年来猪场PRV感染率逐年上升,严重制约养猪业发展[3-4]。PVC2和PRV二者混合感染可导致免疫抑制,使病情复杂化,增加了发病率,导致病死率激增,给养猪业造成巨大的经济损失[5-6]。PCV2和PRV混合感染的情况在云南地区部分猪群中比较严重,发生和流行情况有逐年加重的趋势[6],迫切需要对二者混合感染进行研究和有效预防。
PCV2和PRV的检测方法很多,其中实时荧光定量PCR(real-time PCR)具有准确、特异性强、敏感性高、快速及高通量等优点,并可以对病原进行定量检测,是许多实验室首选的检测手段。免疫组化诊断技术具有特异性强、敏感性高、定位准确、形态和功能相结合以及在抗原定位上的优势特点,因而可以用来观察病毒抗原的组织分布和细胞定位,可更好地理解病毒的致病机制[7-8]。肝脏是机体的解毒器官,也是酶合成及代谢的重要器官。当肝细胞损伤导致肝细胞坏死,通透性增加或者酶在肝内病理性合成亢进。肾脏是机体的排泄器官,可调节电解质浓度、体内水和渗透压平衡、酸碱平衡以及内分泌功能[9]。研究猪圆环病毒2型和猪伪狂犬病病毒混合感染对仔猪肝肾损伤有重要意义。
1 材料与方法
1.1 材料
1.1.1 试验用动物及病毒 公猪和母猪自然交配所产的32头2月龄仔猪,来自于云南文山山区,自繁自养,没有接种任何疫苗,经PCR检测PRV、PVC2、猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)均为阴性的。PRV和PCV2毒株,云南农业大学动物传染病实验室分离保存,病毒效价分别为1×106.5TCID50/mL和1×106TCID50/mL。
1.1.2 主要试剂及仪器 苏木精溶液、伊红溶液,自己配制;小鼠IgG SABC免疫组化染色试剂盒(批号:201510),博士德生物有限公司产品;DEPC(分析纯);DNA提取试剂盒;SYBR○RPrime ExTaqTMⅡ;PMD○R18-T Vector、琼脂粉、TAE缓冲液、异丙醇、氯仿、750 mL/L乙醇、质粒抽提试剂盒。
切片机,显微镜,水浴锅等,云南农业大学动物科学技术学院基础实验室提供;荧光定量PCR仪(CFD-3120),Bio-Rad公司产品;电泳仪(DYY-7C),北京六一仪器厂产品;实时荧光定量PCR仪移液器(KA0052521),DRAGON公司产品;高速冷冻离心机(75005440),Thermo Fisher Scientific公司产品;凝胶成像系统(Tanon-160000),上海天能科技有限公司产品;恒温水浴锅(HWS12),上海一恒科学仪器有限公司产品。
1.2 方法
1.2.1 试验分组及病毒接种 仔猪正常饲喂1周后,分成3个试验组(各10头)和对照组(2头),试验Ⅰ组仔猪颈部肌肉注射PRV悬液2 mL;试验Ⅱ组注射PCV2悬液 2 mL,试验Ⅲ组分别在仔猪颈部肌肉两侧注射PRV 1 mL和PCV2 1 mL(由于两个单感染组病毒总量均为2 mL,为使组别病毒总量相等故而将混合感染组中每个病毒量做了减半处理)。Ⅳ组2头为对照组,颈部肌肉注射生理盐水2 mL。
1.2.2 样品采集 攻毒后分别在第3、7、14、21、35天前腔静脉无菌采血后,随机宰杀2头试验仔猪,对照组在第35天宰杀,观察临床症状,病理剖检,无菌采集肝、肾组织样品2份,1份用40 mg/mL的甲醛溶液浸泡备用,另1份用于real-time PCR检测。
1.2.3 HE染色 参照HE病理染色技术操作步骤进行的染色[10]。
1.2.4 免疫组化染色 参照鼠IgG SABC免疫组化染色试剂盒说明书进行免疫组化染色。
1.2.5 实时荧光定量PCR的建立
1.2.5.1 引物设计 根据国内外发表的PCV2和PRV毒株序列,用Lasergene.v7.1、Primer Premier 5.0、Oligo6.0等分子生物学分析软件设计检测PRV和PCV2的引物,引物由上海生工生物工程技术服务有限公司合成。
1.2.5.2 标准曲线的建立 对SYBR Green Ⅰ qPCR的退火温度、引物浓度、反应时间等进行筛选优化,以得到最佳的real-time PCR反应条件,具体配置体系如下:PRV总反应体系20 μL,其中SYBRⅡ 10 μL,上游引物(F)0.8 μmol/L,下游引物(R)0.8 μmol/L,cDNA 2.0 μL, ddH2O补足20 μL。反应条件为:95℃ 2 min;95℃ 15 s,59℃ 20 s,65℃ 5 s,共35循环;PCV2总反应体系25 μL,其中包含Mix(含10×PCR buffer、dNTPs、TransTaq酶)12.5 μL,ddH2O 10.5 μL,上游引物(YH-1)0.5 μmol/L,下游引物(YH-2)0.5 μmol/L,模版cDNA1 μL。real-time PCR反应程序:94℃ 2 min;94℃ 15 s,60℃ 30 s,72℃ 40 s,共35循环。
1.2.5.3 real-time PCR准确性分析 与常规PCR比较,进行灵敏性试验;用实验室已经分离或保存的毒株或菌株分别提取蓝耳病毒(PRSSV)、猪瘟病毒(CSFV)、副猪嗜血杆菌(HPS)、伪狂犬病毒(PRV)核酸提取;利用提取的核酸作为模板进行特异性试验。
PRV进行PCR扩增反应,建立标准曲线。相关指数PRV(r2)为0.998,回归方程的拟合度较高,误差较小;扩增效率(E)为103.8%,扩增效率在正常的范围之内。根据检测结果得出Ct值与拷贝数之间的线性关系表达式:Ct=-3.232x+28.027(图1)。
PCV2进行PCR扩增反应,建立标准曲线。相关指数(r2)为1.000,回归方程的拟合度很高,误差很小;扩增效率(E)为92.7%。根据检测结果得出Ct值与拷贝数之间的线性关系表达式:Ct=-3.510x+32.996(图2)。
1.2.6 数据统计方法 应用IBM SPSS Statistics 20软件和Excel对数据进行统计与分析。
2 结果
2.1 临床症状及体温测定
3个感染组仔猪均在接毒12 h后出现体温升高,两个单独感染组接种病毒第20天之后趋于正常,混和感染组仔猪在接毒后第10天以后体温骤然下降,提示预后不良。感染组仔猪精神沉郁,食欲不振,第7天,临床症状较为明显, PRV感染组和混合感染组仔猪有共济失调,后肢瘫痪、犬坐式的神经症状及擦墙的痒症,在PCV2感染组仔猪腿部和腹部发现有黑色斑块;混合感染组第14天以后仔猪不能耐过有死亡猪只。
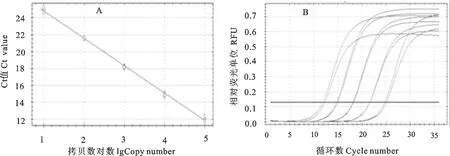
A.标准曲线;B.扩增曲线
A.Standard curve;B. Amplification curve
图1 PRV荧光定量PCR
Fig.1 Real-time fluorescent quantitative PCR of PRV

A.标准曲线;B.扩增曲线
A.Standard curve;B. Amplification curve
图2 PCV2实时荧光定量PCR
Fig.2 Real-time PCR of PCV2
2.2 大体病理变化
对照组仔猪肝脏肾脏均正常;试验组肝脏大体病理变化如图3,混合感染组肝脏表面分布的坏死灶多于两个单独感染组;肾脏大体病理变化如图4,混合感染组肾脏肿胀、肾盂出血、淤血,肾髓质肿胀、出血,髓质与皮质界限明显,出血量大于单独感染组。
2.3 病理组织学变化
对照组仔猪肝脏、肾脏均正常;试验组肝脏和肾脏病理组织学变化如图5和图6,可见PRV感染组肝细胞间质增宽,肝血窦内大量红细胞渗出;PCV2感染组肝组织汇管区大量出血,肝小叶边缘的细胞核溶解,有水泡样变性,巨噬细胞增多;肾小体内浆液渗出,远曲小管管腔增大,巨噬细胞增多。肾小体内大量出血,巨噬细胞聚集,近曲小管结构破坏,致密斑处巨噬细胞增多。混合感染组肝组织淤血较单独感染组严重,中央静脉模糊,红细胞破裂,肝血窦宽度扩大,肝细胞索紊乱,巨噬细胞增多,细胞核溶解消失(图5);肾小体内出血严重,远曲小管周围大量出血(图6)。
2.4 SABC染色结果
2.4.1 PRV阳性分布 PRV阳性主要分布于肝脏的汇管区及细胞间质,混合感染PRV阳性分布较单独感染高。单独感染组PRV阳性分布于肾小体周围的致密斑处,混合感染组肾小体以及周围管腔内均有大量PRV阳性分布(图7)。
2.4.2 PCV2阳性分布 肝和肾的阴性对照分别如图8A和D。PCV2主要分布于肝小叶边缘的肝血窦和细胞浆,以及肾脏的肾小体内和周围的近曲小管,混合感染组的阳性分布于管腔上皮细胞且面积大于单独感染组。
2.5 实时荧光定量PCR
从图9可知PRV单独感染组的肝脏病毒载量先升高后降低,在第3天达到峰值,为412.52拷贝/μL,与第0、14、21、35天比较,差异显著(P<0.05)。混合感染组肝脏病毒载量先升高再降低,然后再升高再降低。混合感染组肝脏病毒载量在第14天达到峰值,为1 907.52拷贝/μL,与第0、7、21、35天相比较,差异极显著(P<0.01)。肾脏的病毒载量先升高后降低,在第7天达到峰值,混合感染组在第14天才达到峰值938.97拷贝/μL,与其他时间比较,差异显著(P<0.05)。
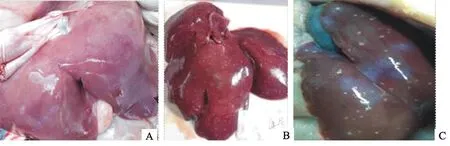
A.PRV单独感染组肝脏灰白色坏死灶; B.PCV2单独感染组肝脏表面有坏死点; C.混合感染组肝脏有坏死点和坏死斑
A.PRV infection group,liver gray necrosis spots;B.PCV2 infection group,liver surface necrosis points;C.Mixed infection group,liver necrosis spots
图3肝脏大体病理变化
Fig.3 Pathological lesions of liver

A.PRV感染组肾乳头肿胀,肾盂苍白; B.PCV2感染组肾乳头肿胀出血;C.混合感染组肾出血淤血
A.PRV infection group,renal papillary swelling;B.PCV2 infection group,renal papilla swelling and bleeding;C.Mixed infection group,renal hemorrhage,congestion
图4肾脏大体病理变化
Fig.4 Pathological lesions of kidney

A.PRV感染组肝血窦红细胞渗出;B.PCV2单独感染组肝脏汇管区大量出血; C.混合感染组肝小叶内大量红细胞渗出,肝细胞索
A.Hepatic cell red blood cell effusion in PRV infection group;B.Massive hemorrhage in liver confluence area of PCV2 infection group;C.Mixed infection group;massive red blood cell exudation in liver lobules;hepatic cords
图5仔猪肝脏病理组织学变化(HE,400×)
Fig.5 Histopathological lesions of liver in piglets(HE,400×)

A.PRV感染组远曲小管管腔增大;B.PCV2单独感染组肾小体内红细胞和巨噬细胞增多;C.混合感染组远曲小管大量出血
A.Increased lumen of the distal convoluted tubule in the PRV infection group;B.Increased red blood cells and macrophages in the renal corpuscle of the PCV2 infection group;C.Large hemorrhage in the distal convoluted tubule of the mixed infection group
图6仔猪肾脏病理组织学变化(HE,400×)
Fig.6 Histopathological lesions of kidney in piglets(HE,400×)

A.肝组织的阴性对照;B.PRV单独感染组阳性分布于肝组织汇管区;C.混合感染组PRV分布于肝细胞浆;D.肾组织的阴性对照;E.PRV单独感染组阳性分布于肾组织的致密斑处;F.混合感染组PRV分布于肾小体
A.Negative control of liver;B.PRV infection group was positive in hepatic tissue duct;C.Mixed infection group PRV was distributed in the cytoplasm of liver;D.Kidney tissue negative control;E.PRV infection group was positive distribution in the dense spots of renal tissue;F.Mixed infection group PRV distribution in the renal corpuscle
图7免疫组化染色定位PRV观察结果(SABC,400×)
Fig.7 Immunohistochemical staining for localization of PRV(SABC,400×)

A.PCV2单独感染组阳性分布于肝小叶边缘;B.混合感染组PCV2分布于肝细胞浆;C.PCV2单独感染组阳性分布于肾组织的肾小体;D混合感染组PCV2分布于管腔上皮细胞
A.PCV2 infection group was positive in the margin of hepatic lobule;B.Mixed infection group PCV2 was distributed in the cytoplasm of liver;C.PCV2 infection group was positive in renal tissue of renal corpuscle;D.Mixed infection group PCV2 distribution in luminal epithelial cells
图8免疫组化染色定位PCV2观察结果(SABC,400×)
Fig.8 Immunohistochemical staining for localization of PCV2(SABC,400×)
由图10可见,PCV2感染组肝脏内病毒含量先升高后降低,第7天达到峰值 58.18 拷贝/μL;混合感染组肝脏病毒载量呈先升高,再降低,然后再升高,再降低,在第14天达到峰值,为635.28拷贝/μL,且其峰值是单独感染PCV2峰值的10.9倍。PCV2感染组肾脏的病毒载量先升高后降低,在第14天达到峰值103.9拷贝/μL,混合感染组也在第14天达到峰值522.826 7拷贝/μL,此时混合感染组病毒载量是单独感染组的5倍。
3 讨论
本试验接毒后发现PCV2和PRV的混合感染后病情变得复杂,接毒后仔猪体温迅速升高,混合感染时体温在第10天迅速下降,低于正常值,表明PCV2和PRV可使仔猪抵抗力下降、迅速发病,混合感染则为新生仔猪发病率高、病死率高的重要原因。
PRV单独感染组出现仔猪共济失调、间歇性抽搐和擦墙的神经症状,腹泻与秦绪伟[11]研究结果相似;PCV2感染组有明显的PDNS体征,与贾静[12]研究结果相似。混合感染组仔猪既出现PRV感染所致的神经症状,也有PCV2所特有的PDNS体征,并伴有仔猪呼吸困难、咳嗽、发热、突然死亡等症状,与支霄刚[13]发现的野毒混合感染症状相似,说明PRV和PCV2单独感染对仔猪肝肾有损伤,混合感染损伤更甚,表明本试验数据具有临床参考价值。
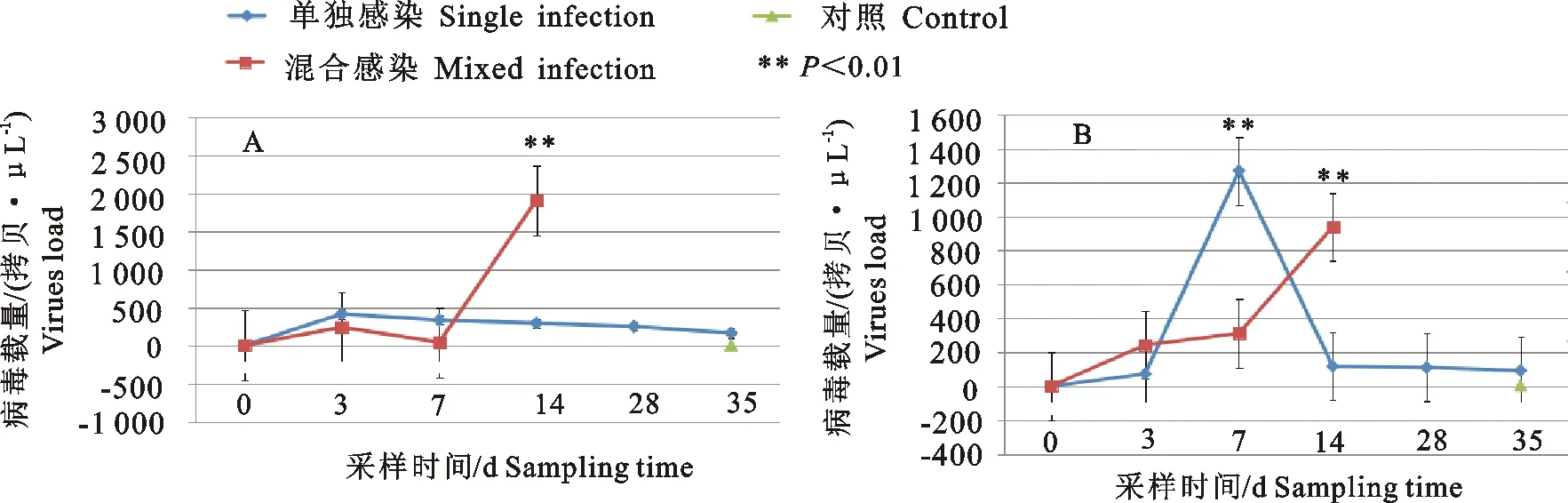
A.肝脏;B.肾脏
A.Liver;B.Kidney
图9感染仔猪肝肾PRV病毒载量变化图
Fig.9 Changes of PRV viral loads in liver,kidney and liver of infected pigs

A.肝脏;B.肾脏
A.Liver;B.Kidney
图10感染仔猪肝肾PCV2病毒载量变化
Fig.10 Changes of PCV2 viral load in liver,kidney and liver of infected pigs
PRV感染组剖检肝脏表面出现灰白色坏死灶,肾脏表面出血,与董筱萍等[14]对辽西地区规模化猪场猪伪狂犬病所做研究相似,本试验PRV单独感染组肾脏乳头肿胀出血,说明本试验的PRV对仔猪肾脏损伤较大。胡玲玲等[15]发现猪圆环病毒2型感染的仔猪出现肝脏有纤维素性增生膜,肾脏表而有针尖大小出血点及散在坏死点,本试验发现,PCV2感染组肾脏病理变化与其结果一致,但并未发现肝脏有纤维素性增生。可能存在地区差异导致PCV2感染后仔猪脏器受损不一致。混合感染组剖检变化与支霄刚所观察结果相似,对仔猪肝肾造成巨大的损伤。
组织病理检查发现,PRV单独感染组对肝肾组织的损伤与付强等[16]的结果相似;PCV2单独感染组对肝组织的损伤主要在肝小叶边缘以及肾组织的肾小球和管腔。混合感染对肝脏和肾脏的损伤程度大于两个单独感染组,可见猪伪狂犬病病毒和猪圆环病毒2型混合感染对仔猪危害极大。
原尿生成的结构基础是肾小球结构的完整,肾小管和集合管受神经体液因素调节,是机体调节水盐平衡和酸碱平衡的主要部位[17]。肝细胞中含有大量的枯否氏细胞,可通过吞噬有毒物质达到解毒效果[18]。本试验组织病理检查发现,PRV和PCV2单独感染可能造成仔猪解毒功能和排毒功能受损,与本试验结果相似。付强等[16]的结果表明,PRV对仔猪肝肾均有损伤,PRV和PCV2混合感染对仔猪肝肾损伤较单独感染严重。
Wen L B等[19]用免疫组化方法,在仔猪肾脏内未检测到PCV2的抗原,只在巨噬细胞中检测到了PCV2抗原。本试验检测到PCV2分布于肾脏的肾小体细胞质以及细胞浆内,可能由于本试验所用云南PCV2毒株毒力较强,可侵袭肾组织。PRV分布于肝细胞的细胞浆内。
实时荧光定量PCR灵敏度高、能够定量,用于本试验病毒载量的测定。单独感染组的肝肾PRV载量呈先升高后降低,肝脏载量在第3天达到峰值,肾脏载毒量则在第7天达到峰值,可能PRV的靶器官在病程发展过程中先是肝脏后为肾脏。混合感染组呈上升趋势,虽然在第14天才达到峰值,但是肝和肾病毒载量远高于单独感染组,且此时混合感染组仔猪已经全部死亡。肝肾PCV2的载量变化趋势同PRV载量。混合感染组肝肾载毒量均大于单独感染组,在第14天达到峰值。混合感染使疾病变得复杂,治疗变得更为困难。
