H5N1亚型禽流感病毒HA蛋白的原核表达
2018-08-23杨理凯郭苗苗杜伟立路宏朝
杨理凯,郭苗苗,杜伟立,丁 锐,王 令,张 涛,路宏朝
(陕西理工大学生物科学与工程学院,陕西汉中 723001)
禽流感病毒(Avian influenza virus,AIV)基因组由单股、负链、8个不连续片段的RNA组成,根据表面糖蛋白血凝素(hemagglutinin,HA)与神经氨酸酶(neuraminidase,NA)的抗原性差异,可进一步分为18种HA亚型和11种NA 亚型[1-2]。由于禽流感病毒能自然感染人、畜和禽等多种动物,其感染性强,容易突然暴发,引起大规模疫情,威胁公共卫生安全[3]。疫苗接种是预防流感病毒感染的有效方法,传统的病毒疫苗生产以鸡胚为载体,再经过灭活或裂解的方式处理病毒,获得疫苗[4-5]。传统方式生产的灭活或弱毒禽流感疫苗存在生物安全性差和有效抗原HA蛋白表达量低等问题[6],建立快速高效的流感病毒毒力因子HA蛋白的表达鉴定体系是解决后续疫苗生产的关键。大肠埃希菌原核表达系统具有成本低、周期短和表达量高等优点,成为表达外源基因的首选系统[7]。本试验以禽流感病毒H5N1的主要抗原HA作为研究对象,构建原核表达载体pET32a-HA,转化至大肠埃希菌Rosetta感受态细胞,观察IPTG浓度和诱导时间对HA表达的影响,从而探索最佳IPTG诱导浓度及诱导时间,以获得大量HA蛋白,为禽流感的诊断和疫苗的研制奠定基础。
1 材料与方法
1.1 材料
大肠埃希菌Rosetta菌株,Top10菌株,原核表达载体pET32a,pPIC3.5K-HA重组质粒,陕西理工大学分子遗传学实验室保存;T4 DNA连接酶,限制性内切酶BamHⅠ、EcoRⅠ,氨苄青霉素和异丙基硫代β-D-半乳糖苷(IPTG),宝生物工程(大连)有限公司产品;DNA Marker DL 2 000、低分子质量标准蛋白Protein Marker,Thermo Fisher公司产品;质粒提取试剂盒和DNA纯化试剂盒,BioFlux公司产品;鼠抗Flag单克隆抗体,Cell Signaling公司产品;羊抗鼠IgG抗体,康为世纪公司产品。
1.2 方法
1.2.1 pET32a-HA载体构建 本实验室保存的pPIC3.5K-HA载体含有禽流感病毒H5N1的HA基因(GenBank:MF116312.1)和Flag标签,EcoRⅠ和BamHⅠ双酶切pPIC3.5K-HA载体获得HA-Flag基因片段,克隆至原核表达载体pET32a。酶切体系如下:2 μg质粒DNA(pPIC3.5K-HA质粒/pET32a质粒),4 μL K buffer,各1.5 μLBamHⅠ和EcoRⅠ内切酶,补纯净水至40 μL。将上述酶切体系置于37℃水浴1 h,10 g/L琼脂糖凝胶电泳分别回收目的片段HA-Flag和骨架载体pET32a。通过T4 DNA连接酶将HA-Flag酶切片段和pET32a连接,连接产物转化至大肠埃希菌Top10感受态细胞,涂布LB平板(100 μg/mL 氨苄青霉素),筛选重组克隆。选择单克隆,提取质粒并酶切鉴定获得重组载体pET32a-HA。提取质粒,将重组质粒pET32a-HA转化至大肠埃希菌 Rosetta感受态细胞中,涂布LB平板(100 μg/mL氨苄青霉素),筛选重组菌株Rosetta/pET32a-HA。
1.2.2 pET32a-HA原核表达条件优化 将重组菌株Rosetta/pET32a-HA按照1∶100比例稀释后分别接种至3 mL LB液体培养基(100 μg/mL氨苄青霉素),于37℃培养至OD600约0.5,加入不同体积的IPTG(0.1 mol/L)使其终浓度分别为0、0.1、0.2、0.4、0.6、0.8、1.0、1.5、2 mmol/L,37℃诱导培养9 h。收集菌液,处理总蛋白,SDS-PAGE电泳分析HA蛋白表达情况,探索IPTG最佳诱导浓度。
将重组菌株Rosetta/pET32a-HA按照1∶100比例稀释后分别接种至3 mL LB液体培养基(100 μg/mL 氨苄青霉素),于37℃培养至OD600约0.5,加入6 μL IPTG(0.1 mol/L),分别诱导3、4、5、6、7、8、9、10、12、24 h,收集菌液,处理总蛋白,SDS-PAGE电泳分析蛋白表达情况,探索诱导表达最佳时间。
1.2.3 HA蛋白的表达检测及分析 离心收集诱导后细菌,加PBS重悬,加上样缓冲液后细胞悬液置于沸水浴10 min,迅速置于冰上冷却,然后于4℃、10 000 r/min离心10 min,取上清于-20℃保存备用。取蛋白上清液进行SDS-PAGE电泳,用考马斯亮蓝R250染色凝胶,用ImageJ软件分析蛋白表达情况。
1.2.4 Western blot分析 取蛋白上清液进行SDS-PAGE电泳,转移至硝酸纤维素膜,脱脂奶粉封闭膜4 h,1∶1 000稀释鼠抗Flag单克隆抗体作为一抗,4℃过夜孵育,TBST洗涤3次,用1∶2 000稀释辣根过氧化物酶(HRP)标记的羊抗鼠IgG单克隆抗体作为二抗,室温孵育2 h,TBST洗涤3次,用ECL化学发光试剂曝光,用Syngene化学发光成像系统检测。
2 结果
2.1 HA基因片段的获得
用EcoRⅠ、BamHⅠ双酶切pPIC3.5K-HA和pET32a,琼脂糖凝胶电泳检测酶切结果。其中泳道2约2 000 bp有一特异条带,与HA基因1 720 bp基本一致。比较泳道3、4可知,酶切后的pET32a被线性化,只有一条明显的DNA条带(图1)。

M.DNA标准DL 2 000;1.pIC3.5K-HA未切 ;2.双酶切pIC3.5K-HA;3.pET32a未切;4.双酶切 pET32a
M.DNA Marker DL 2 000;1.pIC3.5K-HA uncut;2.Double digestion of pIC3.5K-HA;3.pET32a uncut;4.Double digestion of pET32a
图1EcoRⅠ和BamHⅠ双酶切pPIC3.5K-HA和pET32a载体
Fig.1 pPIC3.5K-HA and pET32a byEcoRⅠ/BamHⅠdouble digestion
2.2 酶切鉴定重组载体pET32a-HA
将图1酶切获得的HA片段和pET32a质粒连接,连接产物转化Top10感受态细胞。挑取单克隆置于LB培养基,提取质粒。然后以BamHⅠ和EcoRⅠ双酶切鉴定,泳道2可见酶切后有一个DNA条带位于1 500 bp~2 000 bp之间(图2),与理论的HA片段大小相一致,说明HA基因成功插入pET32a载体,获得重组载体pET32a-HA。
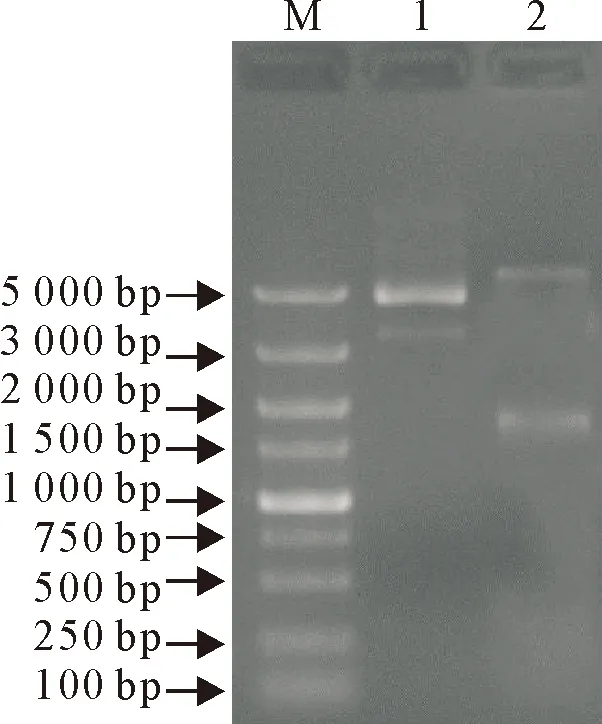
M.DNA标准DL 5 000;1.质粒未切;2.BamHⅠ和EcoRⅠ双酶切质粒
M.DNA Marker DL 5 000;1.Plasmid uncut;2.BamHⅠ andEcoRⅠ digestion of plasmid
图2重组载体酶切鉴定
Fig.2 Identification of recombinant vector by enzyme digestion
2.3 重组菌株原核表达条件优化及其检测
2.3.1 HA蛋白初步表达分析 将重组载体转化至大肠埃希菌Rosetta感受态细胞,涂布于含氨苄青霉素LB平板,然后挑取3个单克隆,诱导表达并收集菌液,取蛋白上清液,用SDS-PAGE电泳鉴定,泳道1为Rosetta菌株,泳道2、3为阴性对照,泳道4、5为1号克隆,泳道6、7为2号克隆,泳道8、9为3号克隆。结果表明,经IPTG诱导的3个克隆在70 ku~100 ku之间有一条特异蛋白条带(箭头所示),与理论蛋白84 ku的大小一致,其中HA蛋白65 ku,trxA 19 ku,而无IPTG诱导和空白对照组均未出现类似蛋白条带(图3)。
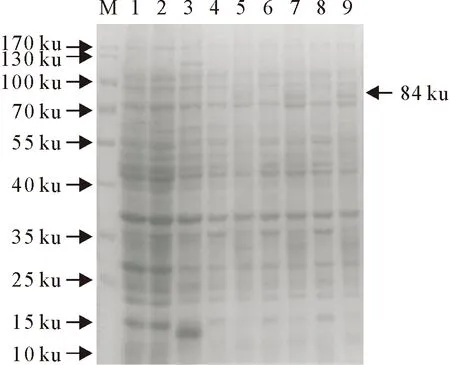
M.蛋白分子质量标准;1.Rosetta空菌;2.Rosetta/pET32a未诱导;3.Rosetta/pET32a诱导;4、6、8. 1、2、3号克隆未诱导;5、7、9. 1、2、3号克隆诱导
M.Protein molecular weight Marker;1.Rosetta bacteria;2.Rosetta/pET32a recombinant bacteria without induction;3.Rosetta/pET32a recombinant bacteria indued;4,6,8. 1#,2#,3# clones without induction;5,7,9. 1#,2#,3# clones indued
图3 SDS-PAGE检测重组蛋白
Fig.3 Detection of the recombinant protein by SDS-PAGE
2.3.2 不同IPTG浓度对HA蛋白表达的影响 取2号克隆的菌液扩大培养9份,采用不同IPTG终浓度诱导HA蛋白表达,SDS-PAGE电泳结果见图4。通过软件进行灰度分析,以目标蛋白/总蛋白比率评价HA蛋白表达水平,结果见图5和图6。数据表明,当IPTG浓度为0.1 mmol/L时,总蛋白含量为152 207,目标蛋白含量为7 510,HA蛋白占总蛋白表达量的4.9%,随着IPTG浓度的提高,目标蛋白占总蛋白的比率呈下降趋势,故0.1 mmol/L为最佳IPTG诱导浓度。
2.3.3 不同诱导时间对HA蛋白表达的影响 取2号克隆菌液扩大培养11份,不同诱导时间对HA蛋白表达水平的影响,SDS-PAGE电泳结果见图7。通过灰度分析HA蛋白相对表达量,结果见图8和图9。诱导9 h的总蛋白量相对表达量达到最大值248 462,目标蛋白量相对表达量为8 943,目标蛋白仅占总蛋白的3.6%,当诱导时间为6 h时,总蛋白相对表达量为130 750,目标蛋白量相对表达量达到6 737,目标蛋白占总蛋白的5.1%。随着诱导时间的延长,目标蛋白占总蛋白的比率呈先上升后下降趋势,因此最佳诱导时间为6 h。
2.3.4 重组菌株中HA基因表达鉴定 Western blot检测重组菌中HA的表达,以抗Flag的单克隆抗体为一抗,结果显示在70 ku~100 ku之间有一条特异蛋白条带与理论大小(84 ku)相一致,对照组未出现特异条带(图10),表明重组菌株成功表达了HA蛋白。
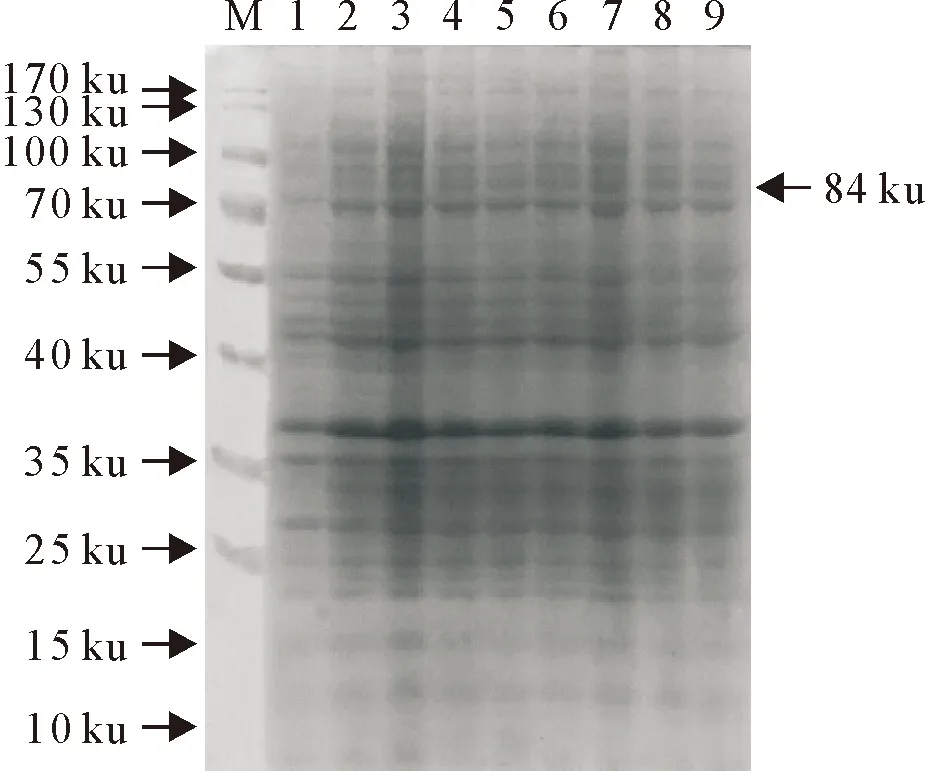
M.蛋白分子质量标准;1~9. 0、0.1、0.2、0.4、0.6、0.8、1.0、1.5、2.0 mmol/L IPTG诱导
M.Protein molecular weight Marker;1-9. 0,0.1,0.2,0.4,0.6,0.8,1.0,1.5,2.0 mmol/L IPTG inductions
图4不同浓度IPTG诱导目标蛋白SDS-PAGE结果
Fig.4 SDS-PAGE results of the target protein induced under different concentrations of IPTG

图5 不同浓度IPTG诱导目标蛋白的表达量

图6 不同浓度IPTG诱导目标蛋白与总蛋白比值

M.蛋白分子质量标准;1~11. 0、3、4、5、6、7、8、9、10、12、24 h
M.Protein molecular weight Marker;1-11. 0,3,4,5,6,7,8,9,10,12,24 h
图7不同诱导时间对目标蛋白表达影响的SDS-PAGE结果
Fig.7 SDS-PAGE results of the target protein expression under different induction time
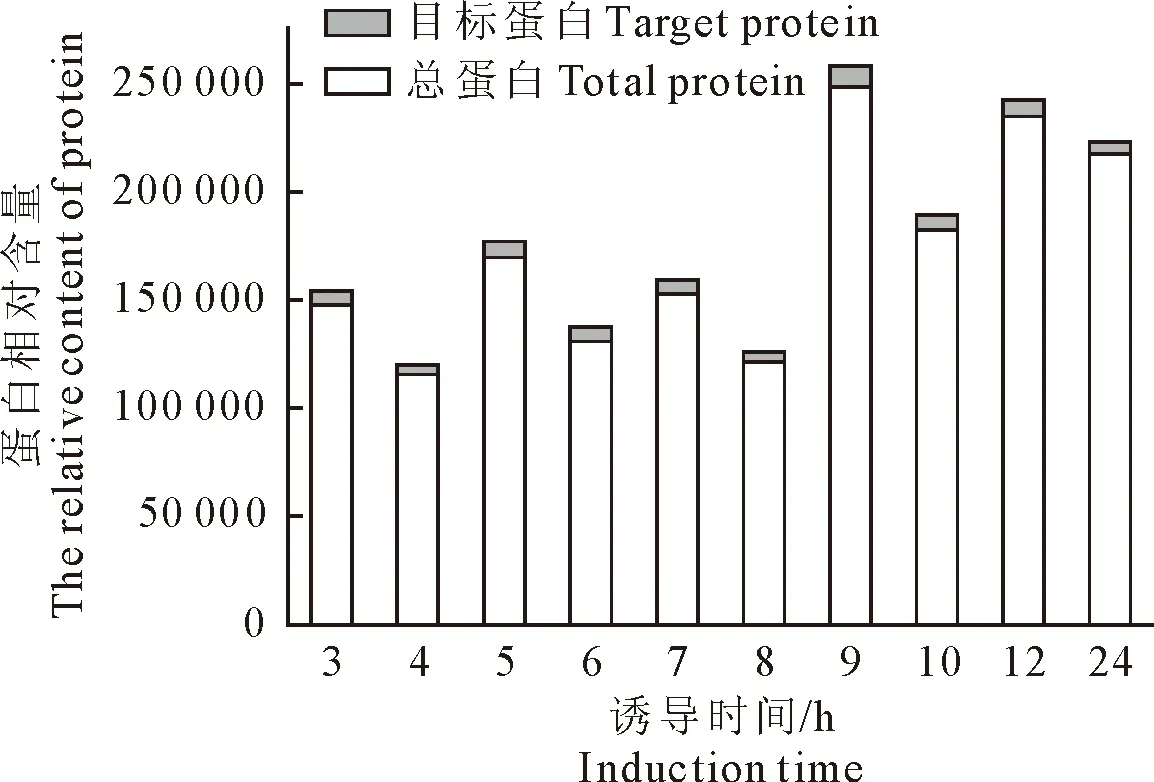
图8 不同诱导时间的目标蛋白表达量

图9 不同诱导时间的目标蛋白含量与总蛋白比值

1.Rosetta/pET32a重组菌诱导;2.Rosetta/pET32a-HA重组菌诱导
1.Induced Rosetta/pET32a recombinant bacteria;2.Induced Rosetta/pET32a-HA recombinant bacteria
图10 Western blot检测HA蛋白
Fig.10 Detection of HA protein by Western blot
3 讨论
禽流感病毒是以RNA为遗传物质的A型流感病毒,根据表面糖蛋白血凝素(HA)与神经氨酸酶(NA)的抗原性差异,分为多种亚型。HA是禽流感病毒的主要表面抗原之一,其与宿主细胞唾液酸受体结合,介导病毒黏附于细胞膜,辅助病毒穿膜内吞,从而感染细胞[8-9]。HA还是流感病毒主要毒力因子之一[10],经常产生变异,导致禽流感病毒遗传性状改变[11],以此来逃逸抗体的识别。目前,疫苗接种是预防流感最有效的方式之一,传统的疫苗生产依赖于鸡胚或哺乳动物细胞培养产生裂解疫苗[12-13],但这种方法存在生物安全性低等缺陷。大量研究针对禽流感病毒的重要抗原HA制备疫苗,不仅能预防流感病毒感染,亦能提高疫苗的生物安全性[14-15]。所以,本研究针对H5N1的HA抗原,构建HA的原核表达载体,在大肠埃希菌细胞内诱导表达,优化诱导条件,以实现抗原蛋白的高效表达。
异丙基硫代β-D-半乳糖苷(IPTG)是一种高效且易控制的原核表达诱导剂,适合外源基因的高效诱导表达[16]。本研究旨在探索诱导HA表达的最佳IPTG浓度和最佳诱导时间,以提高HA的表达水平。我们设计了0、0.1、0.2、0.4、0.6、0.8、1.0、1.5、2.0 mmol/L这9个IPTG诱导浓度梯度;0、3、4、5、6、7、8、9、10、12、24 h这11个诱导时间梯度。在探索最佳诱导时间和最佳诱导浓度过程中,发现诱导时间对目标蛋白表达影响极其显著。结果表明诱导时间为6 h,IPTG诱导浓度为0.1 mmol/L时,HA蛋白表达效率最高。
黄瑜等[17]研究发现,延长诱导时间或提高IPTG浓度,蛋白表达量无明显增加,说明高浓度或长时间IPTG诱导对大肠埃希菌生长繁殖具有抑制作用。本研究发现,培养6 h后未加IPTG的细菌培养液OD600高达5.0,而诱导组OD600最大为3.5,表明在菌体生长过程中IPTG产生了明显的抑制作用。此外,当IPTG浓度大于0.4 mmol/L时,总蛋白量明显减少,当诱导时间超过9 h时,总蛋白量无明显增加。导致上述现象的原因可能是高浓度IPTG和长时间诱导抑制了细菌生长,且不利于目标蛋白的表达。有研究表明,H5N1亚型的HA基因含有大肠埃希菌稀有密码子,甚至有些稀有密码子使用频率≤0.28%[18]。本研究中HA蛋白占总蛋白的比例偏低(1.8%~5.9%),可能受大肠埃希菌表达系统密码子偏好性的影响,在后续的试验中将优化HA基因密码子,以提高HA蛋白表达量。本试验初步研究了H5N1重要抗原蛋白HA的原核表达,为后续HA抗体制备和相关疫苗研究奠定了基础。
