Atg5在肌萎缩侧索硬化症转基因小鼠纹状体和脑干中表达降低
2018-08-21刘金梦管英俊陈燕春刘永新王巧真周风华王箐
刘金梦,管英俊*,陈燕春,刘永新,王巧真,周风华,王箐
(潍坊医学院,1临床医学院,2麻醉学系,潍坊 261053)
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一种慢性进展性神经退行性疾病,特征是皮层、脑干和脊髓等运动神经元的选择性和进行性退化,临床上出现进行性肌无力、肌萎缩,最后导致呼吸衰竭而死亡[1]。许多类型的神经退行性疾病都伴随着聚集的和泛素化蛋白的积累,自噬参与了聚集蛋白的降解和去除,自噬受到抑制会导致中枢神经系统的神经退行性疾病[2]。超氧化物歧化酶1(superoxide dismutase 1, SOD1)基因突变与ALS发病密切相关[3]。研究表明,突变的SOD1聚集体会减弱溶酶体的逆向转运,在ALS早期出现进行性自噬溶酶体缺陷与清除受损[4]。本实验室前期经实验证明SOD1G93A突变的ALS转基因小鼠脊髓中多种自噬相关因子表达水平异常,如TFEB、beclin1、Atg4B[5,6]、Atg5[7]。Peng等[8]的研究也表明自噬相关基因Atg5在自噬体形成中十分重要。ALS脊髓自噬的研究很多,但对于纹状体和脑干神经元的研究尚不明确。本研究应用SOD1G93A基因突变的ALS转基因小鼠检测Atg5在ALS转基因小鼠纹状体和脑干中的表达变化,以探究自噬与ALS的关系,为从自噬角度系统阐明ALS发病机制提供实验依据。
材料和方法
1 实验动物
SOD1G93A基因突变的ALS转基因小鼠,购自Jackson实验室。将4w的小鼠剪尾0.2~0.4cm,按吴欣等方法[9]进行基因型鉴定。将成年ALS转基因小鼠根据发病早期(95d)、中期(108d)和晚期(122d)随机分为3组,每组ALS转基因小鼠配以同窝野生型(wide-type, WT)小鼠作为对照。
2 实验试剂及仪器
Atg5兔单克隆抗体购自Cell Signaling公司,β微管蛋白III(β-tubulin III)小鼠多克隆抗体购自R&D,鼠抗GAPDH单克隆抗体购自Proteintech Group公司,反转录试剂盒购自TOYOBO公司,SYBR Premix Ex TaqII购自Takara公司;CFX96实时定量PCR仪购自Bio-Rad公司。
3 免疫荧光标记
参照本实验室的方法灌注固定,制备鼠脑冷冻组织切片[10]。实验前冷冻切片常温晾片2h,滴加10%山羊血清,37℃封闭抗原40 min,PBS清洗,滴加兔抗Atg5(1∶50)、鼠抗 β-tubulin Ⅲ(1∶100),4℃孵育过夜。PBS清洗,滴加Cy3标记的羊抗兔和Alexafluor 488标记的羊抗鼠荧光二抗(终浓度为1∶400),37℃避光孵育40min,滴加Hoechst,37℃孵育避光15min,防淬灭荧光封片剂封片,在荧光显微镜下观察Atg5及β-tubulin Ⅲ表达情况。对照组用PBS代替一抗。
4 qRT-PCR
RNA提取和逆转录反应:参照本实验室之前的方法提取RNA[10],根据TOYOBO公司反转录试剂盒说明书采用一步法行逆转录反应,冰上配置反应体系,2μg RNA,4μl 5×RT Buffer,1μl RT Enzyme Mix,1μl Primer Mix,Nuclease-free Water将体积补至 20μl,37℃、15min,98℃、5min,-20℃ 保存。
qPCR扩 增 反 应:Atg5上 游 引 物 5’ -TACAG-CATTTTCACAGAGAAGGACG- 3’,下游引物3’-CAGCATTGGCTCTATCCCGTG-5’;β-actin 上游引物 5’-CGTTGACATAAGTAAAGACC-3’,下游引物 3’ -ACAGTCCGCCTAGAAGCAC-5’。以 2μl逆转录产物为模板,β-actin上下游引物各0.8μl,Atg5上下游引物各 0.8μl,10μl SYBR,6.4μl DDW 配成反应体系。反应条件:预变性,95℃,1min;PCR 反应,95℃,15s,60℃,1min,共循环40次,最后生成融解曲线,结束反应。
5 Western Blot
取ALS小鼠和野生型小鼠纹状体和脑干,加裂解液后冰上充分匀浆,裂解30 min,4℃、12000 r/min离心15min,取其上清,检测蛋白浓度。配制12% SDS-DAGE凝胶,每孔上样40μl蛋白,先以恒压80 V电泳40min,再以恒压120V电泳60min,取出凝胶,恒流300mA、100min转膜,5%脱脂奶粉封闭抗原2h,PBS清洗PVDF膜,滤纸吸净表面液体后孵育一抗 Atg5(1∶1000)、GAPDH(1∶2000),放置冰箱4℃过夜。常温下孵育兔二抗(1∶10000)2h,PBS清洗后,ECL孵育后暗室胶片曝光。
6 统计学分析
应用IPP6.0图像分析软件测量Western blot中的Atg5阳性条带和GAPDH阳性条带的光密度值,用SPSS20.0软件进行独立样本t检验分析结果,P<0.05表示差异有统计学意义。
结 果
免疫荧光染色显示,ALS小鼠和WT小鼠纹状体和脑干内舌下神经核(hypoglossal nerve nucleus,12N)及面神经核(facial nerve nucleus, 7N)内均可检测到Atg5阳性细胞,且与β-tubulin Ⅲ标记的神经元共表达。与WT小鼠相比,ALS小鼠纹状体和脑干内12N和7N中Atg5免疫阳性反应明显减弱(图1,图2)。
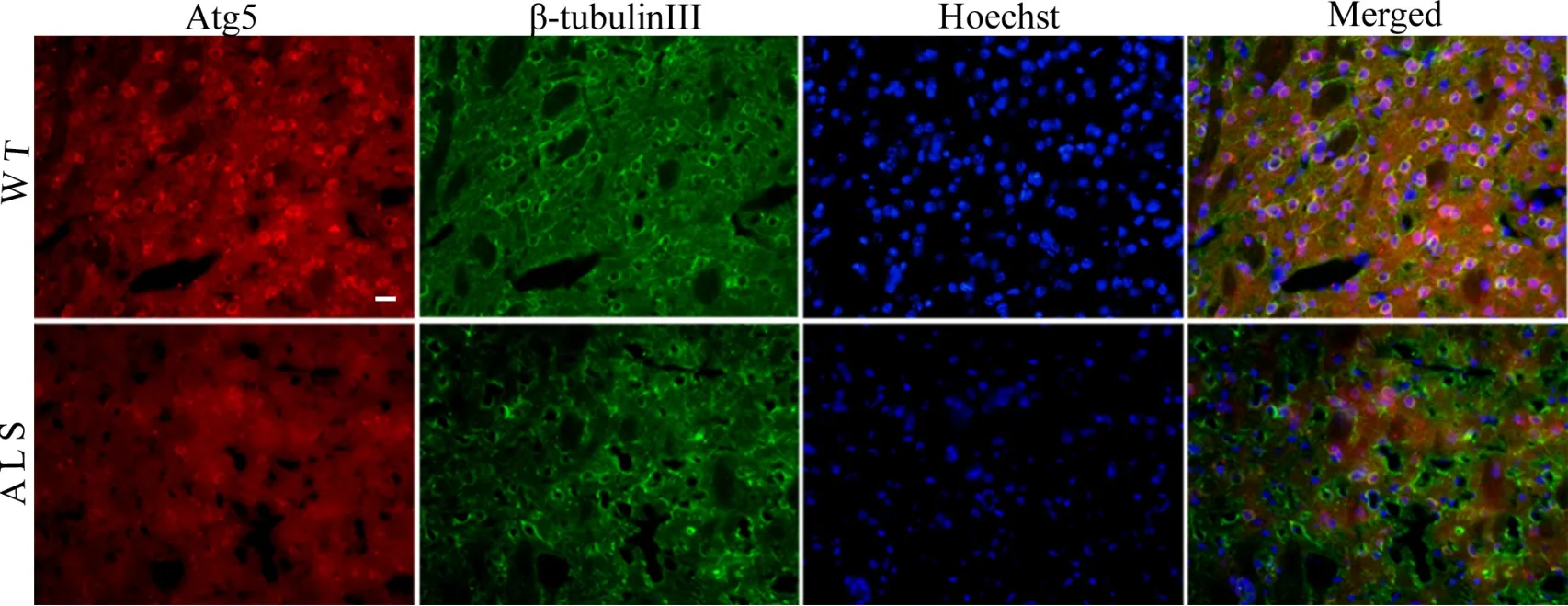
图1 免疫荧光双标检测108d ALS小鼠纹状体内Atg5的免疫反应性变化。比例尺,20μmFig. 1 Expression change of Atg5 detected by immunofluorescence double staining in the striatum of ALS transgenic mice at day 108 after birth. Scale bar, 20μm

图2 免疫荧光双标检测108d ALS小鼠脑干舌下神经核(12N)和面神经核(7N) 中Atg5的免疫反应性变化。比例尺,20μmFig. 2 Expression change of Atg5 detected by immunofluorescence double staining in the brainstem hypoglossal nerve nucleus (12N) and facial nerve nucleus (7N) of ALS transgenic mice at day 108 after birth. Scale bar, 20μm
qRT-PCR检测显示,与WT小鼠相比,ALS转基因小鼠纹状体中Atg5 mRNA在发病的早、中、晚期均显著下降;脑干中Atg5 mRNA在发病中、晚期均显著下降(图3)。
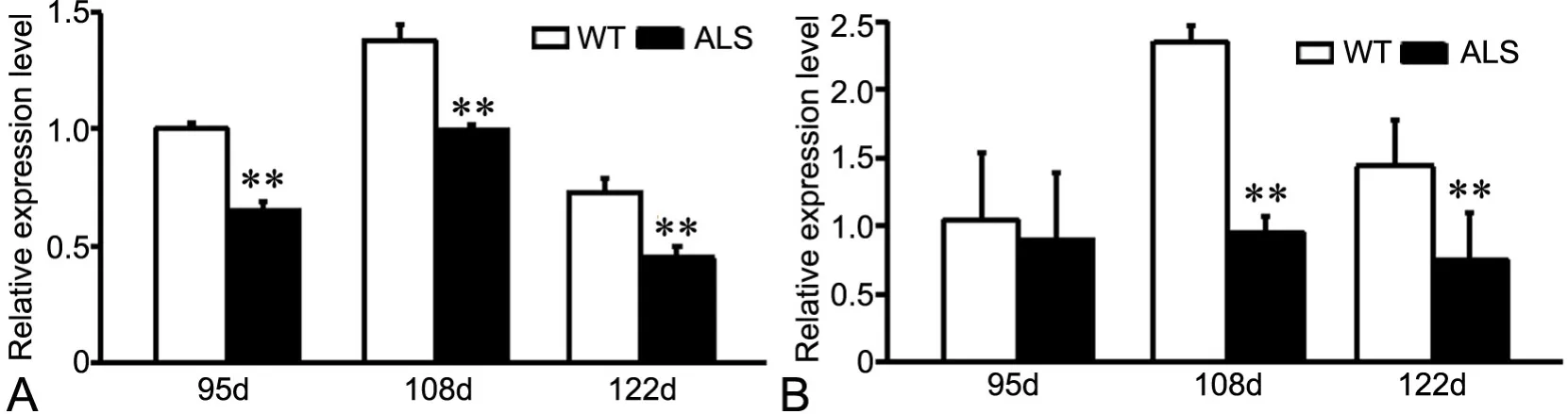
图3 ALS小鼠纹状体(A)和脑干(B)中Atg5 mRNA表达水平的qRT-PCR检测的统计学分析;**,与WT小鼠相比,P<0.01Fig. 3 Statistical analysis of Atg5 mRNA expression detected by qRT-PCR in the striatum (A) and brain stem (B) of ALS transgenic mice. **, P<0.01,compared with WT mice
Western blot分析显示,与WT小鼠比较,ALS小鼠纹状体和脑干中Atg5蛋白在发病早期无显著性变化,发病中、晚期表达均降低(图4)。

图4 ALS小鼠纹状体(A)和脑干(B)中Atg5蛋白水平表达的Western blot检测。A1和B1,代表性Western blot;A2和B2,Atg5蛋白水平的统计学分析;*,与WT小鼠相比,0.01<P<0.05Fig. 4 Western blot detection for the expression of Atg5 in the striatum (A) and brain stem (B) of ALS transgenic mice. A1 and B1, representative Western blots; B1 and B2, statistical analysis of Atg5 protein levels; *, 0.01<P<0.05, compared with WT mice
讨 论
自噬是一种普遍存在于真核生物中的细胞内降解系统[12],可以维持细胞稳态、清除损伤的细胞器和蛋白质[13]。ALS是一种以受累运动神经元中泛素化蛋白质聚集为特征的神经退行性疾病。1993年,SOD1是第一个被鉴定为在家族性ALS病例中聚集的突变蛋白[11]。ALS中SOD1基因突变导致的大量错误折叠蛋白质聚集体需要自噬来清除。近年来的研究也表明自噬与ALS发病相关[14]。神经元中Atg5或Atg7的选择性遗传消融导致与海马、大脑和小脑皮质中的神经元丧失有关的运动和行为缺陷。在神经元特异性自噬缺陷小鼠中观察到的病理性改变与神经退行性疾病患者中发现的相似,表明自噬是神经元存活所必需的。自噬的遗传缺失损害泛素-蛋白质聚集体的分解,诱导泛素化蛋白质在神经元中的累积。在阿尔茨海默氏病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)、亨廷顿病(Huntington’s disease,HD)中均有自噬功能障碍导致的蛋白质错误聚集[12]。Zare-shahabadi等[15]研究也表明自噬-溶酶体缺陷在AD发病早期发生,并在疾病进程中起重要作用。以上研究提示自噬改变与ALS等多种神经退行性疾病密切相关。
Atg5作为自噬家族中的一员,可与Atg12相结合,形成自噬体前体,诱导自噬,抑制Atg5的基因表达,自噬会受到抑制[10]。Atg5是高度保守的蛋白质,Kim等证明了Atg5的纯合E122 d突变(在两个共济失调的人类受试者中发现的独特突变)导致缀合至Atg12的Atg5减少以及自噬活性的总体降低。完全敲除Atg5的小鼠在出生后不久即死亡,表明自噬对于哺乳动物的存活是必需的[16]。本实验发现,与野生型小鼠相比,ALS小鼠中Atg5 mRNA和蛋白在发病中、晚期均降低,免疫荧光双标结果显示,纹状体和脑干中Atg5标记的阳性细胞与神经元存在共表达,提示自噬发生在神经元。纹状体和脑干均与运动功能有关,自噬是神经细胞存活所必需的,Atg5表达下调,自噬的减弱,导致异常蛋白聚集体清除的减少,加剧神经元的变性。神经元是有丝分裂后的细胞,神经元中易聚集的蛋白质不易被降解,因此蛋白质降解系统的活性改变会引起蛋白质的异常积累,导致神经元功能障碍[17],最后可致神经退行性疾病。Hu等[18]通过原位杂交、免疫荧光技术检测与PD相关的自噬相关的基因表达变化,发现Atg5的表达水平下降,自噬通量被阻断。通过游泳行为分析发现Atg5下调导致PD斑马鱼模型病理性运动行为加重,酪氨酸羟化酶标记的多巴胺能神经元或多巴胺转运蛋白损失,阻断斑马鱼模型中的自噬通量,表明Atg5对多巴胺能神经元具有重要的神经保护作用。
Atg5在ALS小鼠纹状体和脑干中出现的异常变化,提示Atg5调控的自噬改变与ALS大脑纹状体和脑干病变有关,干预自噬将为ALS提供新的治疗途径。近年来应用自噬治疗神经退行性疾病越来越受到关注,上调自噬的药物治疗可能是一种有前景的ALS治疗策略[19]。
