三种转染试剂对RSC96细胞miRNA转染效率及细胞毒性影响的比较
2018-08-21刘玉璞国海东邵水金
刘玉璞,国海东,邵水金
(上海中医药大学基础医学院人体解剖教研室,上海201203)
施万细胞(Schwann cell,SC)是一种存在于周围神经系统中的神经胶质细胞,参与形成髓鞘,并对周围神经起到保护、促进轴突再生及再生轴突的髓鞘化等作用[1]。SC分泌多种神经营养因子和神经生长因子,参与周围神经损伤后的修复,因此被广泛研究[2]。
细胞转染是指将外源分子如DNA,RNA等导入真核细胞以研究导入基因功能和机制的方法[2,3]。目前转染细胞常用方法主要为非病毒载体法和病毒载体法,前者操作简单,广为应用;后者则有安全性欠佳和步骤繁琐等缺点[4]。非病毒载体法所使用的转染试剂主要是脂质体,其中常用的脂质体Lipofectamine 2000对许多细胞都具有较好的转染效率[5,6]。
转染试剂对细胞的转染效率可能存在差异,如Lipofectamine 2000转染库普弗细胞则效率欠佳[7]。SC的转染效率较低,鲜见能够高效转染SC的转染试剂,这给科研人员造成了较大的障碍[8]。因此,本实验培养大鼠SC株(RSC96),利用几种常见的广泛应用的转染试剂转染绿色荧光标记物FAM,比较以找到效率最高的转染试剂,并对其进行细胞毒性的观察,以寻找到最理想的转染试剂。
材料与方法
1 实验材料
大鼠RSC96购自上海中科院细胞研究所,lipofectamine 2000购自invitrogen公司,FuGENE6 Transfection Reagent购自Promega公司,SuperFectin II reagent购自上海普飞生物技术有限公司,羧基荧光素(FAM)标记的microRNA(miRNA)阴性对照由上海吉玛制药技术有限公司合成,高糖DMEM培养基、胎牛血清(FBS)和PBS均购自美国CORNINIG公司,CCK-8试剂盒购自碧云天生物技术有限公司,TUNEL凋亡试剂盒购自上海翊圣生物科技有限公司。
2 大鼠SC株RSC96的培养
大鼠RSC96是一种贴壁生长的细胞,所用培养液成分为含4.5g/L葡萄糖的DMEM(含10% FBS),置于37℃,5%CO2的培养箱中,2~3d传代1次。
3 三种转染试剂转染FAM标记的miRNA
3.1 Lipofectamine 2000转染
细胞按每孔100μl传代至96孔板,至少设5个复孔。待细胞长满培养瓶底的60%~70%行转染。换为不含血清的DMEM后分别将羧基荧光素(FAM)标记的miRNA阴性对照用Lipofectamine 2000转染RSC96,用法用量严格按照Lipofectamine 2000产品说明书,设置3个时间点:①转染24h后PBS清洗,换为正常培养液后于荧光显微镜下观察拍照,并计算转染效率,简称24h组;②转染48h后如上所述,拍照计数,简称48h组;③转染8h后清洗换液,48h后拍照计数,简称8h-48h组。
3.2 FuGENE 6 Transfection Reagent转染
转染试剂改为FuGENE6 Transfection Reagent,其他操作同上。
3.3 SuperFectin II reagent转染
转染试剂改为SuperFectinII Reagent,其他操作同上。
3.4 正常对照
将细胞正常传代到96孔板,不做转染,其他操作同上。
4 转染效率计算
按1∶100比例拍摄,用ImageJ对绿色荧光转染成功数和同视野下所有细胞数进行统计。3组各统计10个视野。该转染试剂转染效率(%)=绿色荧光细胞数/总细胞数×100%。
5 CCK-8法检测细胞活性
96孔板每孔加入10μl的CCK8试剂,放回细胞培养箱中静置2h后读取450nm波长处OD值(吸光度)。OD值越高表示细胞活性越高。
6 TUNEL染色检测细胞凋亡
96孔板每孔PBS清洗后4%多聚甲醛固定15min,按照TUNEL试剂盒说明加入适量TUNEL反应液后于37℃反应1h。PBS清洗,DAPI衬染细胞核,磷酸甘油封片,荧光显微镜下观察,拍照统计各组凋亡细胞占总细胞数的比例。
7 统计学分析
采用SPSS 22软件处理数据。所有数据以均数±标准差表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 SuperFectin II reagent转染效率高
应用FuGENE6 Transfection Reagent转染的细胞中未见任何被转染的细胞,与对照组相同,转染效率为0%;在用Lipofectamine 2000转染的细胞中可见较多的被转染细胞,其在3个时间点的转染效率分别为(38±8)%、(40±5)% 和(15±5)%,均低于60%;在用SuperFectin II Reagent转染的细胞中,可见更多被转染的细胞(图1),其在3个时间点的转染效率分别为(88±7)%、(90±6)%和(70±10)%,明显高于Lipofectamine 2000(P<0.01)。由此表明,FuGENE6 Transfection Reagent不适于RSC96的miRNA转染;Lipofectamine 2000虽有一定的转染率,但不足以满足实验需求;只有SuperFectin II Reagent的转染效率能满足实验需求。此外,Lipofectamine 2000和SuperFectin II Reagent在8h-48h组的转染效率明显低于48h组,但SuperFectin II Reagent转染效率仍达到平均70%(图1),表明其在转染8h后换液其转染效率仍能基本满足实验需求。
2 三种转染试剂对细胞活力的影响
CCK-8检测细胞活性表明,在3个不同时间点,与Control组比较,FuGENE6 Transfection Reagent对细胞活力的影响无统计学差异,Lipofectamine 2000和SuperFectin II Reagent则不同程度地降低细胞活力;与Lipofectamine 2000组比较,SuperFectin II Reagent组细胞活力更低,表明SuperFectin II Reagent细胞毒性更大(图2)。此外,与48h细胞活力对比,8h-48h时Lipofectamine 2000和SuperFectin II Reagent组的细胞活力升高,表明转染8h后换液能够降低这两种转染试剂的细胞毒性。
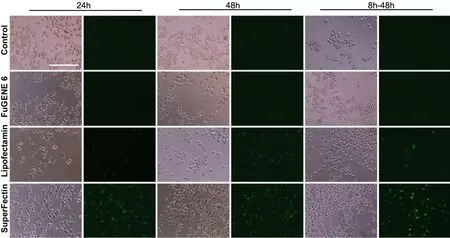
图1 三种转染试剂转染FAM标记的miRNA(绿色荧光)效率对比。FuGENE 6,FuGENE 6 Transfection Reagen;Lipofectamin,Lipofectamin 2000;SuperFectin,SuperFectin II Reagent;比例尺,100μmFig. 1 Comparison of the transfection efficiency of FAM-labeled miRNAs (green) with three transfection reagents. FuGENE 6∶ FuGENE 6 Transfection Reagen; Lipofectamin∶ Lipofectamin 2000; SuperFectin∶ SuperFectin II Reagent; scale bar, 100μm

图2 CCK-8法检测3种转染试剂对细胞活力影响的统计学分析。**,P<0.01,与Control组比较;##,P<0.01,与Lipofectamin组比较Fig. 2 Statistical analysis of the effects of three transfection reagents on the cell viability by CCK-8 assay. **, P<0.01, compared with control group; ##, P<0.01, compared with Lipofectamin group
3 三种转染试剂对细胞凋亡的影响
TUNEL凋亡染色检测显示,在3个时间点,与Control组比较,FuGENE6 Transfection Reagent对细胞凋亡无明显影响;24h时,Lipofectamine 2000对细胞凋亡也无明显影响,48h和8h-48h时的Lipofectamine 2000能明显促进细胞凋亡, SuperFectin II reagent在3个时间均促进细胞凋亡,并明显强于Lipofectamine 2000(图3、4)。此外与48h时间点对比,8h-48h时SuperFectin II reagent组细胞凋亡减少,提示转染8h后换液能够降低SuperFectin II reagent的促细胞凋亡作用。

图4 TUNEL染色检测3种转染试剂对细胞凋亡影响的统计学分析。*,0.01<P<0.05,与 Control组比较;**,P<0.01,与 Control组比较;##,P<0.01,与Lipofectamin组比较Fig.4 Statistical analysis of the effects of three transfection reagents on apoptosis by TUNEL staining. *, 0.01<P<0.05 compared with control group; **, P<0.01, compared with control group; ##, P<0.01, compared with Lipofectamin group
讨 论
SC是周围神经系统中主要的神经胶质细胞,其参与神经的生长、损伤后修复,因此其作为周围神经系统损伤后修复的关键被广泛研究[9],糖尿病患者周围神经病变,SC凋亡和脱髓鞘的机制研究已成热点[10]。细胞转染是医学科研工作中最常用的实验技术之一,SC属于难以转染的贴壁细胞,找到一种转染SC效率较高的转染试剂具有较高的科研价值[11]。

图3 TUNEL染色检测转3种染试剂对细胞凋亡的影响。比例尺,100μmFig.3 Effects of three transfection reagents on cell apoptosis detected by TUNEL staining. Scale bar, 100μm
本实验设置3个观察时间点,使用3种不同的转染试剂转染绿色荧光素FAM标记的miRNA阴性对照,从细胞转染效率角度评价其转染效果。数据分析表明,SuperFectin II Reagent的转染效率最高,能够满足SC转染后研究的需要;Lipofectamine 2000转染效率低;FuGENE6 Transfection Reagent可能不适用于转染miRNA进入SC。因此,不同转染试剂对于SC的转染效率存在着较大差异;在正式转染有关产品之前,最好先做下荧光标记的转染以确定转染是否成功。
转染试剂的细胞毒性不容忽视,毒性过大则直接影响到细胞的存活和增殖、迁移、凋亡方面的实验结果。根据CCK-8和TUNEL染色结果,FuGENE6 Transfection Reagent基本无细胞毒性,Lipofectamine 2000具有一定毒性,SuperFectin II reagent毒性更大,而经换液后则有一定程度的改善,结合第一部分转染效率的结果,建议使用SuperFectin II reagent对RSC96进行miRNA转染,并在8h进行换液以降低其细胞毒性。
值得提出的是,miRNA的激动剂和拮抗剂经过特殊化学修饰后成为miRNAagomir和antagomir,其在动物体内外具有更高的稳定性和效果持续时间,且能克服体内细胞膜、组织等障碍富集于靶细胞。在后续试验中我们尝试以Cy3(红色荧光)标记的miRNAagomir阴性对照转染RSC96,结果也较为理想。因此,直接使用miRNAagomir和antagomir也不失为一种提高转染效率的方法。
Lipofectamine 2000是应用广泛的转染试剂,属于脂质体转染试剂,有转染需要更换无血清培养液、本身参与细胞生理活动造成一定细胞毒性的缺点[12]。有鉴于此,较多的非脂质体转染试剂被大力研究开发,FuGENE 6 Transfection Reagent就是其中之一,其具有较低的细胞毒性,转染效率与Lipofectamine 2000相当[13],且无需更换培养液,简化操作步骤。SuperFectin II Reagent是第三代阳离子聚合物型转染试剂,目前尚在不断开发,其具有更广的细胞适用范围和更快的转染速度;但从本文结果看尚需注意控制其细胞毒性。总之,本实验为大鼠SC的基因领域研究打下基础,为更方便、高效的探究RSC96细胞相关基因修饰后的功能和机制提供便利。
