德氏乳杆菌保加利亚亚种菌株自溶活性的比较研究
2018-08-21张玉玉于江马建军苏文政黄保华吴家强王可
张玉玉,于江,马建军,苏文政,黄保华,吴家强,王可
(山东省农业科学院畜牧兽医研究所山东省畜禽疫病防治与繁育重点实验室,济南250100)
0 引言
乳酸菌自溶(autolysis)现象在发酵乳制品中普遍存在,是细菌在胁迫环境条件下维持菌群生存的一种自我保护机制。自溶过程中菌体释放的胞内蛋白酶、肽酶和酯酶等酶类,可将蛋白、多肽和脂肪分解成不同的风味物质或风味前体物质,从而形成发酵乳制品的独特风味和质地[1]。菌体自溶在不同发酵乳制品中对产品品质所起的作用并不相同,有利也有弊[2]。然而,当发酵剂菌体自溶速率过快时,会导致发酵乳制品产酸不足、凝乳不良及乳糖残留过多等问题而影响乳制品的品质和得率[3]。因此,乳酸菌自溶速率在一定程度上决定着发酵乳制品的质量、风味及产品生产周期。
德式乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)是一种被冠以国姓的细菌,是酸乳发酵的常用菌种,也是酸乳在贮藏期间发生后酸化的主要菌株[4]。德式乳杆菌保加利亚亚种具有调节胃肠道健康、增强免疫功能、抗癌抗肿瘤等重要的生理功能,是被规定为可用于保健食品的益生菌菌种之一[5]。在酸乳发酵剂生产中,德式乳杆菌保加利亚亚种菌体自溶则会制约菌株的增殖水平,不利于菌株的高密度培养,而在酸乳的货架期菌体自溶影响酸乳的后酸化程度和品质。因此,德式乳杆菌保加利亚亚种的自溶活性对酸乳制品发酵生产至关重要。
本研究针对分离自传统和市售乳制品的德式乳杆菌保加利亚亚种菌株,通过核酸溶出检测法检测其自溶活性,筛选出高、低自溶活性菌株,为开发优良的酸乳发酵剂提供理论依据。
1 实验
1.1 试验材料
12株德式乳杆菌保加利亚亚种菌株,均由本实验室分离鉴定;改良MRS培养基,青岛高科园海博生物技术有限公司;Tris base,美国Amresco公司;EDTA,国药化学试剂有限公司。
1.2 试验方法
1.2.1 菌株培养及处理
活化菌种接种改良MRS液体培养基,37℃静置培养至对数生长中期的菌液作为后续试验的种子液。按4%(体积分数)的接种剂量将种子液接种于改良MRS液体培养基,37℃静置培养至目标菌体浓度后,取样,离心(5 000 rpm,4℃)10 min收集菌体。无菌生理盐水洗涤菌体3次,灭菌TE缓冲液(50 mmol/L Tris,50 mmol/L EDTA)洗涤菌体1次,最后菌体用适当的TE缓冲液重悬,使菌悬液的OD600值约为0.6。
1.2.2 自溶度检测方法
1.2.2.1 核酸/蛋白溶出检测法
取适量上述菌悬液离心去除菌体,测定上清液的OD260/OD280,记为A0。另取适量上述菌悬液置于37℃培养箱温育t小时后,取样离心去除菌体,测定上清液的OD260/OD280,记为At;剩余菌悬液超声波冰浴破碎(400 W,工作3 s,间隙3 s)至菌液透明,取样离心去除菌体,测定上清液的OD260/OD280,记为As。自溶度(%)=(At-A0)/(As-A0)×100%。
1.2.2.2 比浊法
取适量上述菌悬液测定初始OD600值,记为 A0。另取适量上述菌悬液置于37℃培养箱温育t小时后,取样测定OD600值,记为At。自溶度(%)=(A0-A t)/A0×100%。
1.2.3 扫描电镜观察
将对数生长中期的正常菌体和自溶菌体用生理盐水冲洗后,用2.5%戊二醛磷酸缓冲液(pH7.4)4℃固定2 h,磷酸缓冲液冲洗3次,再用1%锇酸4℃后固定1.5 h。随后,样品用双蒸水冲洗,逐级酒精脱水,醋酸异戊酯置换30 min,CO2临界点干燥,粘托后表面喷金,置于扫描电子显微镜下观察并拍照。
2 结果与分析
2.1 菌体自溶检测方法的确定
应用核酸/蛋白溶出检测法和比浊法对YF-L711菌株的自溶度进行检测,三种方法测得的自溶度均随着处理时间的延长而增大,但自溶度的增长趋势保持一致(图1)。YF-L711菌株处理24 h内自溶速率较大,随后增速逐渐变缓。核酸溶出法(OD260)检测得到的自溶度最大,24 h时自溶度约为71%,其次为蛋白溶出法(OD280)检测得到的自溶度,24 h时自溶度约为62%,最小的为比浊法(OD600)检测得到的自溶度,24 h时自溶度仅约为40%。由于核酸溶出检测法最为灵敏,本研究选用核酸溶出检测法检测菌株处理24 h时的自溶度。
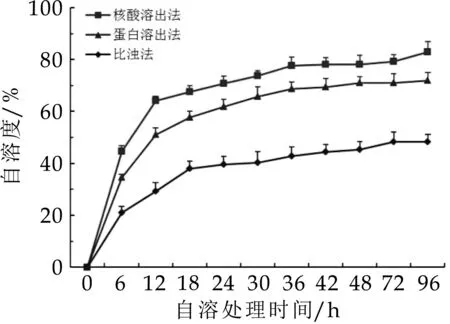
图1 不同检测方法测定的YF-L711菌株的自溶度比较
2.2 菌体不同生长阶段自溶度的比较分析
3株德式乳杆菌保加利亚亚种的生长曲线见图2,相对应的不同生长阶段的菌株自溶度结果见图3。YF-L711株、YOM 505株和CX株不同生长阶段自溶度的变化规律相似,在对数生长期(4-12 h)菌体细胞具有最大的自溶度,进入稳定期(14-24 h)后菌体细胞的自溶度迅速降低,衰退期(24-48 h)菌体细胞的自溶度最低且随着培养时间的延长逐渐降低。
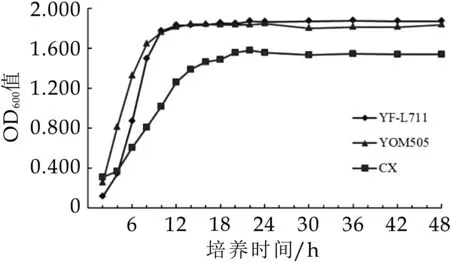
图2 德式乳杆菌保加利亚亚种的生长曲线
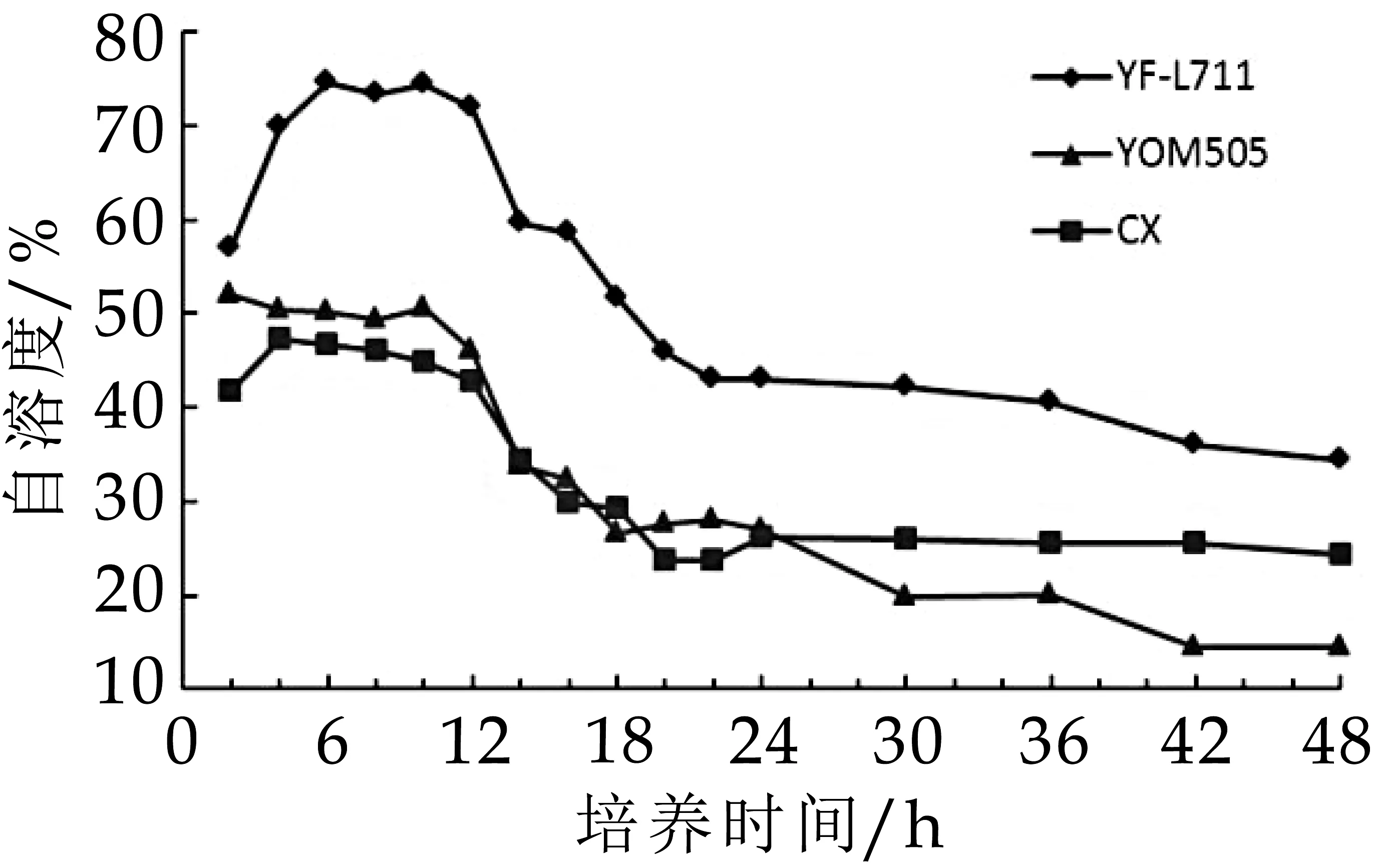
图3 德式乳杆菌保加利亚亚种不同生长阶段的自溶度结果
2.3 不同菌株自溶度的比较分析
由于对数生长期菌体的自溶度最高,且酸乳发酵结束时发酵菌株正处于对数生长期,因此本研究仅检测了12株德式乳杆菌保加利亚亚种对数生长中期的菌体自溶度。从图4可以看出,MNGYR株、YF-L711株和YLCQ株的自溶度最高,均达到70%以上;YBT株、Y450B株、Y278F株和YLYX株的自溶度居中,在50%~60%之间;JB株、YOM 300株、YOM 505株、YOM 528株的自溶度最低,在50%以下。由此可见德式乳杆菌保加利亚亚种不同菌株之间的自溶度差异较大。
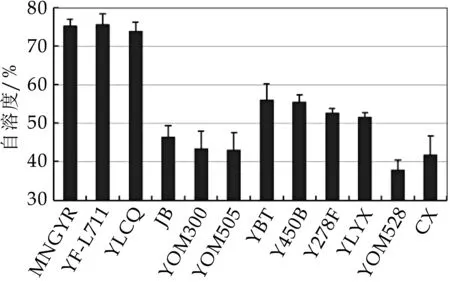
图4 对数生长中期的不同菌株处理24 h时的自溶度
2.4 不同菌株在自溶中的形态变化
扫描电镜(图5)显示德式乳杆菌保加利亚亚种正常菌体细胞结构完整且表面光滑;YF-L711株作为高自溶菌株,自溶菌体细胞表面出现孔洞,胞内物质逐渐释放出来;而YOM 300株作为低自溶菌株,自溶菌体细胞表面出现轻微萎缩且有部分细胞内容物逸出的现象,但细胞表面没有出现明显的孔洞。结果说明低自溶菌株比高自溶菌株具有更强的抗逆能力,在不利环境下能够更好的维持细胞的完整性。
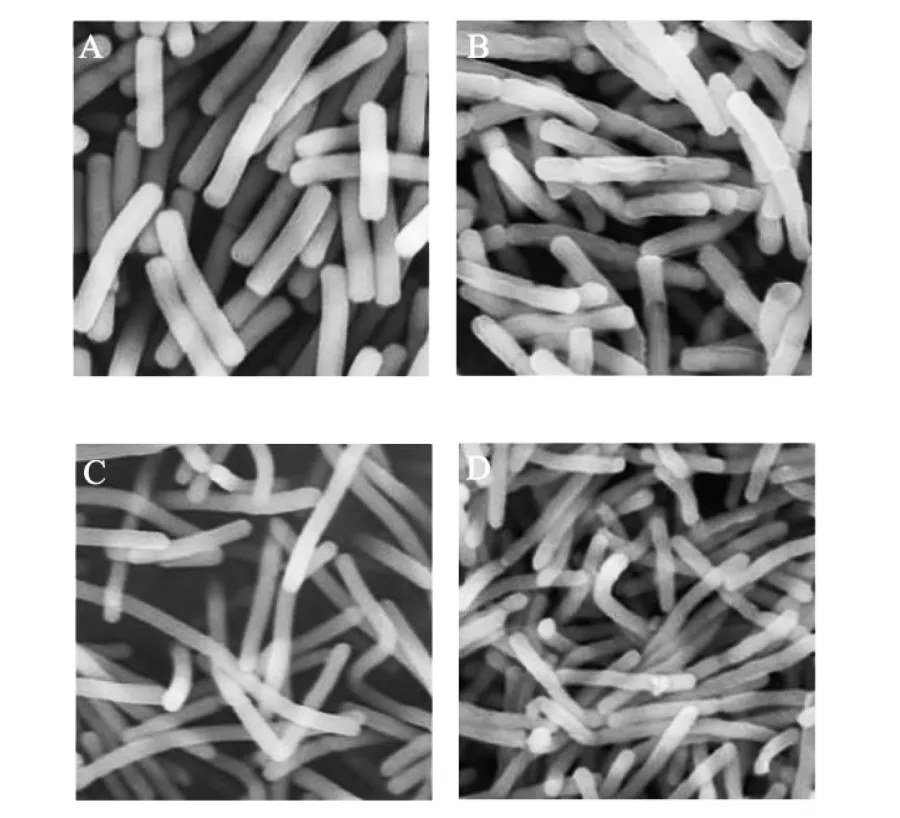
图5 正常菌体和自溶菌体的扫描电镜照片(×6.0K)
3 讨论
乳酸菌自溶活性常用的检测方法有核酸/蛋白溶出检测法、比浊法、胞内酶检测法和碘化丙锭染色-流式细胞仪法。由于核酸/蛋白溶出检测法和比浊法操作简便,本研究比较了其测定菌体自溶活性的灵敏性,结果显示上述方法测定的德式乳杆菌保加利亚亚种的自溶活性变化规律一致,但核酸溶出检测法最为灵敏,因此本研究采用核酸溶出检测法测定德式乳杆菌保加利亚亚种不同菌株的自溶活性。
据报道细菌自溶与胞内自溶酶有非常密切的相关性,自溶酶水解细胞壁从而导致细胞壁完整性受到破坏甚至表面出现孔洞,致使胞内物质逸出[6-7]。本研究中扫描电镜观察德式乳杆菌保加利亚亚种自溶菌体也证实自溶导致了菌体细胞壁受到轻微或严重的破坏,胞内物质逸出。正常情况下,自溶酶对菌体细胞的分裂作用是有序进行的,不会导致菌体的自溶,而一旦在胁迫条件下将导致作用失序而引起自溶[8]。对数生长期的细菌快速增殖,细胞的生命活动活跃,负责细胞分裂的自溶酶大量产生,所以处于此阶段的细胞自溶活性最高。细菌生长进入稳定期后,细胞的活跃度显著降低,自溶酶的生成量减少,所以自溶活性显著降低。细菌生长进入衰退期后,部分菌体开始死亡,自溶酶的生成量更少,所以自溶活性持续降低。
不同乳酸菌甚至同种属的不同菌株在相同条件下的自溶活性不尽相同。有研究显示菌体自溶对发酵乳的品质和保质期影响极为显著,自溶活性较高的乳酸菌菌株在酸乳发酵过程中产酸性能更优,酸乳后酸化的程度相对较低[9-10]。本研究采用核酸溶出检测法分析比较了12株德式乳杆菌保加利亚亚种在对数生长中期的自溶活性,筛选到了高自溶活性菌株和低自溶活性菌株,为进一步研究德式乳杆菌保加利亚亚种自溶活性的调控和改造以及开发优良酸乳发酵剂奠定基础。
