上调miR-7对胃癌细胞增殖凋亡的影响及其机制研究
2018-08-20谭海洋倪钰璇罗良弢
谭海洋, 倪钰璇, 罗良弢
湖北科技学院附属医院天门市第一人民医院 1.胃肠外科; 2.胃镜室, 湖北 天门 431700
胃癌是一种发生在胃黏膜上皮细胞的常见恶性肿瘤,是威胁人类健康的第二大肿瘤疾病。研究[1-2]显示,我国2015年胃癌的新增病例约42.9万,死亡病例约28.1万,其发病率和死亡率仍处于较高水平。胃癌具有发病隐匿、易转移和易复发等特点,而转移和复发是其预后差和死亡率高的主要原因。随着科技的发展,尽管近年来在胃癌的机制研究、早期诊断和治疗方面取得了很大进步,但胃癌的有效诊治仍是人类面临的巨大难题。miRNA是真核生物广泛存在的一类内源性非编码小分子RNA,在新陈代谢、生长发育和细胞增殖凋亡等生命活动中发挥着类似癌基因或抑癌基因的重要作用,参与多种肿瘤疾病的发生、发展过程[3-4]。大量研究[5-7]发现,miR-7在肺癌、胶质瘤和结肠癌等多种肿瘤细胞中低表达,与细胞增殖和凋亡等生理过程密切相关。目前,关于miR-7对胃癌细胞增殖凋亡的影响及其机制研究的报道较少,本研究以胃癌BGC823细胞为研究对象,通过体外实验观察miR-7对胃癌细胞生物学行为的影响,并探讨其可能的作用机制,为miR-7在胃癌方面的研究提供参考。
1 材料与方法
1.1主要材料、试剂和仪器BGC823人胃癌细胞系和RGM-1正常胃黏膜上皮细胞系由上海生化细胞研究所提供。miR-7 mimics、miR-7 mimics NC及PCR引物购自上海吉玛制药技术有限公司。RPMI 1640培养基、胰蛋白酶和胎牛血清购自美国Hyclone公司。LipofectamineTM2000、膜联蛋白-V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒和细胞周期检测试剂盒均购自美国Invitrogen公司。CCK-8检测试剂盒、细胞总蛋白提取试剂盒和逆转录试剂盒均购自上海碧云天公司,总RNA提取试剂盒、CO2细胞培养箱、RNA紫外分光度计和酶标仪均购自美国 Thermo公司,荧光定量PCR(qPCR)试剂盒和BCA蛋白浓度检测试剂盒分别购自大连宝生物公司和南京碧云天公司。细胞周期蛋白D1(Cyclin D1)抗体、细胞周期蛋白依赖激酶6(cyclin-dependent kinase 6,CDK6)抗体和细胞周期蛋白依赖激酶4(cyclin-dependent kinase 4,CDK4)抗体、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)抗体、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)抗体、β肌动蛋白(β-actin)抗体和辣过氧化物酶标记羊抗鼠或羊抗兔IgG抗体均购自美国Cell Signaling Technology公司。流式细胞仪和PCR仪分别购自美国BD公司和ABI公司。
1.2方法
1.2.1 细胞培养:将正常胃黏膜上皮RGM-1细胞和胃癌BGC823细胞种植于质量浓度为100 ml/L的胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的RPMI 1640培养基中,置于37 ℃、体积分数为5%的CO2、饱和湿度的培养箱中常规培养。待细胞成长完全贴壁后,以质量浓度为2.5 g/L的胰蛋白酶消化传代。收集对数生长期RGM-1细胞和BGC823细胞进行后续实验。
1.2.2 miR-7表达检测:取培养至对数生长期的RGM-1细胞和BGC823细胞,用总RNA提取试剂盒提取细胞总RNA,并用RNA紫外分光度计检测其纯度。逆转录试剂盒获取cDNA后,利用Primer premier 5.0软件参照GenBank中miR-7序列,设计miR-7及内参U6基因的PCR引物,以cDNA为模板链,按照PCR试剂盒说明书进行扩增。以U6为内参,采用2-△△Ct法计算miR-7的表达水平。其中,PCR扩增35个循环的反应条件如下:95 ℃变性30 s,56 ℃ 退火30 s,72 ℃延伸30 s。整个实验过程中,每组实验重复3次。
1.2.3 细胞转染、实验分组及转染效果检测:转染前1 d,将收集到的对数生长期的BGC823细胞随机分为空白组、阴性组和干扰组3组。其中,干扰组中加入1 μg miR-7 mimics和100 μl脂质体,阴性组中加入1 μg miR-7 mimics NC和100 μl脂质体,空白组中只加入100 μl脂质体。待细胞融合度为70%~80%时,将质粒和脂质体按上述分组混合均匀后加入培养基中。转染6 h后,更换培养液,再继续常规培养48 h。收集空白组、阴性组和干扰组的对数生长期细胞,按照1.2.2中的操作步骤检测各组细胞中miR-7的表达水平,观察其转染效果。
1.2.4 细胞增殖检测:取上述转染48 h的干扰组、阴性组和空白组生长对数期细胞,以质量浓度为2.5 g/L的胰蛋白酶消化,调整细胞浓度为1×105ml-1后,接种到96孔细胞培养板上。其中,每组设置5个复孔,实验重复3次。在体积分数为5%的CO2、温度为37 ℃的饱和湿度培养箱中培养。分别于24 h、48 h和72 h时采用CCK-8法进行检测。检测前每孔加入CCK-8溶液10 μl,混匀后常规条件下反应4 h后,于波长490 nm处酶标仪测定各组细胞的吸光度值(optical density,OD)。
1.2.5 细胞周期和细胞凋亡检测:收集胰蛋白酶消化转染48 h的各组细胞,预冷的磷酸缓冲液(PBS)洗涤后离心,加入预冷的质量浓度为700 g/L的乙醇,4 ℃低温条件下固定24 h。离心、PBS洗涤后,加入PI避光染色30 min后,上流式细胞仪检测各组细胞的周期分布情况。
收集胰蛋白酶消化转染48 h的各组细胞,预冷的PBS洗涤、离心。每组取1 ml细胞,洗涤离心后加入结合缓冲液200 μl重悬细胞,调整细胞浓度为1×104ml-1。加入10 μl Annexin V和5 μl PI进行染色,充分混匀后,于室温下避光孵育15 min。再加入结合缓冲液400 μl,上流式细胞仪检测各组细胞的凋亡率。
1.2.6 蛋白检测:收集转染48 h的空白组、阴性组和干扰组的对数生长期细胞,采用细胞总蛋白提取试剂盒提取各组细胞总蛋白,并使用BCA法检测所提取总蛋白的浓度和纯度。取蛋白样品30 μg,上样至质量浓度为120 g/L的十二烷基硫酸钠聚丙烯酰胺凝胶中电泳分离,电泳完毕后,经转印、封闭后加入Cleaved Caspase-3抗体(1∶500稀释)、Bcl-2抗体(1∶500稀释)、CDK6抗体(1∶1 000稀释)、CDK4抗体(1∶1 000稀释)、Cyclin D1抗体(1∶1 000稀释)和β-actin抗体(1∶500稀释),在4 ℃条件下孵育24 h后,加入二抗(1∶2 000稀释),常温条件下反应2 h后,以化学发光法显色,曝光,采用凝胶电泳成像仪和Quantity One 软件进行分析。以β-actin为内参,计算目的蛋白的相对表达水平。

2 结果
2.1miR-7在胃癌BGC823细胞中的表达及转染效果采用qPCR检测胃癌BGC823细胞和正常胃黏膜上皮RGM-1细胞中miR-7的相对表达水平,分别为0.28±0.08和0.96±0.05。与正常胃黏膜上皮RGM-1细胞相比,miR-7在胃癌BGC823细胞中的表达水平显著降低(t=12.485,P=0.000)。转染48 h后,干扰组、阴性组和空白组胃癌BGC823细胞中miR-7的表达水平分别为5.06±1.52、1.15±0.48和1.06±0.35。与空白组相比,阴性组中miR-7的表达差异无统计学意义(t=0.262,P>0.05),而干扰组中miR-7表达显著升高,差异有统计学意义(t=4.442,P<0.05)(见图1)。
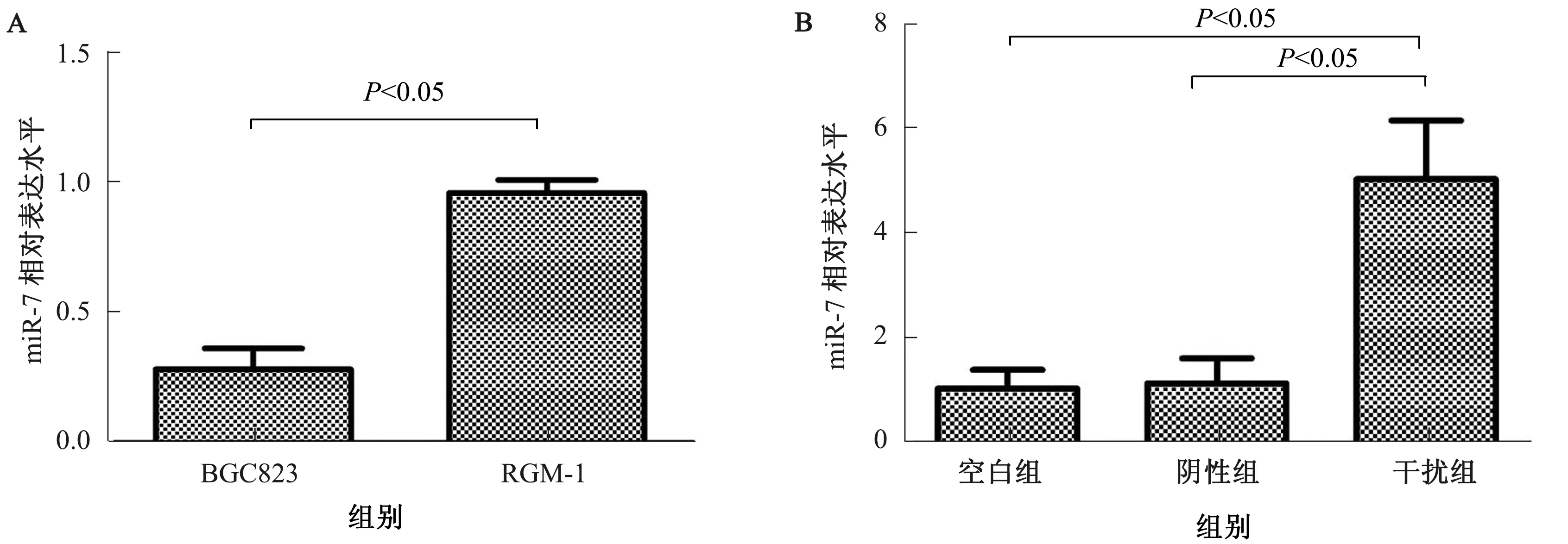
图1 qPCR检测miR-7表达结果 A:miR-7在胃癌BGC823细胞和正常胃黏膜上皮RGM-1细胞中的相对表达水平;B:转染48 h后,各组胃癌BGC823细胞中miR-7的相对表达水平Fig 1 The results of miR-7 expression detected by qPCR A: relative expression of miR-7 in gastric cancer BGC823 cells and normal gastric epithelial RGM-1 cells; B: relative expression of miR-7 in gastric cancer BGC823 cells after 48 hours transfection
2.2上调miR-7对胃癌BGC823细胞增殖的影响采用CCK-8法检测转染24 h、48 h和72 h的各组BGC823细胞中的OD值,结果如表1所示,空白组与阴性组细胞中OD值比较,差异无统计学意义(P>0.05),而干扰组细胞中的OD值较空白组显著降低,差异有统计学意义(P<0.05)。结果表明,上调miR-7可抑制胃癌BGC823细胞增殖。
2.3上调miR-7对胃癌BGC823细胞周期的影响转染miR-7 mimics 48 h后,流式细胞仪检测空白组、阴性组和干扰组中的细胞周期分布情况,结果如表2所示,与空白组相比,阴性组中G1期、S期和G2/M期细胞所占比例差异无统计学意义(P>0.05),而干扰组中G1期细胞所占比例显著升高,S期和G2/M期细胞所占比例显著下降,差异均有统计学意义(P<0.05)。结果表明,上调miR-7表达使胃癌BGC823细胞周期阻滞在G1期。为了进一步探讨上调miR-7对胃癌BGC823细胞增殖的机制,Western blotting检测了细胞周期相关蛋白CDK6、CDK4和Cyclin D1的相对表达情况。结果显示,上调miR-7表达后,BGC823细胞中CDK6、CDK4和Cyclin D1蛋白的相对表达水平均显著下降,差异有统计学意义(P<0.05)(见图2、表3)。

表1 上调miR-7对胃癌BGC823细胞增殖的影响Tab 1 The effect of up-regulation of miR-7 on the proliferation of gastric cancer BGC823 cells
注:与空白组相比,t24 h=11.061,t48 h=7.971,t72 h=10.521,*P<0.05。

表2 上调miR-7对胃癌BGC823细胞周期的影响Tab 2 The effect of up-regulation of miR-7 on the cell cycle of gastric cancer BGC823 %
注:与空白组相比,tG1=7.751,ts=6.662,tG2/M=8.855,*P<0.05。
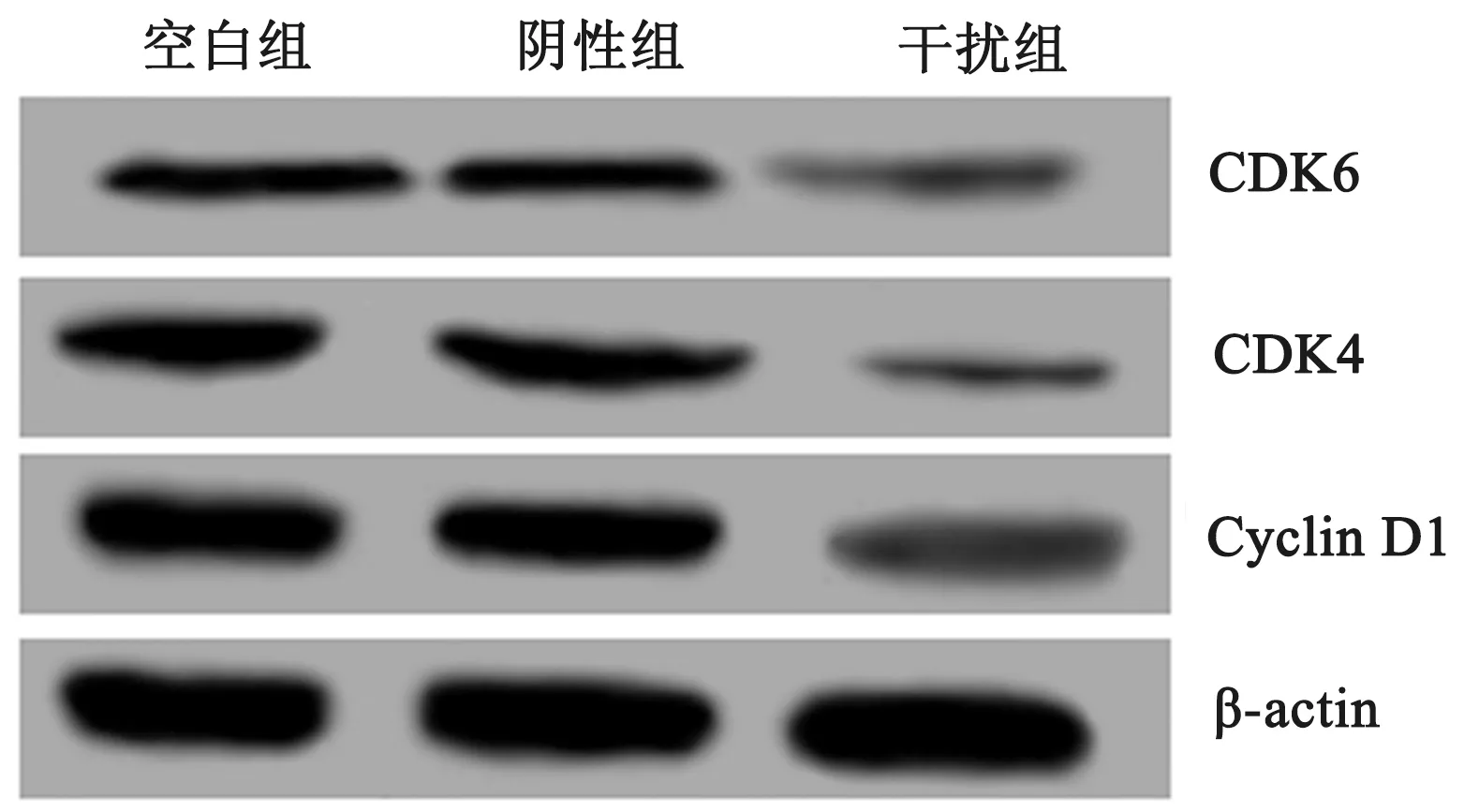
图2 Western blotting 检测CDK6、CDK4和Cyclin D1蛋白表达结果Fig 2 The expressions of CDK6, CDK4 and Cyclin D1 proteins detected by Western blotting

组别CDK6CDK4Cyclin D1空白组0.46±0.030.55±0.030.87±0.05阴性组0.44±0.050.51±0.060.82±0.08干扰组0.23±0.05*0.16±0.05*0.36±0.06*F值24.76359.18656.904P值<0.05<0.01<0.01
注:与空白组相比,tCDK6=6.832,tCDK4=11.585,tCyclin D1=11.310,*P<0.05。
2.4上调miR-7对胃癌BGC823细胞凋亡的影响流式细胞仪检测转染48 h后miR-7对胃癌BGC823细胞凋亡的影响,结果如图3所示,转染miR-7 mimics后,干扰组中BGC823细胞凋亡率为(25.62±2.35)%。与空白组的细胞凋亡率(5.82±1.25)%相比,干扰组的细胞凋亡率显著升高(t=12.884,P<0.01);阴性组的细胞凋亡率为(6.25±1.48)%,与空白组比较,差异无统计学意义(P>0.05)。结果表明,上调miR-7可促进BGC823细胞凋亡。为了探讨上调miR-7对胃癌BGC823细胞凋亡的作用机制,Western blotting进一步检测凋亡相关蛋白Cleaved Caspase-3和Bcl-2蛋白的表达情况。干扰组、阴性组和空白组细胞中Cleaved Caspase-3蛋白的相对表达量分别为0.38±0.05、0.16±0.03和0.13±0.02,Bcl-2蛋白的相对表达量分别为0.11±0.05、0.58±0.08和0.61±0.05。与空白组相比,干扰组中Cleaved Caspase-3蛋白表达量显著升高,Bcl-2蛋白表达量显著降低(P<0.05);阴性组Cleaved Caspase-3蛋白和Bcl-2蛋白的表达量与空白组相比,差异无统计学意义(P>0.05)(见图4)。
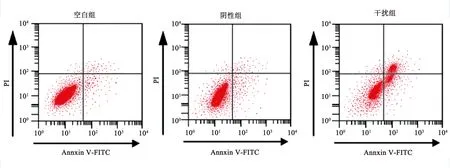
图3 上调miR-7对胃癌BGC823细胞凋亡的影响Fig 3 The effect of up-regulation of miR-7 on apoptosis of BGC823 cells

注:*:与空白组相比,t阴性组=1.441,P阴性组>0.05,t干扰组=8.041,P干扰组<0.05;#:与空白组相比,t阴性组=0.551,P阴性组>0.05,t干扰组=12.247,P干扰组<0.05。
3 讨论
miR-7是一种由位于9号染色体上的miR-7-1、位于15号染色体上的miR-7-2和位于19号染色体上的miR-7-3加工转录而成的相同成熟体,可编码23个氨基酸,具有一定的高度保守性[8-9]。研究[10-11]发现,miR-7在多种肿瘤细胞中呈异常表达,通过不同的调控机制在肿瘤细胞增殖凋亡过程中发挥着抑癌基因的作用。miR-7在肺癌和肝癌细胞中表达下调,上调其表达可通过抑制PI3K/AKT信号通路抑制癌细胞的增殖。在宫颈癌细胞系中,过表达的miR-7能够通过下调XIAP癌基因抑制HeLa细胞和C-33A细胞活力,促进细胞凋亡[12]。在肝癌细胞的转移过程中,过表达miR-7可能通过调控CCNE1的表达阻滞细胞周期从G1期向S期转移[13]。近年来,在miR-7通过抑制表皮生长因子受体的表达抑制胃癌细胞侵袭和转移的研究中发现,miR-7在胃癌组织中呈低表达,恢复其表达能够明显抑制胃癌MGC-803、MKN-45和SGC-7901细胞的侵袭和迁移[14]。可见,miR-7在胃癌的发生、发展过程中发挥着重要作用。胃癌的发生是一个复杂的过程,与癌细胞的恶性增殖、细胞周期的异常和细胞凋亡受阻等密切相关,但其具体的作用机制尚不完全明确。目前,关于miR-7对胃癌细胞增殖、凋亡的影响及其机制报道较少,本研究通过体外实验发现,miR-7在胃癌BGC823细胞中呈低表达,上调其表达能够明显抑制胃癌细胞增殖,促进细胞的凋亡,同时使细胞周期阻滞在G1期。
细胞周期和细胞凋亡是机体细胞生命活动的重要过程,两种生命活动的正常进行受多种靶基因或蛋白的调控。Cyclin D1、CDK4/6是细胞周期家族中的重要成员,参与细胞周期的正向调节,在G1期向S期转换过程中起着重要的促进作用[15-16]。Bcl-2是凋亡相关蛋白Bcl-2家族中重要成员,通过阻止细胞色素C激活Caspase、抑制细胞色素C从线粒体释放、拮抗Bax基因和抗氧化及维持细胞内钙稳态等作用机制在线粒体中直接或间接发挥抗凋亡作用;Caspase-3是细胞凋亡的重要执行蛋白酶,其活化表达代表着细胞凋亡已进入不可逆转的阶段。Bcl-2和Caspase-3在凋亡信号传递、传导和整合过程中发挥着重要作用[17-18]。研究[19-21]发现,Cyclin D1、CDK4/6、Bcl-2和Caspase-3在胃癌中异常表达,与胃癌的发生关系密切。有研究[22]显示,高表达miR-7可通过靶向XRCC2下调Cyclin D1和上调Caspase-3表达,抑制结肠癌细胞增殖和诱导细胞凋亡。为了探讨miR-7在胃癌中的作用机制,采用Western blotting 检测Cyclin D1、CDK4/6、Bcl-2和Cleaved Caspase-3的表达情况,结果发现,上调miR-7表达后,BGC823细胞中CDK6、CDK4、Cyclin D1和Bcl-2蛋白的相对表达水平均显著下降,Cleaved Caspase-3蛋白表达量显著升高。结果提示,过表达miR-7通过抑制CDK6、CDK4和Cyclin D1蛋白的表达使细胞周期阻滞在G1期,进而抑制胃癌BGC823细胞增殖;过表达miR-7通过上调Cleaved Caspase-3蛋白表达和下调Bcl-2蛋白表达促进BGC823细胞凋亡。
综上所述,miR-7在胃癌进展过程中发挥着重要作用,上调其表达可抑制胃癌细胞增殖,促进细胞凋亡,其作用机制可能与CDK6、CDK4、Cyclin D1和Bcl-2蛋白的表达下调,Cleaved Caspase-3蛋白表达升高有关。本研究只在细胞水平上进行了探讨,具有一定的局限性,后期还需要动物实验和临床试验进行更深入的研究,为miR-7在胃癌中作用机制研究及胃癌的基因靶向治疗提供新的理论依据。
