慢病毒介导过表达果糖-1, 6-二磷酸酶1基因降低胃癌细胞糖酵解水平的机制研究
2018-08-20王春芳徐瑜杰赵国栋
王春芳,刘 兵,孙 光,徐瑜杰,赵国栋
中南大学湘雅医学院附属海口医院胃肠外科,海南 海口 570208
肿瘤细胞的恶性增殖与细胞的异常代谢有着密切的关系。已有研究[1-3]证实,氧气充足条件下,肿瘤细胞仍然可以通过糖酵解途径供能完成自身的生物学行为。因此,阻断和抑制糖酵解途径可能是治疗肿瘤的潜在途径。果糖-1, 6-二磷酸酶1(FBP1)是一种糖异生限速酶,可转化糖酵解的中间产物阻断糖酵解过程,也可作为转录辅助因子,参与细胞的代谢过程。FBP1在肺癌、乳腺癌和肝癌等多种肿瘤组织中低表达,与肿瘤的发生、发展关系密切,沉默肝癌中FBP1表达可通过促进细胞的糖酵解,促进肝癌细胞的增殖和转移[4-6]。近年来有研究[7]指出,FBP1在胃癌中低表达,且其表达水平与肿瘤大小、临床分期、淋巴结转移有关,提示FBP1与胃癌的发生、发展有关。因此,本研究以胃癌SGC7901细胞为研究对象,观察慢病毒介导过表达FBP1对SGC7901细胞增殖迁移和糖降解的影响及其机制,以期为胃癌的发展机制和治疗提供新的理论依据及治疗靶点。
1 材料与方法
1.1材料人正常胃黏膜上皮GES-1细胞、胃癌SGC7901细胞和293T细胞购自美国ATCC,DMEM培养液、opti-MEM、青/链霉素、胰蛋白酶购自美国Corning公司,胎牛血清购自美国Gibco公司。辣根过氧化物酶标记的山羊抗鼠IgG二抗、缺氧诱导因子1α(HIF-1α,1∶800)和葡萄糖转运蛋白1(GLUT-1,1∶1 000)特异性一抗购自美国Santa Cruz公司,lipo2000购自美国Invitrogen公司,二甲亚砜、FBP1 shRNA和FBP1(1∶1 000)抗体购自美国Sigma-Aldrich公司,pLenti6.3/FBP1和pcDNA3.1购自美国GE Health Dharmacon公司。二喹啉甲酸(BCA)试剂盒和化学发光试剂盒购自美国Pierce公司,聚偏二氟乙烯(PVDF)膜购自美国Roche公司。CCK-8试剂盒购自南京凯基生物公司。PFK ELISA试剂盒购自美国Sigma公司,血气分析仪测试卡购自美国Abbott公司,酶标仪、蛋白电泳及转膜系统购自美国Bio-Rad公司,CO2恒温培养箱购自美国Thermo Forma Series Ⅱ公司。
1.2细胞培养、分组及病毒转染293T、SGC7901和GES-1细胞采用含胎牛血清DMEM完全培养液培养于体积分数为5% CO2、37 ℃和95%湿度的孵育箱中。待细胞铺满培养瓶底90%时,加质量浓度为2.5 g/L胰蛋白酶消化传代,收集对数生长期细胞进行实验。取生长良好的293T细胞,以5×105ml-1细胞接种至含血清DMEM培养液的培养皿上,常规培养24 h。在离心管中加入5 μg目标shRNA、10 μg pEXQV、10 μg pVSV-G 和2 ml opti-MEM充分混合。在另一离心管中加入1 μg opti-MEM和75 μg lipo2000充分混合。两离心管溶液混合,37 ℃下反应30 min。取5 ml培养皿中的293T细胞,加入上述混合液,常规培养24 h。次日,换培养液后加入丙酮酸钠10 μl孵育24 h。以3 000 r/min离心10 min,存储备用。取生长良好的对数生长期的SGC7901细胞,以细胞浓度5×105ml-1每孔接种100 μl 至6孔细胞板上,将细胞随机分为对照组(未转染)、NC shRNA组(转染空载体 pcDNA3.1质粒)和FBP1 shRNA组(转染pLenti6.3/FBP1质粒)。待细胞贴壁时,根据实验分组更换成含有1 ml DMEM培养液和1 ml病毒上清,再加入10 μg/ml凝胶胺孵育24 h。更换DMEM培养液后,加入2 μg/ml嘌呤霉素,常规培养48 h。
1.3RT-PCR检测收集生长良好的对数生长期SGC7901细胞和GES-1细胞,以Trizol法提取总RNA,参照反转录试剂盒说明书步骤获得模板链cDNA。根据设计的内参GAPDH引物:5′-CGGAGTCAACGGATTTGGTCGTAT-3′和5′-AGCCTTCTCCATGGTGGTGAAGAC-3′以及FBP1引物:5′-CGCGCACCTCTATGGCATT-3′和5′-TTCTTCTGACACGAGAACACAC-3′,采用PCR仪参照如下反应条件:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火延伸30 s,35个循环进行扩增。2-ΔΔCT法计算FBP1 mRNA的相对表达量。相同方法检测对照组、NC shRNA组和FBP1 shRNA组中FBP1 mRNA的表达水平。
1.4Westernblotting检测收集生长良好的对数生长期SGC7901细胞和GES-1细胞,于冰上加蛋白裂解液提取总蛋白,经BCA蛋白检测试剂盒对总蛋白定量后,取50 μg上样至SDS-PAGE电泳,每个样品设3个平行孔。转膜后置于含有50 g/L脱脂奶粉的封闭液封闭。加入1∶800~1∶1 000倍稀释的特异性一抗4 ℃下反应24 h,再加入1∶2 000倍稀释的二抗37 ℃反应2 h。于暗室中曝光后,以凝胶成像系统和Quantity One 4.6.2软件分析。相同方法检测对照组、NC shRNA组和FBP1 shRNA组中FBP1、GLUT-1和HIF-1α蛋白的表达水平。
1.5CCK-8和Transwell实验检测采用CCK-8法检测细胞增殖情况。收集慢病毒感染转染48 h后的对照组、NC shRNA组和FBP1 shRNA组的SGC7901细胞,制备浓度为3×105ml-1的单细胞悬液。在96孔细胞板上每孔接种100 μl,于培养箱中常规培养48 h后,加入CCK-8溶液10 μl,混合后继续培养4 h。采用酶标仪检测各组细胞在490 nm的吸光度(OD)值,以细胞存活率(%)=OD实验组/OD对照组×100%公式计算细胞存活率。实验重复3次。采用Transwell实验检测细胞的迁移能力。选取生长良好的对照组、NC shRNA组和FBP1 shRNA组细胞,以无血清培养液饥饿培养24 h后,胰蛋白酶消化制备单细胞悬液。以每孔3×105个细胞接种于Transwell小室中,并于下层加入500 μl含有100 g/L胎牛血清的培养基,均设置3个平行孔,于培养箱中孵育48 h后取出,加入质量浓度为40 g/L甲醛溶液1 ml,37 ℃下固定10 min。清洗后,再加入浓度为5 g/L结晶紫溶液1 ml,染色 30 min。磷酸缓冲液清洗晾干。湿棉签小心擦去上室中没有穿膜的细胞,采用光学显微镜,随机选择5个视野,观察穿膜细胞数。
1.6胞内PFK和胞外乳酸含量检测选取生长良好的对照组、NC shRNA组和FBP1 shRNA组细胞,分成2份,一份用于检测胞内PFK含量:加入蛋白裂解液提取总蛋白,并以BCA法对其定量。采用PFK ELISA检测试剂盒检测各组细胞内PFK含量。另一份用于检测胞外乳酸浓度:按照每孔100 μl(细胞浓度为3×105ml-1)接种对照组、NC shRNA组和FBP1 shRNA组细胞至96孔板上,常规条件下培养24 h后,参照血气分析仪测试卡使用说明书步骤测定各组细胞外乳酸含量。

2 结果
2.1FBP1在胃癌细胞中的表达及慢病毒感染转染效果RT-PCR检测人正常胃黏膜上皮GES-1细胞和胃癌SGC7901细胞中FBP1 mRNA的相对表达量分别为1.00±0.08和0.21±0.02;Western blotting检测两种细胞中FBP1 蛋白的相对表达量分别为0.63±0.04和0.13±0.01(见图1A)。SGC7901细胞中FBP1 mRNA和蛋白水平上的表达均明显低于GES-1细胞(P<0.05)。 慢病毒转染pLenti6.3/FBP1质粒和空载体pcDNA3.1质粒后分别转染SGC7901细胞,实时定量PCR和Western blotting检测其转染效果(见表1、图1B)。与对照组相比,转染空载体pcDNA3.1质粒的NC shRNA组细胞的FBP1 mRNA和蛋白表达水平无明显改变(P<0.05),而转染pLenti6.3/FBP1质粒的FBP1 shRNA组细胞中FBP1 mRNA和蛋白表达水平均显著升高(P<0.05)。
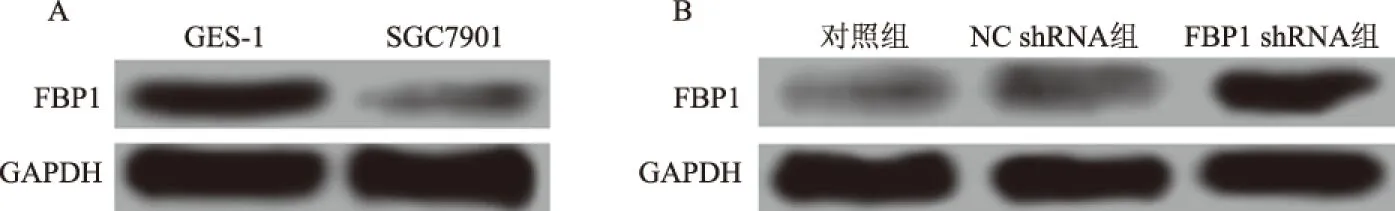
图1 Western blotting检测胃癌细胞中FBP1蛋白的表达 A:FBP1蛋白在胃黏膜上皮细胞GES-1和胃癌SGC7901细胞中的表达;B:慢病毒转染后各组SGC7901细胞中FBP1蛋白的表达Fig 1 The expression of FBP1 protein in gastric cancer cells detected by Western blotting A: expression of FBP1 protein in gastric epithelial cell GES-1 and gastric cancer SGC7901 cells; B: FBP1 protein expression in SGC7901 cells of each group after lentivirus infection

组别FBP1 mRNAFBP1蛋白对照组1.00±0.070.11±0.03NC shRNA组1.05±0.060.15±0.03FBP1 shRNA组 5.48±1.25* 0.68±0.06*F值37.904168.722P值0.0000.000
注:与对照组相比,*P<0.05。
2.2上调FBP1表达对胃癌SGC7901细胞增殖和迁移能力的影响CCK-8法和Transwell实验检测各组SGC7901细胞的增殖和迁移情况。FBP1 shRNA组中SGC7901细胞的存活率和穿膜细胞数与对照组相比明显降低,差异均有统计学意义(P<0.05);而NC shRNA组中细胞存活率和穿膜细胞数与对照组相比,差异均无统计学意义(P>0.05)(见表2)。
2.3上调FBP1表达对胃癌SGC7901细胞中GLUT-1和HIF-1α蛋白表达的影响Western blotting检测结果显示,与对照组相比,FBP1 shRNA组SGC7901细胞中GLUT-1和HIF-1α蛋白水平均显著降低(P<0.05),而NC shRNA组中两种蛋白的表达水平无显著变化(P<0.05)(见图2、表3)。

表2 各组SGC7901细胞的存活率和穿膜细胞数Tab 2 The survival rate and the number of membrane cells of SGC7901 cells in each n=3)
注:与对照组相比,*P<0.05。

图2 Western blotting检测各组SGC7901细胞中GLUT-1和HIF-1α蛋白的表达Fig 2 The expressions of GLUT-1 and HIF-1α proteins in SGC7901 cells of each group tested by Western blotting
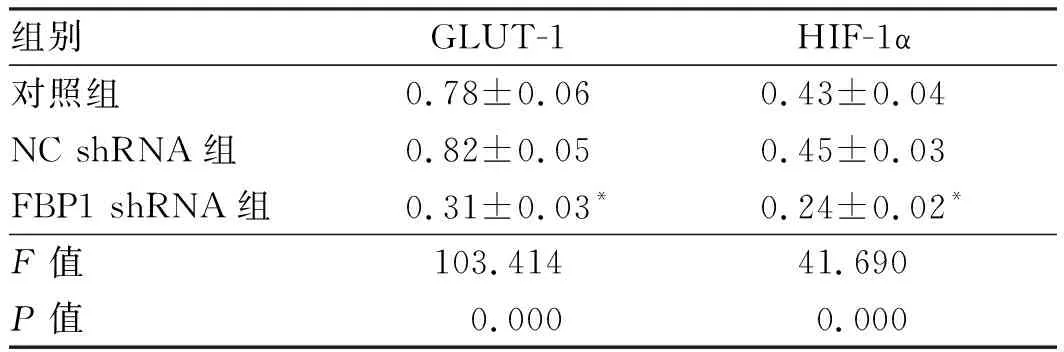
组别GLUT-1HIF-1α对照组0.78±0.060.43±0.04NC shRNA组0.82±0.050.45±0.03FBP1 shRNA组0.31±0.03*0.24±0.02*F值103.41441.690P值0.0000.000
注:与对照组相比,*P<0.05。
2.4上调FBP1表达对细胞内PFK和胞外乳酸含量的影响与对照组相比,NC shRNA组细胞内PFK和胞外乳酸含量差异无统计学意义(P<0.05),而FBP1 shRNA组细胞内PFK和胞外乳酸含量均明显降低,差异有统计学意义(P<0.05)(见表4)。

表4 各组SGC7901细胞内PFK和胞外乳酸含量Tab 4 PFK and extracellular lactate contents in SGC7901 cells mmol/L
注:与对照组相比,*P<0.05。
3 讨论
肿瘤细胞在有氧条件下可通过糖酵解过程为自身供能进行恶性增殖,这可能是肿瘤发展的重要机制,调控糖酵解过程也往往可以影响肿瘤细胞的生长。XU等[8]指出,改善糖酵解能显著提高大肠癌细胞的增殖和侵袭能力;GUO等[9]指出,抑制糖酵解能够促进胃癌细胞凋亡。因此,阻断或抑制肿瘤细胞的糖酵解过程有望成为治疗肿瘤的潜在手段。果糖-1, 6-二磷酸酶(FBP)是糖异生的限速酶,而糖异生是糖酵解的逆反应,FBP1属于FBP家族成员,在维持糖酵解和糖异生平衡过程中发挥着重要作用。FBP1在多种肿瘤中异常表达,可介导糖酵解过程参与肿瘤细胞的生物学过程。YU等[10]研究发现,FBP1在胰腺癌中低表达,通过减少葡萄糖摄取、乳酸生成和关键糖酵解基因的转录调控胰腺癌的糖酵解过程,进而影响癌细胞增殖和侵袭。ZHANG等[11]发现,FBP1在肺癌组织和细胞中表达下调,与肺癌患者预后不良有关,恢复FBP1表达抑制葡萄糖摄取和乳酸生产,也抑制了肺癌细胞在缺氧状态下的增殖和侵袭。有报道[8]显示,FBP1在胃癌组织中异常低表达,可作为胃癌病情和预后的预测指标之一。因此,本研究从糖酵解方面入手研究FBP1在胃癌SGC7901细胞增殖迁移中的作用,对胃癌发生、发展和治疗具有重要意义。
本研究通过慢病毒介导成功构建FBP1过表达的SGC7901细胞后,采用CCK-8法和Transwell实验检测SGC7901细胞的增殖和迁移能力。结果发现,上调FBP1表达可明显抑制SGC7901细胞的增殖和迁移。提示FBP1在胃癌的发生、发展中具有重要作用。该结果也反向印证了LI等[12]通过下调FBP1表达促进胃癌转移的结果。HIF-1α是广泛存在的转录因子,缺氧条件下可通过转录调节作用使肿瘤细胞适应环境,在肿瘤细胞能量代谢和血管再生方面发挥着重要的促进作用[13];GLUT-1是一种重要的葡萄糖转运蛋白,在调控葡萄糖摄取,维持糖代谢和调控肿瘤细胞的增殖、分化和转移等方面具有重要作用[14]。本研究采用Western blotting进一步检测SGC7901细胞中GLUT-1和HIF-1α蛋白表达发现,上调FBP1表达能够明显抑制GLUT-1和HIF-1α蛋白。这一结果与SHI等[15]所发现过度表达FBP1可通过靶向HIF-1α和GLUT1抑制糖酵解进而抑制乳腺癌细胞的生长和迁移的结果相吻合。此外,本研究还通过检测SGC7901细胞内糖酵解途径相关酶PFK含量和胞外糖酵解终产物乳酸含量进一步验证糖酵解水平被抑制的结果。提示,FBP1可能通过抑制GLUT-1和HIF-1α表达,降低胞内PFK含量,抑制SGC7901细胞的糖酵解过程,进而发挥抑制细胞增殖和迁移的作用。
综上所述,FBP1过表达能够通过降低细胞的糖酵解水平抑制胃癌SGC7901细胞的增殖和迁移,其作用机制可能与抑制GLUT-1和HIF-1α表达有关。这一结果进一步阐明了胃癌的发生、发展机制,也为胃癌以FBP1为靶点的治疗提供参考依据。
