斑块型汗孔角化症一家系MVK基因突变检测
2018-08-20叶珊珊李莹洁王东霞王再兴
叶珊珊 李莹洁 王东霞 李 卉 王再兴
汗孔角化症(porokeratosis,PK)是一种常染色体显性遗传的慢性角化不全性皮肤病,具有遗传异质性[1]。1875年Isidor Neuman首次发现此病特点,但于1893年被Vittorio Mibelli命名为“汗孔角化症”[2]。继斑块型汗孔角化症(porokeratosis of Mibelli,PM)被发现后,PK的其它几种常见临床亚型及少见特殊类型陆续被认识,而播散性浅表性光化性汗孔角化症(DSAP)是最为常见的一种亚型。PK临床表现可见中央萎缩,边缘呈堤状隆起的环状斑块,病理检查以角化不全柱为其特征性表现[3]。其中,斑块型汗孔角化症(PM)常表现为单个或数个孤立性环状的角化不全性皮损,少数可出现直径达20 cm的斑块[4]。PM常于儿童期发病,病变于四肢多见,但身体其他部位也可能受影响,如手掌、足底、口唇黏膜及生殖器部位[5]。临床上极少出现不同类型的汗孔角化症同时出现在同一个体,但既往有报道表明PM可与浅表播散型、线状型、疣状斑块型及播散性浅表性光化性汗孔角化症共存[6]。同时,PM具有一定的恶变风险。由于PK的发病呈家族聚集性,进一步证明遗传因素在疾病发生具有重要作用。目前研究发现甲羟戊酸途径相关酶突变与PK的发生密切相关,主要包括MVK、PMVK、MVD、FDPS[7]。其中MVK基因位于12q24.11,含有11个外显子,约23 576 bp,仍是目前研究的热点基因。早期研究认为,MVK基因的突变为DSAP主要的致病基因,后经学者们进一步验证发现,MVK与PM的发病同样具有密切相关性。在本研究中,我们通过对1个斑块型汗孔角化症家系7例患者进行了MVK基因的突变检测,并进一步明确MVK基因突变与PM发病的相关性。
1 资料与方法
1.1 研究对象 本研究对象为1个PM家系,其中包括先证者和6例家系患者,7例患者均具有典型PM临床表现,其中先证者由安徽医科大学第一附属医院皮肤科专家确诊,并行组织病理检查进一步明确。先证者临床表现为:双下肢及躯干部对称分布的呈黄豆至蚕豆大暗棕色环状斑块,边缘呈堤状隆起,中央见萎缩状(图1a)。皮肤组织病理可见典型的角化不全柱(图1b)。该家系为3代,发病年龄在5~38岁不等(图2),家系其他6例患者皮损均较轻,病变部位于右下肢伸侧单发多见(图1c),均为斑块状,偶伴有瘙痒不适症状。
1.2 实验方法
1.2.1 样本收集 在获得该家系成员知情同意的情况下,我们抽取了7例发病患者和家系内2名未发病健康对照的外周静脉血液样本各5 mL于EDTA抗凝管内,并置于-80℃冰箱中保存。
1.2.2 外周血DNA提取 将冷冻样本于常温中解冻化开。使用人外周血全血基因DNA提取试剂盒(QIAGEN,德国),按照标准操作程序,提取该家系血液样本中的DNA。并将提取到的DNA进行纯度检测标化。
1.2.3 PCR引物设计 通过美国国家生物信息中心数据库(NCBI)检索出MVK基因外显子序列,并应用在线Primer3.0 软件对MVK基因所有外显子进行引物设计。所有引物由上海天昊生物科技有限公司合成。
1.2.4 PCR引物扩增、纯化 PCR反应在2720型PCR扩增仪(美国ABI公司)上完成。总反应体积为20 μL。扩增循环参数:95℃预变性15 min;94℃变性15 s,62℃退火40 s,每循环减0.5℃,72℃延伸1 min,共11个循环;94℃变性15 s,57℃退火30 s,72℃延伸1 min,共24个循环;最后72℃延伸2 min,4℃保存。8 μL PCR产物与0.5 U 虾碱性磷酸酶和4 U核酸外切酶混合,放入水浴锅中,37℃孵育1 h,随后75℃ 15 min将虾碱性磷酸酶和核酸外切酶灭活,取得纯化PCR产物。
1.2.5 DNA序列分析 纯化后的PCR产物采用3730XL遗传分析仪直接测序,并将测序结果在Polyphred 软件上进行分析,同时将检测出的结果与既往测得的676名健康对照的全部外显子进行比较[8]。
2 结果
通过对比MVK基因编码区的全部外显子及其侧翼序列,在7例发病患者的6号外显子上均发现c.604G>A(p.Gly202Arg)错义突变,即第604位的鸟嘌呤(G)突变为腺嘌呤(A),导致蛋白质序列的第202位甘氨酸突变为精氨酸(图3)。同时将该突变与676名健康对照的全部外显子进行对比后,未发现此突变。应用SIFT和Polyphen工具对该突变进行分析,得出分值分别为0和1,推算出该突变为有害突变[1]。
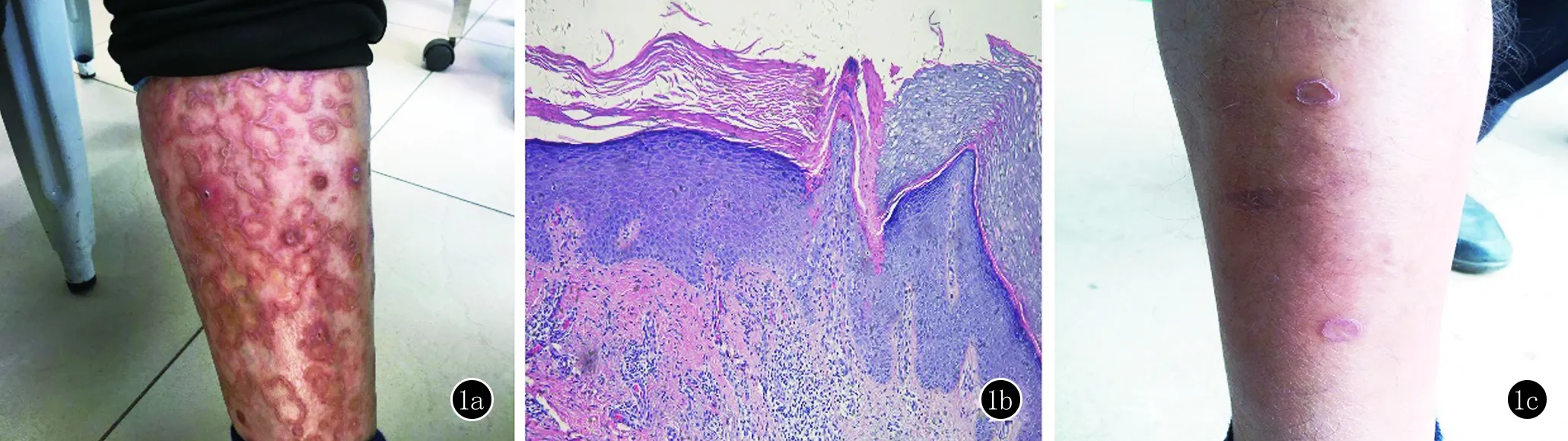
图1 1a为先证者,下肢可见密集分布的暗棕色环状斑块,边缘隆起,少许鳞屑;1b为先证者组织病理,镜下可见角化不全柱,颗粒层消失,真皮血管扩张,周围炎细胞浸润(HE,×40);1c为家系中发病患者,右下肢见两个孤立性环状斑块
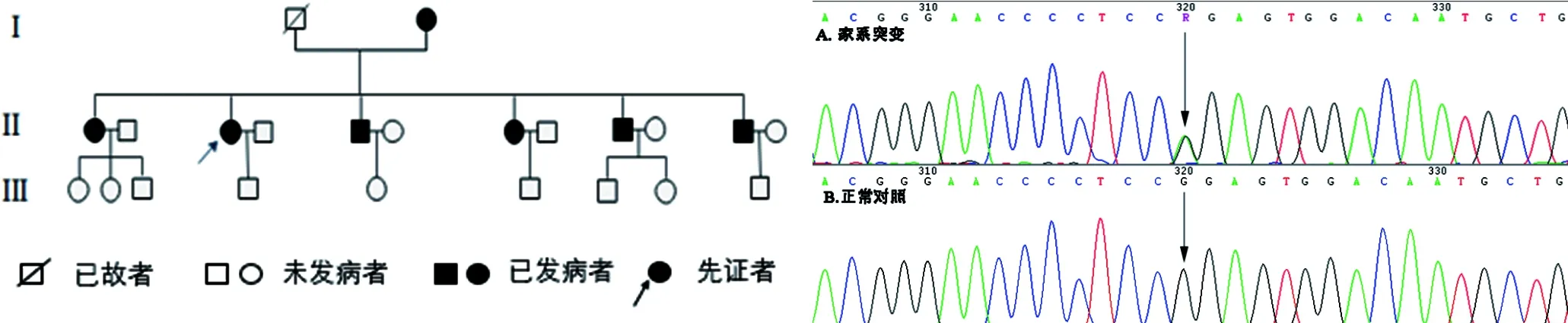
图2 汗孔角化症患者家系图 图3 家系突变检测图
3 讨论
汗孔角化症(PK)是一种少见的慢性进行性角化不全的皮肤疾病,为常染色体显性遗传性疾病,具有遗传异质性。临床上可见一个或多个边缘堤状隆起,中央萎缩的环状斑块,局部出现或散发于全身。角化不全柱为组织病理的特征表现。虽然目前对PK发生的病因尚不清楚,但认为长期紫外线照射、器官移植、脏器功能衰竭及免疫受抑等原因导致角质形成细胞异常克隆有关[9,10]。结合本家系先证者临床表型及组织病理,可明确诊断为PM,于1893年首先被Vittorio Mibelli认识并命名的一种常见类型的汗孔角化症。在本家系中,发病患者可见与先证者类似皮损,但多为单个或数个孤立性斑块,于四肢多见,幼年至青年时发病,同样符合PM诊断特点。
PM进展缓慢,但可出现数量增多,皮损加重等情况,如本家系中的先证者,也可进一步出现恶变可能。早在1942年首先由Vigne报道出,7%的斑块型汗孔角化症患者可能出现恶变趋势。这种致癌潜能可能是由于角样板层附近的角质形成细胞中p53过度表达导致的结果[11]。因而早期积极干预,定期随访是本病治疗的一个关键措施。
近年国内学者研究发现,甲羟戊酸途径上相关酶基因突变,与汗孔角化症的发生密切相关,其中主要包括MVK、PMVK、MVD、FDPS。早在2012年,国内学者Zhang采用全基因组外显子测序,发现了MVK为播散性浅表性光化性汗孔角化症(DSAP)的致病基因,但并未发现MVK与PM的发病具有关联性[12]。随后在2014年,Zeng通过全基因组测序的方法,在1个PM家系中,发现了MVK上的突变位点c.1039+1G>A,进一步证实MVK参与了PM的发病[5]。2015年,Zhang等通过平行测序和外显子拷贝数变异分析,发现PK患者中存在甲羟戊酸途径相关酶的基因突变,其中23例PM患者为MVK突变,这进一步明确,MVK与PM的发病密切相关[1]。在本次研究中,我们结合家系临床表型并将该家系DNA进行Sanger测序筛查后发现,在MVK基因上第6号外显子,编码序列为c.604 G>A的错义突变,是既往于播散性浅表性光化性汗孔角化症(DSAP)患者中发现过的突变位点[1,12],更加证实MVK是PM的致病基因。
根据近年国内学者归纳的关于DSAP突变基因发现,MVK的突变率为60.3%,其突变热点为c.395delT和c.604G>A,突变比率均为5.7%[13]。后一突变热点与本家系突变一致,但不同的是,在本家系中该突变导致的临床表型为斑块型汗孔角化症。结合本家系研究,猜测MVK上的c.604G>A突变在斑块型汗孔角化症及播散性浅表性光化性汗孔角化症均能发生致病作用。
MVK基因编码的甲羟戊酸激酶是甲羟戊酸途径上的关键酶,此通路对细胞的生长、分化具有重要作用,而MVK基因突变可能导致酶结构功能及活性的改变,从而促进了PK的发生。MVK基因上目前已发现40余种突变位点[14]。通过既往研究总结发现,MVK基因突变可见于多个临床表型[15],其中常见的有斑块型PK、播散性浅表性PK、播散性浅表性光化性PK[14]和线状PK。且在不同个体中,即使携带同一突变位点也可能出现不同的临床表型,这可能与患者所处的生活状态及环境因素密切相关。本文通过对1个PM家系进行MVK基因的突变研究,检测出了一个既往于DSAP患者中发现过的突变位点c.604 G>A,进一步证明了MVK与PM的发病密切相关,更值得关注的是c.604 G>A为PM与DSAP共同的突变位点,这更加让我们深刻地认识到外界因素对遗传疾病的临床表型具有重要作用。
