Notch信号通路在咪喹莫特诱导的银屑病样小鼠模型中的表达
2018-08-20王小康林向飞朱晓芳
潘 敏 王小康 赵 莎 林向飞 朱晓芳
银屑病(psoriasis)是一种常见的慢性炎症性疾病,典型表现为身体多处皮肤表面的鳞屑样红斑。在欧洲和美国,发病率接近2%,其他地区相对较少。2010年中国六省市银屑病流行病学调查研究发现中国人患病率为0.47%。在银屑病发病机制研究中发现T淋巴细胞活化及信号转导是银屑病发病机制中的关键环节,对于银屑病的发生和发展起着重要作用[1-3]。研究表明,在银屑病相关的信号通路中,Notch信号通路与角质形成细胞的增殖和凋亡与银屑病发生关系密切,其中受体Notch1-4、配体Jagged-1、目标基因Hes1均为Notch信号通路的关键信号分子[4-6]。本研究通过建立咪喹莫特(imiquimod,IMQ)诱导的银屑病小鼠模型,观测Notch1、Notch2、配体Jagged-1、目标基因Hes-1等在模型小鼠皮损和对照组小鼠皮损中的表达水平,从而进一步明确Notch信号通路在银屑病发病机制中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性BALB/c小鼠,6~8周龄,购买于扬州大学比较医学中心,饲养于SPF级动物室。
1.1.2 试剂及仪器 凡士林乳膏(南昌白云药业有限公司),5%咪喹莫特乳膏(四川明欣药业有限责任公司),薇婷护肤脱毛膏[利沾时家化(中国)有限公司],抗Notch1-2、Jagged-1及Hes-1蛋白单克隆抗体(美国Abcam公司),通用型二抗及抗体稀释液(美国Abcam公司);Trizol RNA提取试剂((北京BioTeke公司);iScript cDNA kit逆转录试剂盒(美国BioRad公司);iTaqTMSYBR-Green Real Time PCR试剂盒(美国ABI公司);DAB试剂盒(北京中衫金桥生物有限公司);显微镜(OLYMPUS BX43)。
1.2 方法
1.2.1 动物模型建立 取BALB/c小鼠30只,随机分为IMQ模型组20只和空白对照组10只,用戊巴比妥钠80 mg/kg腹腔注射麻醉,小心剃去小鼠背部中央区域的被毛,温和型脱毛膏脱去毳毛,形成约2 cm×3 cm暴露区域。空白对照组:小鼠背部抹凡士林乳膏50 mg/cm2在脱毛部位,1次/d,连续7 d;IMQ模型组:小鼠背部抹按50 mg/cm2剂量均匀涂在脱毛部位,1次/d,连续7 d。
1.2.2 HE染色观察皮损病理变化 于造模及处理后第8天小鼠拉颈处死后剪取小鼠皮损处皮肤甲醛固定,石蜡包埋,采用HE染色观察IMQ模型组及空白对照组皮肤病理变化。
1.2.3 实时定量RT-PCR(Real-time RT-PCR)检测IMQ模型组及空白对照组皮肤受体Notch1、Notch2、配体Jagged-1、目标基因Hes-1的mRNA表达水平 用RNA提取试剂盒提取组织样本中总RNA,用iScript cDNA kit逆转录试剂盒将RNA反转录为cDNA,实验操作按产品说明书进行。采用实时荧光定量PCR法进行扩增,引物序列见表1,β-actin作为内参。按照iTaqTMSYBR-Green Real Time PCR试剂盒要求,将反转录产物cDNA作为模板进行两步法PCR反应:预变性95℃ 1 min;循环时95℃变性15 s,60℃退火20 s,72℃延伸30 s,进行50个循环。检测数据应用2-ΔΔCt法进行分析,检测目的基因的相对表达量。
1.2.4 免疫组化观察皮损处受体Notch1、Notch2、配体Jagged-1、Hes-1的蛋白表达水平 采用免疫组化SABC法检测IMQ模型组及空白对照组皮损处受体Notch1、Notch2、配体Jagged-1、Hes-1的蛋白表达水平。常规石蜡包埋的皮肤组织脱蜡、水化,切片经高压抗原修复5 min,甲醇-过氧化氢阻断内源性过氧化物酶10 min,加入稀释的一抗Notch1(1∶100)、Notch2(1∶100)、Jagged-1(1∶100)、Hes-1(1∶100),4℃孵育过夜;滴加二抗,常温孵育30 min; DAB 显色,苏木素复染,酒精梯度脱水,二甲苯透明和中性树胶封片,显微镜下观察和拍片。根据阳性细胞百分比( 5个×400倍随机视野的阳性细胞百分比平均值) 及染色强度( 多数细胞的染色情况积分) 进行综合评分。阳性细胞百分比:无阳性为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。染色强度按颜色深浅计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两项相加为综合评分:0分为阴性,1~3分为弱阳性(+),4~5分为中度阳性(++),6~7分为强阳性(+++)。
1.2.5 统计学方法 实验数据以均数±标准差表示,采用SPSS19.0统计软件进行统计学分析,采用t检验、Ridit分析法对数据进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 IMQ模型组及空白对照组皮肤病理变化 HE染色显示,空白对照组皮肤菲薄,仅见2~3层形态正常的细胞;IMQ模型组小鼠表皮明显增厚,表皮层细胞数量增加,表皮层向下延伸,可见明显角化过度伴有角化不全,棘层细胞显著增厚,真皮炎症大量浸润,表现为典型银屑病样改变(图1)。
2.2 IMQ模型组较空白对照组皮肤的受体Notch1、Notch2、配体Jagged-1、目标基因Hes-1的mRNA表达水平升高 IMQ模型组的Notch1的mRNA水平高于空白对照组,t=3.550,P<0.05;IMQ模型组的Notch2的mRNA水平高于空白对照组,t=3.575,P<0.05;IMQ模型组的Jagged-1的mRNA水平高于空白对照组,t=3.732,P<0.05;IMQ模型组的Hes-1的mRNA水平高于空白对照组,t=3.506,P<0.05(图2)。
2.3 IMQ模型组较空白对照组皮肤的受体Notch1、Notch2、配体Jagged-1、目标基因Hes-1的蛋白表达水平升高 在光镜下,Notch1、Notch2、Jagged-1、Hes-1阳性表达表现为表皮角质形成细胞中出现浅黄色至棕黄色均匀或颗粒沉着。IMQ模型组皮损组织表皮角质形成细胞中Notch1、Notch2、Jagged-1、Hes-1的表达阳性率显著高于空白对照组组织表皮角质形成细胞,差异有统计学意义(P<0.05) ,见表2。Notch1、Notch2、Jagged-1、Hes-1在IMQ模型组皮肤表皮角质形成细胞中的阳性表达以中度阳性、强阳性为主,在空白对照组表皮角质形成细胞中的表达以阴性、弱阳性为主。见图3~6。

表1 引物序列

图1 IMQ模型组及空白对照组皮肤组织病理(HE,×100) 1a:空白对照组皮肤菲薄,仅见2~3层形态正常的细胞;1b:IMQ模型组小鼠表皮明显增厚,表皮层细胞数量增加,表皮层向下延伸,可见角化过度、角化不全、棘层细胞显著增厚,真皮炎症细胞浸润
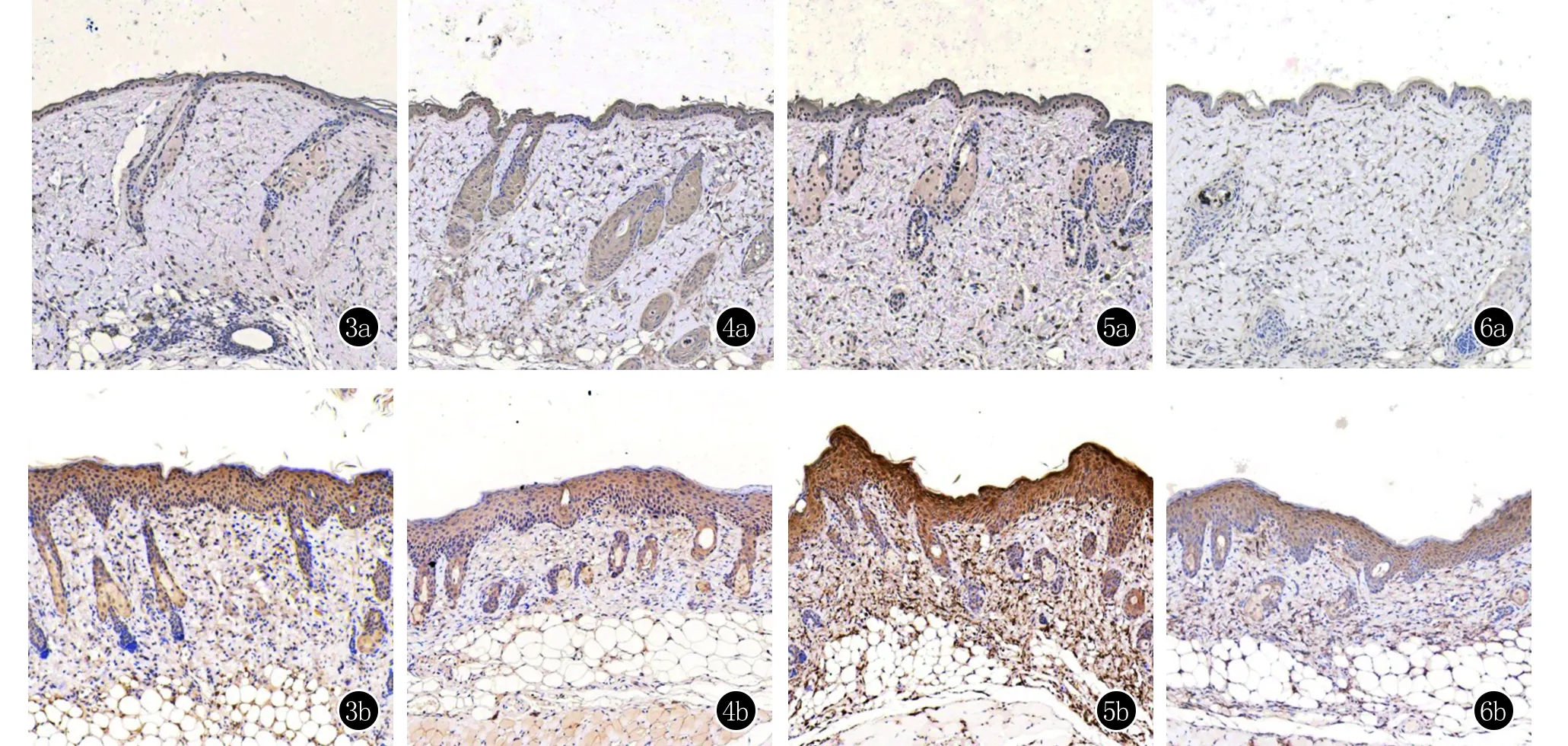
图3 IMQ模型组及空白对照组皮肤Notch1的表达(免疫组化,×100) 3a:空白对照组表皮角质形成细胞中的表达以阴性、弱阳性为主;3b:IMQ模型组皮肤表皮角质形成细胞中的阳性表达以中度阳性、强阳性为主 图4 IMQ模型组及空白对照组皮肤Notch2的表达(免疫组化,×100) 4a:空白对照组表皮角质形成细胞中的表达以阴性、弱阳性为主;4b:IMQ模型组皮肤表皮角质形成细胞中的阳性表达以中度阳性、强阳性为主 图5 IMQ模型组及空白对照组皮肤Jagged-1的表达(免疫组化,×100) 5a:空白对照组表皮角质形成细胞中的表达以阴性、弱阳性为主;5b:IMQ模型组皮肤表皮角质形成细胞中的阳性表达以中度阳性、强阳性为主 图6 IMQ模型组及空白对照组皮肤Hes-1的表达(免疫组化,×100) 6a:空白对照组表皮角质形成细胞中的表达以阴性、弱阳性为主;6b:IMQ模型组皮肤表皮角质形成细胞中的阳性表达以中度阳性、强阳性为主
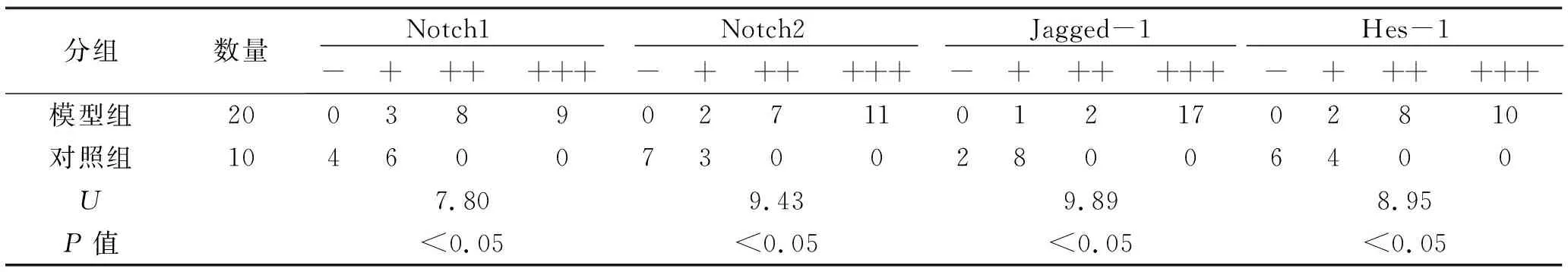
表2 IMQ模型组及空白对照组皮肤Notch1、Notch2、Jagged-1、Hes-1的表达
3 讨论
银屑病是一种常见的以角质形成细胞过度增生、角化不全、炎症细胞浸润和新生血管形成为主要组织病理改变的慢性炎症性皮肤病,以鳞屑性红斑为典型皮损表现,其病因和发病机制非常复杂,目前为止仍未完全阐明[7]。近年的研究发现,Notch信号改变与银屑病的表皮细胞过度增生、炎症细胞浸润和新生血管形成发生发展有密切关系[8,9]。Notch信号传导通路由4种受体(Notch1-4)、5种配体(Jagged-1、Jagged-2、Delta-like-1、Delta-like-3、Delta-like-4)和DNA结合蛋白3部分组成。Notch信号传导过程中,Notch信号蛋白共经历了3次剪切过程。Notch基因编码的Notch受体前体蛋白在核糖体合成以后,首先在高尔基体被Fringe糖基转移酶切割为两个片段,转运到细胞膜后组成异二聚体形成成熟的Notch受体。当Notch配体与受体结合后触发Notch信号的活化,Notch受体相继发生两次蛋白水解后生成活性片段Notch细胞内段(NICD),NICD释放入胞浆后由细胞内体通过内吞作用将转运至核内与转录抑制物CSL、Foxp3结合,进一步激活Bcl2、Hes1,Hes5等下游靶基因家族,从而促进细胞分化[10]。因此,受体Notch1、Notch2、配体Jagged、目标基因Hes1均为Notch信号通路的关键信号分子。
咪喹莫特(imiquimod, IMQ),是一种很强的免疫激活剂,临床上常用作由人乳头状瘤引起的生殖道和肛周疣的局部治疗。IMQ是Toll 样受体7(Toll-like receptor7,TLR7)的激动剂,当其被激活后,能引起免疫调控因子的改变,进一步产生炎性反应及损伤。当用咪喹莫特涂抹动物皮肤后,出现鳞屑、红斑、皮肤褶皱及增厚,呈现银屑病样皮损[11]。因此咪喹莫特皮损模型也是目前热点研究的银屑病样皮损动物模型之一[12]。
我们的预实验提示IMQ外用诱导银屑病样皮损在连续用药后第7天达到高峰,然后逐渐改善。因此我们以IMQ造模小鼠,同时建立空白对照组,在试验第8天采集试验所需标本,研究发现,IMQ可成功诱导银屑病小鼠模型,RT-PCR结果提示IMQ模型组较空白对照组皮肤的受体Notch1、Notch2、配体Jagged-1、目标基因Hes-1的mRNA表达水平升高,免疫组化结果提示IMQ模型组较空白对照组皮肤的受体Notch1、Notch2、配体Jagged-1、目标基因Hes-1的蛋白表达水平升高。因此可以认为,IMQ诱导的银屑病小鼠模型中Notch信号转导表达增加, Notch信号通路传导活化信号的能力增强,可以推断Notch信号通路活化参与了银屑病的发生发展过程。本实验的研究对象为咪喹莫特诱导的银屑病样皮炎小鼠模型,实验结果与国外关于银屑病病人血液、皮损的Notch表达方面的研究结果趋势一致[13,14],证实了咪喹莫特诱导的银屑病样皮炎小鼠模型作为银屑病动物模型的可靠性。本实验就银屑病相关的Notch信号转导进行了初步研究,但是银屑病的病因和发病机制非常复杂,多种信号通路异常参与其中,Notch信号通路的其他因子以及其与其他类型信号通路(如NF-κB、SMAD等)在银屑病发病机制方面的串话关系仍有待进一步研究。
