IL-35在特应性皮炎样小鼠模型中的表达
2018-08-20张丽霞
王 倩 刘 伟 薛 竞 王 勤 张丽霞
特应性皮炎(atopic dermatitis, AD)是一种常见的慢性、复发性、炎症性皮肤病,主要表现为湿疹样皮炎、顽固性瘙痒及皮肤干燥、皮肤屏障损害,病程中常伴有哮喘和/或过敏性鼻炎。在过去的二三十年间,全球AD的患病率大幅度增加,有学者回顾了1990-2010年间的69项研究,显示在部分发达国家儿童AD患病率已高于20%,并且在非洲、东亚等发展中国家患病率也在增高[1]。AD确切发病机制未明,但免疫失衡已被认为在其发病中起重要作用。近年研究发现,除Th2细胞占优势外,Th17/Treg细胞之间平衡状态的打破也可能是关键因素。IL-35作为一种由Treg细胞分泌的新抑制性细胞因子在炎性疾病中的作用开始受到重视,但IL-35与AD发病的关系目前尚未见报道。本研究旨在利用特应性皮炎样小鼠模型初步探讨IL-35在特应性皮炎发病中的作用。
1 材料与方法
1.1 实验动物及试剂 4~6周龄SPF级BALB/c雌性小鼠30只(成都达硕生物科技有限公司);2, 4-二硝基氟苯(DNFB,美国Sigma公司);小鼠IL-35、IL-4、IFN-γ、IL-17 ELISA试剂盒(上海鑫乐生物科技有限公司);TRIZOL(美国Invitrogen公司);PrimeScript RT reagent Kit[宝生物工程(大连)有限公司];SYBR Premix Ex Taq II Kit[宝生物工程(大连)有限公司];引物由上海生工生物工程技术服务有限公司设计合成,序列为:IL-12p35上游引物5’-CATCTGGCGTCTACACTGCTGCTGAA-3’,下游引物5’-ACTGAGGTGGTTTAGGAGGGCAAGGG-3’;EBI3上游引物5’-TCCAAGGAACAGAGCCACAGAGCAT-3’,下游引物5’-TGAAGGACGTGGATCTGGTGGAGTTG-3’;酶标仪(型号Multiskan Mk3,美国ThermoFisher仪器有限公司);实时荧光定量(RT-PCR)仪(型号PikoReal,美国ThermoFisher仪器有限公司)。
1.2 方法
1.2.1 特应性皮炎动物模型的建立 参照本研究小组既往实验建立模型[2]:小鼠先在恒温恒湿清洁级环境中饲养2周,适应环境之后进入实验。实验前用8%硫化钠淀粉溶液脱去小鼠背部面积约2 cm×4 cm毛发。将30只小鼠随机分为模型组及对照组,每组15只。模型组用丙酮:橄榄油3∶1溶液作为基质配置0.5% 2,4-二硝基氟苯(DNFB),0.5%DNFB 100 μL外涂背部进行2次诱导(实验第1天和第2天各涂搽一次),实验第2周(第7天)起每隔2天背部涂搽1次,每次70 μL,第28天涂搽后造模完成。对照组小鼠背部脱毛区给予等量基质(丙酮∶橄榄油3∶1),时间及涂搽剂量与实验组一致。
1.2.2 血清IL-35、IL-4、IFN-γ、IL-17水平的检测 造模成功后,两组小鼠经腹腔注射10%水合氯醛1 mL/kg麻醉后摘除右侧眼球取血,将收集的血液于37℃静置30 min后以3500 r/min离心15 min,分离收集上层血清,-80℃保存。血清中IL-35、IL-4、IFN-γ、IL-17浓度采用生物素双抗体夹心酶联免疫吸附法(ELISA),严格按照试剂盒说明书进行操作,于450 nm处测量吸光度值,使用相关软件绘制标准曲线并计算血清样本中IL-35、IL-4、IFN-γ、IL-17的含量。
1.2.3 组织学形态观察 无菌条件下取两组小鼠背部皮肤组织,约1 cm×0.5 cm,以10%甲醛固定,常规石蜡包埋、切片,观察两组小鼠背部皮肤组织学改变。
1.2.4 RT-PCR检测皮肤组织中IL-12p35 mRNA及EBI3 mRNA水平 无菌条件下取两组小鼠背部皮肤组织,约0.5 cm×0.5 cm,迅速冷冻在液氮中,再放入-80℃保存。之后在液氮条件下研磨组织至粉末状,将粉末倒入去RNA酶的EP管中,加入1 mL TRIZOL,再用TRIZOL法提取小鼠皮肤总RNA。按照试剂盒说明书进行逆转录及RT-PCR扩增。反应体系如下:SYBR Premix Ex Taq II 10.0 μL,上、下游引物各0.4 μL,cDNA模板2.0 μL,ddH2O 6.4 μL。反应条件:以95℃ 30 s预变性,95℃ 5 s变性,55℃ 30 s退火,72℃ 30 s充分延伸,共40个循环。每个样本设三个复孔,取其平均Ct值,以β-actin为内参,通过2-△△Ct计算IL-12p35、EBI3的mRNA相对表达量。
2 结果
2.1 模型组小鼠背部皮损表现及组织病理学改变 对照组小鼠背部皮肤正常(图1a),模型组小鼠背部可见红斑、丘疹、渗出、浆痂、增厚、苔藓样变等改变(图1b)。对照组小鼠背部皮肤组织镜下结构基本正常(图2a),模型组小鼠背部皮肤组织镜下可见角化过度伴角化不全、棘层增厚、海绵水肿、真皮浅层淋巴细胞为主的炎细胞浸润等特应性皮炎样改变(图2b)。
2.2 模型组小鼠及对照组小鼠血清中IL-35、IL-4、IFN-γ、IL-17的表达 模型组小鼠血清中IL-35浓度明显低于对照组[(326.39±27.19)pg/mL vs. (362.78±59.64)pg/mL],差异有统计学意义(P<0.05);模型组小鼠血清中IL-4、IL-17浓度均明显高于对照组[(33.98±3.92)pg/mL vs. (29.93±4.41)pg/mL,(257.50±26.14)pg/mL vs. (179.61±36.43)pg/mL],差异有统计学意义(P<0.05);模型组小鼠血清中IFN-γ浓度较对照组有所降低,但差异无统计学意义[(371.22±39.18)pg/mL vs. (398.98±48.69)pg/mL,P>0.05]。见表1。
2.3 模型组小鼠血清中IL-35浓度与IL-4、IFN-γ、IL-17浓度的相关性 将模型组小鼠血清中IL-35浓度与IL-4、IFN-γ、IL-17浓度进行相关性分析,结果显示IL-35与IL-17呈负相关(r=-0.611,P=0.015);而与IL-4、IFN-γ无明显相关性(r=-0.117, 0.435,P=0.679,0.106)。
2.4 模型组小鼠及对照组小鼠背部皮肤组织中IL-35亚单位(IL-12p35及EBI3)mRNA的表达 IL-12p35mRNA在模型组小鼠背部皮损中的相对表达量(0.57±0.37)明显低于对照组(1),差异有统计学意义(t=-2.461,P=0.021);EBI3 mRNA在模型组小鼠背部皮损中的相对表达量(0.65±0.55)也较对照组(1)降低,差异有统计学意义(t=-2.074,P=0.047);且模型组小鼠背部皮损中IL-12p35 mRNA与EBI3 mRNA表达呈显著正相关(t=0.962,P=0.000)。见图3。
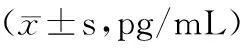
表1 模型组及对照组血清中IL-35、IL-4、IFN-γ、IL-17表达水平的比较
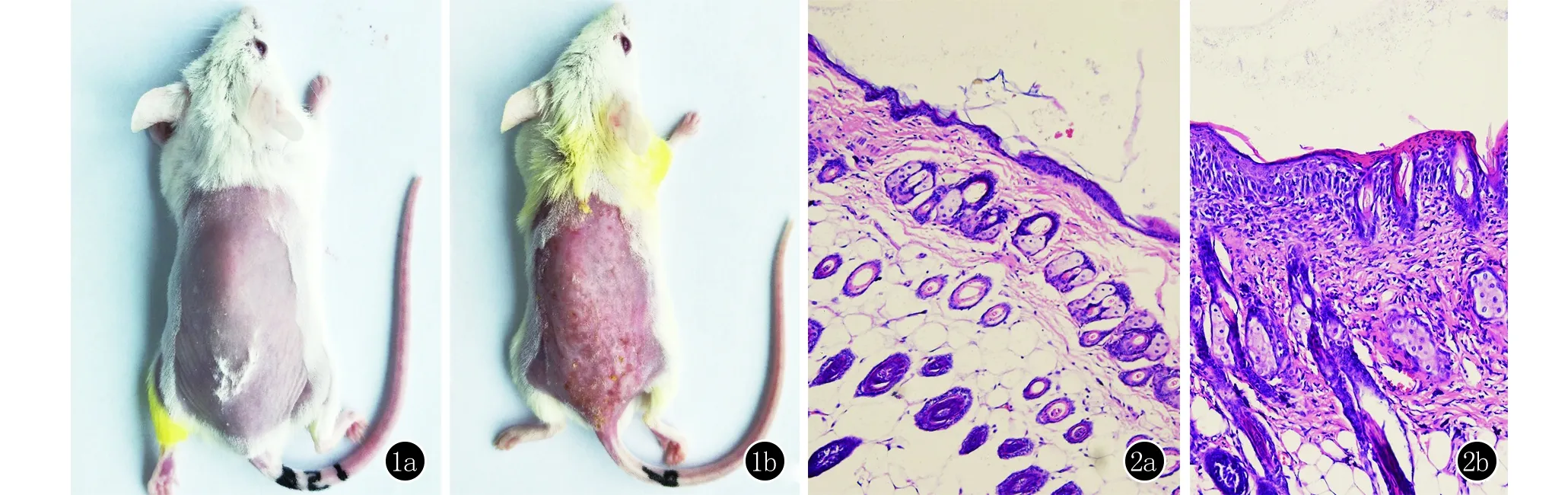
图1 对照组(1a)及模型组(1b)小鼠背部皮肤表现 图2 对照组(2a)及模型组(2b)小鼠背部皮肤组织病理表现(HE,×200)
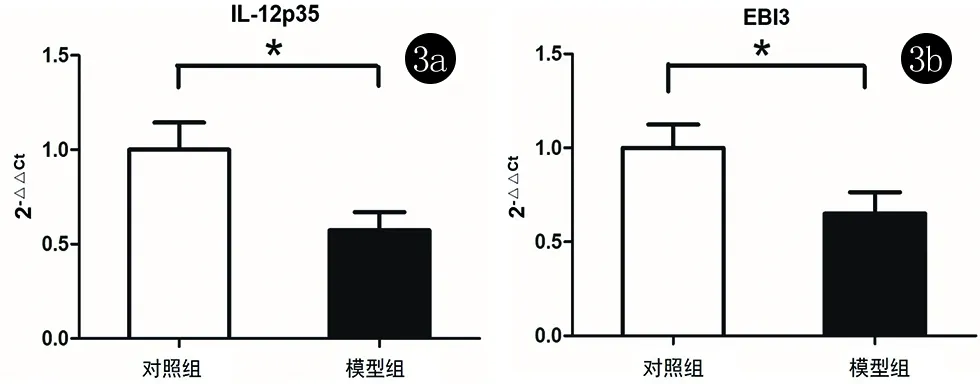
图3 对照组及模型组小鼠背部皮肤IL-12p35(3a)及EBI3 mRNA(3b)相对表达量,*P<0.05
3 讨论
特应性皮炎(AD)是一种慢性、反复性、炎症性皮肤病,瘙痒剧烈,常伴有哮喘和/或过敏性鼻炎,严重影响患者生活质量。AD发病机制复杂,涉及遗传、免疫、环境、感染、生理病理等多种因素。目前已有大量研究证实Th1/Th2细胞网络失衡是AD的发病基础[3,4]。此外,促进炎症反应的Th17细胞和抑制炎症反应的Treg细胞之间的细胞平衡是机体维持免疫稳态的重要因素,其平衡的打破也可能在AD的发病中占有重要地位[5]。
IL-35是近年新发现的一种抑制性细胞因子,于1990年被发现,2007年由Collison等[6]命名。IL-35为IL-12家族的新成员,是由IL-12p35(IL-12A)亚基与EB病毒诱导基因3(EpsteinBarr virus-induced gene 3,EBI3)蛋白组成的异源二聚体,主要由Treg细胞分泌。IL-35是Treg细胞发挥免疫抑制效应必需的,其性质稳定,在体内外能抑制传统T细胞的增殖并诱导幼稚T细胞转换成iTreg,具有强大的免疫抑制作用[7,8]。近年研究发现IL-35在血液系统疾病[9]、心血管疾病[10]、慢性肝炎病毒感染[11]、自身免疫性疾病[12,13]、肿瘤[14]等多种疾病中参与炎症的免疫调节。除此之外,IL-35也被发现在过敏性疾病如过敏性哮喘及过敏性鼻炎的发病中起重要作用,有学者[15]研究表明Treg细胞主要是通过IL-35抑制Th17细胞的分化和IL-17因子释放的方式发挥作用。Li等建立了Balb/c小鼠过敏性气道疾病模型,发现将腺病毒介导的IL-35基因转入小鼠体内能明显减低气道高反应性、增加肺组织中CD4+CD25+Fox3+T细胞的数量并降低支气管肺泡灌洗液中IL-4、IL-5、IL-13及IL-17的水平[16]。此后,在一些过敏性鼻炎或哮喘的动物模型及患者体内进行的试验进一步证实了IL-35对Treg细胞的上调作用和对Th2、Th17细胞的抑制作用[17,18]。鉴于AD这一皮肤科常见的过敏性炎性疾病与过敏性气道疾病的发病机制有相似之处,故我们推测IL-35亦可能在AD发病中起负调控作用。我们采用了DNFB诱导的特应性皮炎样小鼠模型对IL-35在AD发病中的作用做了初步探讨,目前鲜有报道。
本次实验研究发现,在特应性皮炎样小鼠模型血清中IL-4、IL-17水平明显高于对照组,IFN-γ水平较对照组有所降低,这与特应性皮炎急性期Th2细胞占优势及Th17促进其发病的理论相符[19,20];而其血清中IL-35水平较对照组明显下降提示Treg免疫抑制功能的减弱。此外,模型组小鼠血清中IL-35与IL-17呈负相关,这在一定程度上代表了Th17/Treg比例的失衡,与过敏性气道疾病的研究结果类似,进一步证实了Th17/Treg细胞失衡是导致过敏性炎性疾病的重要原因之一。另外,我们的研究还发现特应性皮炎样小鼠模型皮损中IL-12p35 mRNA与EBI3 mRNA表达均较对照组明显降低,提示IL-35可能在抑制皮损形成方面发挥作用。Wang等[21]的研究显示IL-35可能会抑制活化的CD4+CD25-T细胞产生IL-4并逆转Th1/Th2的失衡,而我们此次研究并未发现模型组小鼠血清中IL-35水平与IL-4、IFN-γ水平有相关性。但由于此次研究样本量较小,结果的局限性及偏倚性不可避免,故尚待更大样本及更深入的人体试验进一步进行相关验证。
综上,该研究提示,IL-35可能参与特应性皮炎的发病,尤其在维持Th17/Treg平衡方面可能发挥作用,但其靶蛋白的表达、其对Th1/Th2的影响及发挥作用的具体机制等方面还有待进一步研究。
