胃神经内分泌肿瘤的精准诊治
2018-08-16徐天铭李景南
徐天铭 李景南
中国医学科学院 北京协和医学院 北京协和医院消化内科(100730)
胃神经内分泌肿瘤(gastric neuroendocrine neo-plasms, G-NENs)是一类起源于肠嗜铬样细胞(enterochromaffin-like cell, ECL细胞)的少见肿瘤。近30年来,随着消化内镜的广泛应用、内镜技术的进步以及对疾病认识的不断提高,G-NENs发病率呈逐渐上升趋势。G-NENs的发病率存在地域和人种差异,西方国家G-NENs占胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms, GEP-NENs)的5%~23%,亚洲地区G-NENs占GEP-NENs的4.3%~26.1%[1-2]。G-NENs多为惰性生长,但也可能迅速进展,后者病程与胃腺癌具有一定相似性。G-NENs发病率较低,临床表现呈现高度异质性和复杂性,患者的治疗决策依赖于肿瘤临床分型和多学科综合治疗。
一、G-NENs的分型
2016年欧洲神经内分泌肿瘤学会(ENETS)相关指南将G-NENs分为三型(表1)[3]。1型和2型G-NENs存在胃泌素升高,提示肿瘤发生可能与胃泌素相关。胃泌素可与ECL细胞表面的胆囊收缩素B受体(cholecystokinin B receptor, CCKBR)结合。CCKBR与胃泌素的亲和力是胆囊收缩素的1 000倍,大量胃泌素刺激CCKBR基因表达,促进胃上皮细胞增殖,激活ECL细胞,而ECL细胞异常增生增加肿瘤发生风险。此外,人ATP4a基因编码质子泵,该基因错义突变(p.R703C)导致胃酸分泌减少,继发高胃泌素血症,可能与G-NENs的发生相关[4]。2型G-NENs与多发性内分泌肿瘤综合征1型(multiple endocrine neoplasia type 1, MEN-1)相关。MEN1基因是MEN-1的关键致病基因之一,编码menin蛋白,后者与细胞生长、发育过程中的重要调控蛋白如JunD、Smad3、nm23H1、p53等存在相互作用,若MEN1基因缺失,甲状旁腺、胰岛细胞、垂体等内分泌腺散发肿瘤的发生率将明显增高。约31%的散发胃泌素瘤存在MEN1基因突变[5]。G-NENs,特别是3型G-NENs的病因目前尚不明确,可能与散发基因突变有关,有待进一步研究。
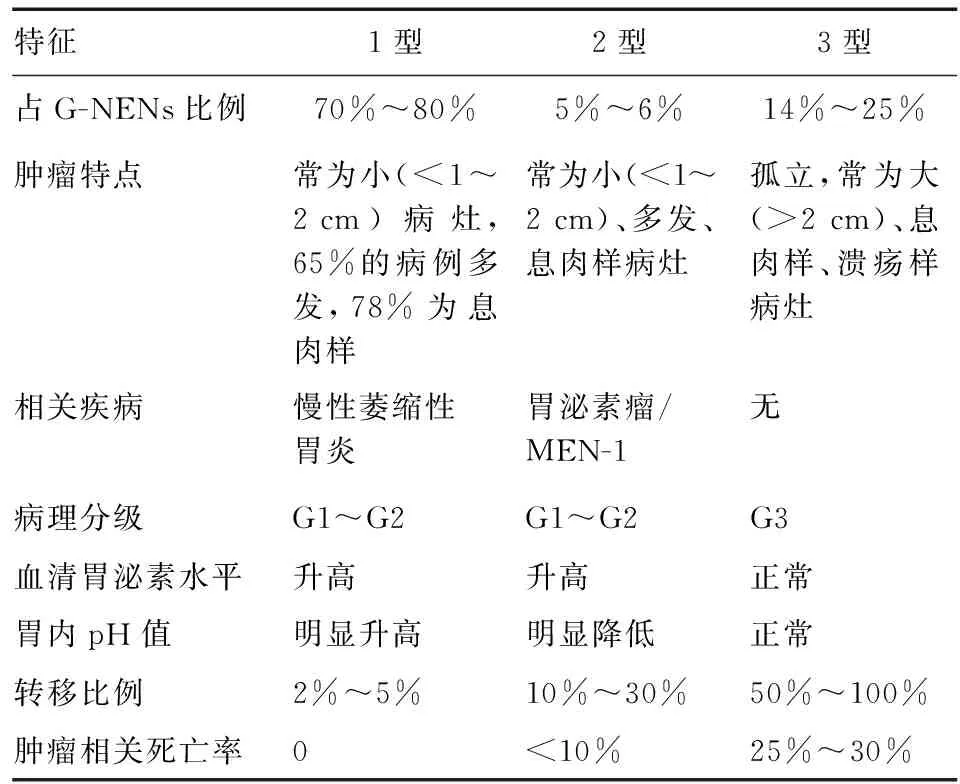
表1 G-NENs分型
《中国胃肠胰神经内分泌肿瘤专家共识(2016年版)》将G-NENs分为四型,即将分化良好的G-NENs分为三型,各型界定同ENETS指南(2016年版),而将分化差的胃神经内分泌癌归为4型[6]。张盼等[7]对241例G-NENs的临床病理特点和预后进行总结分析,发现随访期内3型患者总体生存率为79.3%,4型患者总体生存率为39.2%,两组间差异有统计学意义。因此,我国提出的G-NENs四型分类法具有实际临床意义,可指导预后评估。
二、G-NENs的精准诊断
1. 临床表现:G-NENs的临床表现具有高度异质性,主要包括早饱、纳差、腹痛、腹胀、上腹不适等,部分患者可无明显临床症状。1型G-NENs继发于自身免疫性胃炎,胃壁细胞破坏,胃酸、内因子分泌减少,影响铁、维生素B12吸收,常合并缺铁性贫血或巨幼细胞性贫血。2型G-NENs合并高胃泌素血症,常表现为难治性消化性溃疡、上腹部疼痛、腹泻等。部分2型G-NENs由于合并甲状旁腺、胰岛细胞、垂体肿瘤,可表现为高钙血症、肾结石、反复发作的低血糖、移行性坏死性红斑、闭经、溢乳等症状。垂体肿瘤较大时可出现局部压迫症状,如头痛、视野缺损等。3型G-NENs压迫或侵袭周围组织,可有肠梗阻、消化道出血等症状。发生肝转移者可能合并面色潮红、心动过速、高血压或低血压等类癌综合征表现[8]。
2. 实验室检查:血清嗜铬粒蛋白(chromogranin A, CgA)是神经内分泌肿瘤最重要、最具临床意义的肿瘤标记物,有助于肿瘤诊断、疗效评估和患者随访。CgA诊断神经内分泌肿瘤的敏感性和特异性为60%~90%。但在应用质子泵抑制剂(PPI)、肝硬化、肾功能障碍、心力衰竭、慢性萎缩性胃炎或合并自身免疫性疾病的患者中,血清CgA水平可能假阳性升高。30%~50%的神经内分泌肿瘤患者神经元特异性烯醇化酶(NSE)水平升高,NSE明显升高多提示高病理级别肿瘤[9]。
1型和2型G-NENs均合并高胃泌素血症,如临床怀疑G-NENs,应筛查血清胃泌素和胃内pH值,1型胃内pH值明显升高,2型则明显降低。1型G-NENs还应评估血清铁和维生素B12水平,完善壁细胞抗体、内因子抗体等检查。2型G-NENs与MEN-1相关,应同时完善甲状腺、甲状旁腺、垂体、胰腺等腺体的内分泌功能评估。
3. 消化道内镜检查:1型和2型G-NENs内镜下多表现为息肉样隆起,病变多局限于黏膜层或黏膜下层,可分布于胃腔贲门至幽门的任何部位,以胃体部最为多见。1型G-NENs多伴有慢性萎缩性胃炎。与1型G-NENs相比,2型G-NENs肿瘤浸润肌层、侵袭血管、淋巴结和远处脏器转移风险较高,且多伴有消化性溃疡。3型G-NENs内镜表现多样,包括巨大息肉、多结节样隆起、溃疡性病变等,其生物学行为与胃癌类似,与1型和2型G-NENs相比更易出现淋巴结和血行转移。对于疑为G-NENs的胃部病变,如息肉直径>1~2 cm或表现为巨大溃疡,应行内镜超声检查评估病变浸润深度以及有无周围淋巴结转移[10]。
4. 影像学检查:CT和MRI检查可帮助判断有无淋巴结和远处脏器转移,有助于评估受累部位和肿瘤分期。低病理级别G-NENs主要表现为息肉样或结节样隆起,高病理级别G-NENs可表现为局部胃壁不规则增厚或溃疡,病变向浆膜外生长。G-NENs起源于ECL细胞,主要位于黏膜层和黏膜下层,属于富血供肿瘤,增强扫描时肿瘤强化,但肿瘤增强速率和消退速率不一,结合临床表现和神经内分泌肿瘤标记物检查结果,诊断并不困难。磁共振扩散加权成像(diffusion weighted imaging, DWI)序列是诊断神经内分泌肿瘤的重要序列。研究[11]发现,对GEP-NENs而言,全身DWI的诊断敏感性、特异 性和准确性均优于生长抑素受体闪烁成像(somatostatin receptor scintigraphy, SSRS)(敏感性:72%对60%;特异性:100%对99%;准确性:91%对86%)。G-NENs DWI多呈高信号,动态增强扫描可反映瘤体血供以及瘤体与周围血管的关系。18F-FDG PET/CT、68Ga-DOTATATE PET/CT等功能性显像技术有助于G-NENs的诊断。相关系统综述显示,68Ga-DOTATATE PET/CT诊断神经内分泌肿瘤的敏感性为90.9%(95% CI: 81.4%~96.4%),特异性为90.6%(95% CI: 77.8%~96.1%),准确性高于SSRS[12],提示其对于筛查神经内分泌肿瘤具有极高的潜力。18F-FDG PET/CT主要反映肿瘤细胞增殖和葡萄糖代谢能力,与G-NENs的恶性程度相关。
5. 组织病理学检查:G-NENs临床表现形式多样,仅凭临床症状、内镜特点或影像学表现诊断误诊率较高,确诊依赖于组织病理学检查。G-NENs的病理学诊断需满足以下条件:①具有典型组织病理学形态特点,如肿瘤细胞排列成巢状、小梁状或腺管样,细胞形态均匀一致,胞内含有颗粒,但神经内分泌癌的形态特点与恶性肿瘤类似;②表达神经内分泌肿瘤相关标记物,如突触素、CgA、NSE等。有时为与非上皮性恶性肿瘤鉴别,需加做广谱角蛋白(AE1/AE3)、CK7、CK20以帮助判断肿瘤是否为上皮来源[13]。G-NENs的分级参照2010年WHO 神经内分泌肿瘤分级标准,根据核分裂象数和Ki-67阳性指数评估肿瘤增殖活性(表2)。对于手术切除标本,根据肿瘤大小、浸润程度、切缘情况、淋巴结和远处转移等信息,根据2010年WHO TNM分期系统明确TNM分期。
三、G-NENs的精准治疗
G-NENs是一种实体肿瘤,与其他实体肿瘤一样,手术为其主要根治手段,治疗目的是降低肿瘤负荷、缓解症状、改善预后。G-NENs的治疗应综合考虑肿瘤功能状态、临床分型、病理分级、生长抑素受体(somatostatin receptor, SSR)表达水平、是否可以手术切除以及有无远处转移等因素。G-NENs治疗方案的制订需消化内科、外科、放射科、放疗科、肿瘤科等多学科协作,以避免单一治疗手段的局限性,为患者提供个体化、全面化的治疗方案,从而改善患者预后。 G-NENs的治疗流程见图1。
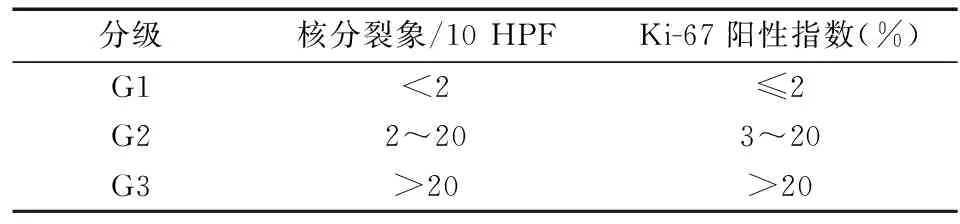
表2 2010 WHO神经内分泌肿瘤分级标准
注:如核分裂象数与Ki-67阳性指数不在同一等级,以两者中等级较高者为准
1. 1型G-NENs:1型G-NENs多局限于黏膜层或黏膜下层,常为胃底、胃体多发、散在的小息肉,淋巴结转移率低于2.5%,远处脏器如肝转移风险小于2.5×10-4。由于1型G-NENs多为惰性生长,低风险病灶可长期随访观察。有研究者推荐以活检钳钳除所有可见病灶,对于>5 mm的病灶行内镜黏膜切除术[14]。由于内镜操作存在出血、穿孔等潜在风险,现尚无随机对照试验证实积极治疗微小病灶具有明确获益,因此目前ENETS指南推荐:对于≥1 cm的肿瘤,可考虑内镜下切除。但1型G-NENs存在累及固有肌层甚至转移风险,建议术前行内镜超声检查评估肿瘤浸润深度,明确是否有胃周淋巴结转移,如肿瘤局限于黏膜层或黏膜下层、无淋巴结转移,可选择内镜黏膜下剥离术、内镜黏膜切除术等方法切除病灶。不论G-NENs是局限性肿瘤还是转移性肿瘤,手术目标均为完整切除肿瘤。1型G-NENs如肿瘤浸润超过黏膜下层、术后切缘阳性、存在远处转移、淋巴结转移,建议行外科根治性手术联合淋巴结清扫[15]。理论上胃窦切除可抑制高胃泌素血症、限制ECL生长,但胃窦切除术存在胃排空障碍、肠梗阻、倾倒综合征、残胃癌等并发症,约30%的患者胃窦切除术后临床症状持续不缓解,可能与其他部位仍有G细胞有关,因此目前对于胃窦切除术尚存争议。
生长抑素类似物(somatostatin analogue, SSA)虽有助于缓解1型G-NENs,但目前在患者中应用有限,主要是由于尚未对其与选择长期随访监测的患者进行预后比较,因此暂不推荐早期患者使用SSA。符合以下条件的1型G-NENs患者,可尝试SSA治疗:①SSR阳性,Ki-67阳性指数较低且存在远处转移灶;②内镜下难以根除的多发小病灶;③切除后多次复发等[16]。常见SSA制剂包括奥曲肽、兰瑞肽、帕瑞肽等。此外,netazepide是高选择性胃泌素/CCK-2受体拮抗剂,能阻断慢性萎缩性胃炎继发的高胃泌素血症对ECL细胞的生长刺激作用,从而抑制1型G-NENs生长。研究[17]显示netazepide能有效降低1型G-NENs患者的肿瘤负荷以及循环中的胃泌素、CgA水平,但停药后存在病情反复。由于缺乏足够高级别的临床证据支持,netazepide的应用需进一步研究验证。
2. 2型G-NENs:2型G-NENs常表现为多发小息肉(<1 cm),病灶通常位于黏膜-黏膜下层。除内镜下切除病灶外,如病灶>2 cm、胃内多发病灶或肿瘤侵及肌层,可考虑外科手术治疗。2型G-NENs手术治疗的目的是去除高胃泌素血症的根源。胃泌素瘤常见于十二指肠和胰腺,胃泌素瘤根治术后高胃泌素血症解除,胃内病灶可能缩小甚至消失。如无法明确胃泌素来源,根据患者意愿、是否耐受手术以及有无手术禁忌证,全胃切除术也是一种治疗选择,但手术可能导致严重远期并发症,不作为常规治疗推荐。2型G-NENs合并高胃泌素血症,除有创治疗外,不能手术切除病灶或无法明确胃泌素来源的患者可使用SSA抑制胃泌素分泌和肿瘤细胞增殖。对于难治性肿瘤、肿瘤耐药等情况,可选择增加SSA给药频率[18]。长期使用PPI或H2受体拮抗剂类药物抑制胃酸分泌,可反馈性引起胃泌素分泌增多,高胃泌素血症导致ECL细胞过度增殖,进而增加G-NENs发生风险[19]。但对于高胃泌素血症导致胃巨大溃疡伴或不伴溃疡出血的患者,可短期应用大剂量PPI,通常为常规剂量的2倍以上,以减轻临床症状[20]。
3. 3型G-NENs:3型G-NENs多为单发病灶,形态可呈息肉样、溃疡样或菜花样,病灶浸润常超过黏膜下层,约70%的患者合并淋巴结或远处转移。对于3型G-NENs,虽然部分小病灶(≤1 cm)可采用内镜下切除术,但鉴于肿瘤自身的病理类型和行为特点,按胃腺癌手术原则行外科治疗(部分或全胃切除术合并淋巴结清扫)仍是首选治疗策略。肝脏是最常见的转移部位,对于仅有肝转移者,如绝大部分转移灶局限于同一肝叶,建议首选手术切除。有研究[21]对85例行原位肝移植的转移性神经内分泌肿瘤患者的疗效进行系统评价,5年总体生存率为52%,不良预后因素包括肿瘤侵犯大血管和既往上腹部大型手术史。由于接受原位肝移植治疗的患者数量较少,疗效存在争议,故尚不作为常规推荐治疗手段。如肝转移灶不可切除,可考虑局部动脉栓塞、射频消融、冷冻消融等治疗手段,有效率约为50%。研究[22]发现G-NENs根治术后5年复发率为37%,肿瘤侵及深层胃壁、存在淋巴结和远处脏器转移、血中性粒细胞/淋巴细胞比值升高、病理学低分化提示G-NENs根治术后复发、转移和死亡风险较高。根据美国国立综合癌症网络(NCCN)发布的指南,神经内分泌肿瘤手术切除后第1~2年应至少每隔6个月进行一次体格检查,包括上消化道内镜、腹部CT或MRI、血清CgA检测等以综合评估疾病有无复发或进展;此后四年建议每年进行一次综合评估,然后随访时间延长至每两年一次直至术后10年[23]。尽管随访方案仍存在一定争议,但对具有病灶大、侵袭浆膜、病理学分级高或脉管浸润等高危因素的患者,建议手术治疗后规律随访。
G-NENs患者如存在肝外转移灶或广泛转移,可考虑系统治疗,包括生物治疗、靶向药物治疗、化疗、肽受体放射性核素治疗(peptide receptor radio-nuclide therapy, PRRT)等。
①生物治疗: 大部分G-NENs表达SSR,主要为SSR2亚型。尽管目前尚无SSA和(或)干扰素-α(IFN-α)抗肿瘤作用的直接证据,但多项研究显示两者能抑制40%~70% G-NENs患者的肿瘤生长。PROMID研究[24]显示,在转移性中肠神经内分泌肿瘤患者中,长效奥曲肽对于肝脏肿瘤负荷较低者可延长总体生存期。IFN-α具有诱导细胞周期阻滞和细胞凋亡的作用,同时参与免疫调控、抑制新生血管生长,但由于其存在流感样症状、血小板减少、粒细胞缺乏等不良反应,不推荐作为G-NENs的一线治疗药物。临床合并类癌综合征的G-NENs患者,如SSA单药治疗效果欠佳,可考虑SSA联合IFN-α治疗,IFN-α推荐剂量为3~9 MU/次,每周3~7次。Telotristat ethyl是一种口服色氨酸羟化酶抑制剂,可抑制体内5-羟色胺合成,美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)已批准其用于治疗难治性类癌综合征的腹泻症状[25]。
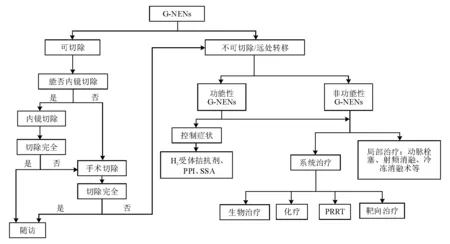
图1 G-NENs治疗流程图
②靶向药物:依维莫司是雷帕霉素类似物,可抑制哺乳动物雷帕霉素靶蛋白复合物(mTORC)中的mTORC1。RADIANT-4研究[26]纳入分化良好(G1-G2)的进展期无功能肺或胃肠道神经内分泌肿瘤患者,与安慰剂相比,依维莫司能明显延长无进展生存期(中位无进展生存期:11.0个月对3.9个月);依维莫司治疗无功能非胰腺神经内分泌肿瘤的客观缓解率为2%,疾病控制率为82.4%,主要作用为延缓疾病进展,在诱导肿瘤缓解方面效果不明显。舒尼替尼是一种酪氨酸激酶抑制剂,作用于血管内皮生长因子受体、c-KIT、血小板衍生生长因子受体-α等多个位点,可减少肿瘤新生血管形成,诱导肿瘤坏死。舒尼替尼在治疗进展期胰腺神经内分泌肿瘤方面取得良好效果,但尚无高级别临床证据证实其对G-NENs有效,故目前尚不常规推荐舒尼替尼用于治疗G-NENs。贝伐珠单抗可选择性与血管内皮生长因子结合并阻断其生物活性,未来是否可用于G-NENs的治疗有待进一步研究明确。
③化疗:G-NENs发病率较低,因此尚无高效化疗方案的大规模病例研究报道,进展期神经内分泌癌的药物治疗仍是铂类联合依托泊苷或联合伊立替康方案。多项研究显示,5-氟尿嘧啶、链脲霉素或阿霉素单药治疗转移性类癌客观有效率低于10%。G-NENs化疗的主要目的是维持疾病稳定、延缓疾病进展、延长无进展生存期,实现肿瘤分期降级或诱导肿瘤缓解的效果不理想。
④PRRT:如SSRS提示病灶存在放射性摄取,PRRT可作为一种治疗选择。多项欧洲Ⅱ期临床试验证实PRRT在GEP-NENs中的总有效率为20%~40%,中位疾病进展期长达40个月。Ⅲ期随机对照NETTER-1临床试验结果显示,在分化良好的SSR阳性转移性中肠神经内分泌肿瘤患者中, PRRT联合长效奥曲肽与单用大剂量长效奥曲肽相比能明显改善患者20个月时的无进展生存率(65.2%对10.8%)[27]。由于缺乏充分前瞻性研究结果,且PRRT可能导致骨髓抑制等严重并发症,目前该疗法多用于SSA治疗或化疗失败者。
四、结语
G-NENs是一类高度异质性的肿瘤,不同亚型G-NENs的生物学行为和治疗方案存在一定差异,其诊断需结合临床表现以及实验室、内镜、影像学、病理学检查等多种手段,治疗方式包括内镜下切除、手术、生物治疗、靶向药物、化疗、PRRT等。制订治疗方案时需综合考虑肿瘤临床分型、数目、大小、累及部位、有无远处转移等因素,全面评估,综合衡量,实施个体化、精准化治疗。
