双特异性单链抗体BiTE的研究进展
2018-08-15韩邦兴刘黎琼施海峰
周 冲, 于 峰, 韩邦兴, 周 阳, 刘黎琼, 施海峰
(1. 江苏大学 生命科学研究院, 镇江 212013; 2. 皖西学院 生物与制药工程学院 中药研究与开发工程技术研究中心, 六安 237012; 3. 深圳市南山区人民医院血液科, 深圳 518052)
癌症是严重威胁人类健康及社会发展的重大疾病。据中国2013年癌症统计数据显示,中国新发病例368万,占世界癌症新发病例的四分之一,且发病率总体呈增长趋势[1]。现有常规治疗方案存在的非特异性、副作用大等问题推动了特异靶向治疗癌症的新型战略发展。近年来,以BiTE为代表的一类具有显著抗肿瘤效应的双特异抗体技术迅速发展。
BiTE又称双特异性T细胞接合器(bispecific T cell engager),属于双特性单链抗体,可同时识别T细胞与表达特定的肿瘤表面抗原的靶细胞,帮助T细胞重定向到肿瘤病灶区[2]。人体自身大量存在的T细胞被激活可大量扩增,产生强大而持久的细胞毒性反应,且具有免疫记忆的潜力,因此BiTE利用T细胞治疗癌症的显著优势可产生较好的治疗效果[3]。
1 BiTE的结构
BiTE本质上是一个多肽链,结构上由短的融合柔性接头与两个具有抗原特异性的单链可变片段(single chain variable fragment,scFv)组成(图1),大小约为55~60 ku,长度约为11 nm[4-6]。其中两个scFv分别来自两个单克隆抗体,一个靶向识别选定的肿瘤相关抗原(tumor associated antigen,TAA),另一个靶向识别T细胞表面的CD3ε,其中CD3ε是T细胞受体中CD3复合物亚基,是T细胞信号传导的稳定组成部分。小的无免疫原性的融合接头连接一个重链与轻链组成scFv,同时串联两个scFv并允许它们能够自由旋转,一般由3个或更多个SGGGG柔性重复结构组成(S代表丝氨酸,G代表甘氨酸),甘氨酸分子量小、侧链短可增加侧链的柔韧性,丝氨酸较强的亲水性可增加肽链的亲水性[7-8]。优化重复结构的数目不仅帮助单链可变片段中的轻链与重链以正确构象缔合,并可通过影响两个scFv之间的距离以促进T细胞和靶细胞在免疫突触中的最佳交互作用[9]。
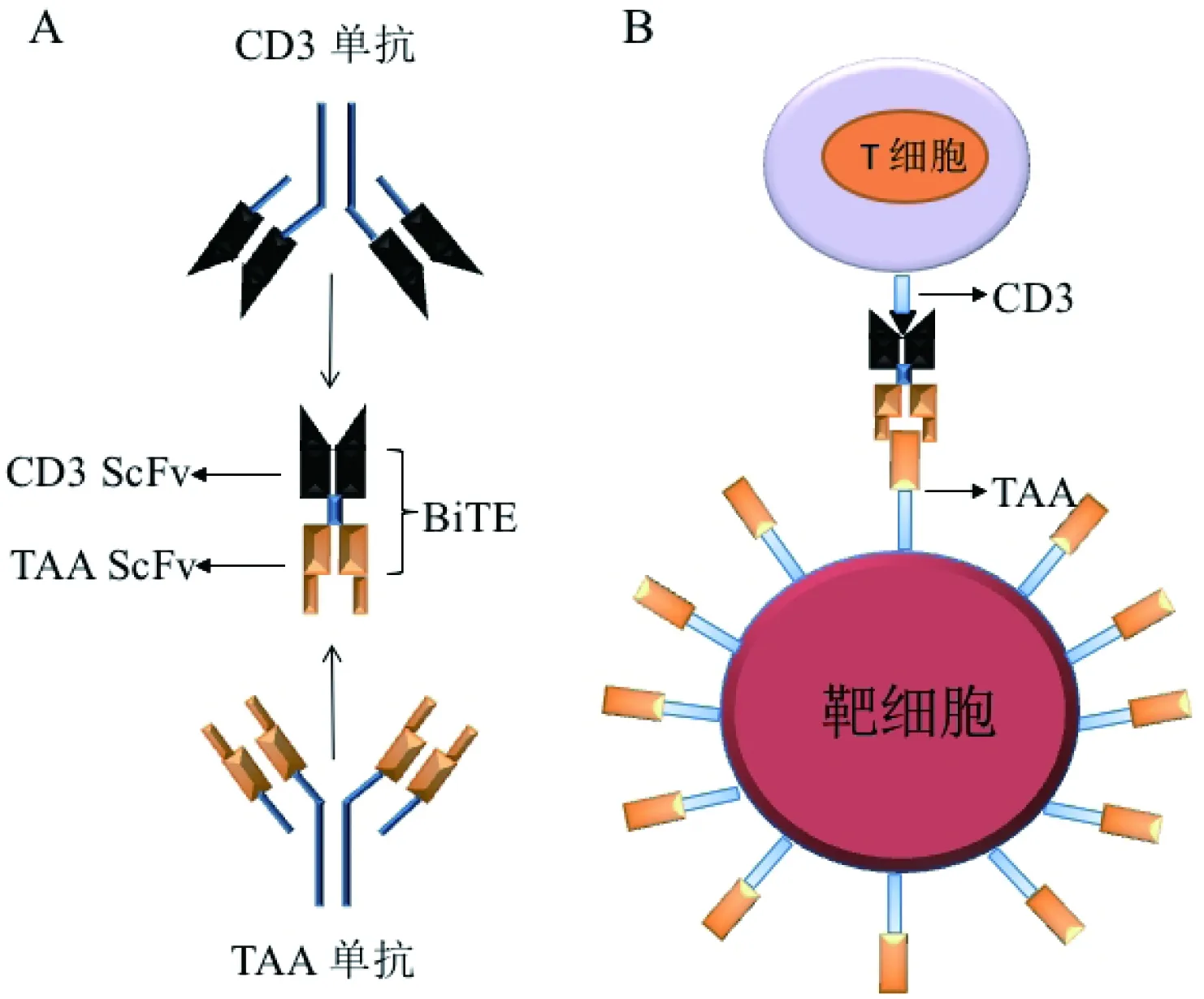
图1 BiTE的结构与功能示意图
A:BiTE结构示意图,BiTE(bispecific T cell engager)由抗T细胞CD3接头肽与抗TAA的两个特异性单链可变片段(single chain variable fragment,scFv)串联组成;B:BiTE在肿瘤细胞和T细胞之间“桥梁“作用示意图,BiTE特异性识别与桥接T细胞与靶细胞,形成T细胞-BiTE-靶细胞复合物
2 BiTE的作用机制
BiTE与其他抗体介导的免疫疗法相似,选择的靶标抗原主要是肿瘤细胞膜上高表达但在正常组织上较低表达的蛋白[10]。该策略最大限度地减少了非预期的靶向肿瘤外反应的可能性,同时优化了对肿瘤的特异靶向性。目前BiTE的完整作用机制尚未完全清楚,但可以确定的是BiTE的两个抗原识别结构域桥接T细胞与肿瘤细胞,形成T细胞-BiTE-肿瘤细胞复合物,诱导细胞毒性免疫突触形成,促进T细胞活化和细胞毒性分子、细胞因子的产生,进而使T细胞免疫激活并裂解靶细胞(图2)[11]。
BiTE的作用机制以抗原依赖性为基础,且具有双重结合依赖性,即BiTE必须同时结合T细胞与表达相关抗原的肿瘤细胞,才能产生T细胞介导的细胞毒性,在BiTE单臂结合T细胞而无靶细胞存在或靶细胞不表达选定靶向抗原的情况下,这种作用机制不发生。研究表明,当BiTE同时结合T细胞和肿瘤细胞时,可诱导T细胞的活化标志物CD69与CD25以及细胞因子的表达上调,包括IFN-γ、TNF-α、IL-2、IL-4、IL-6和IL-10等,T细胞被激活而迅速增殖,效应细胞总数增加,杀伤效率进一步增强[12-13]。而BiTE单侧结合CD3并不能激活T细胞或者产生这种诱导能力。这种抗原依赖式的效应机制规避了预期外的T细胞活化与非特异性毒性产生,预示BiTE靶向抗原的严格特异性优点。
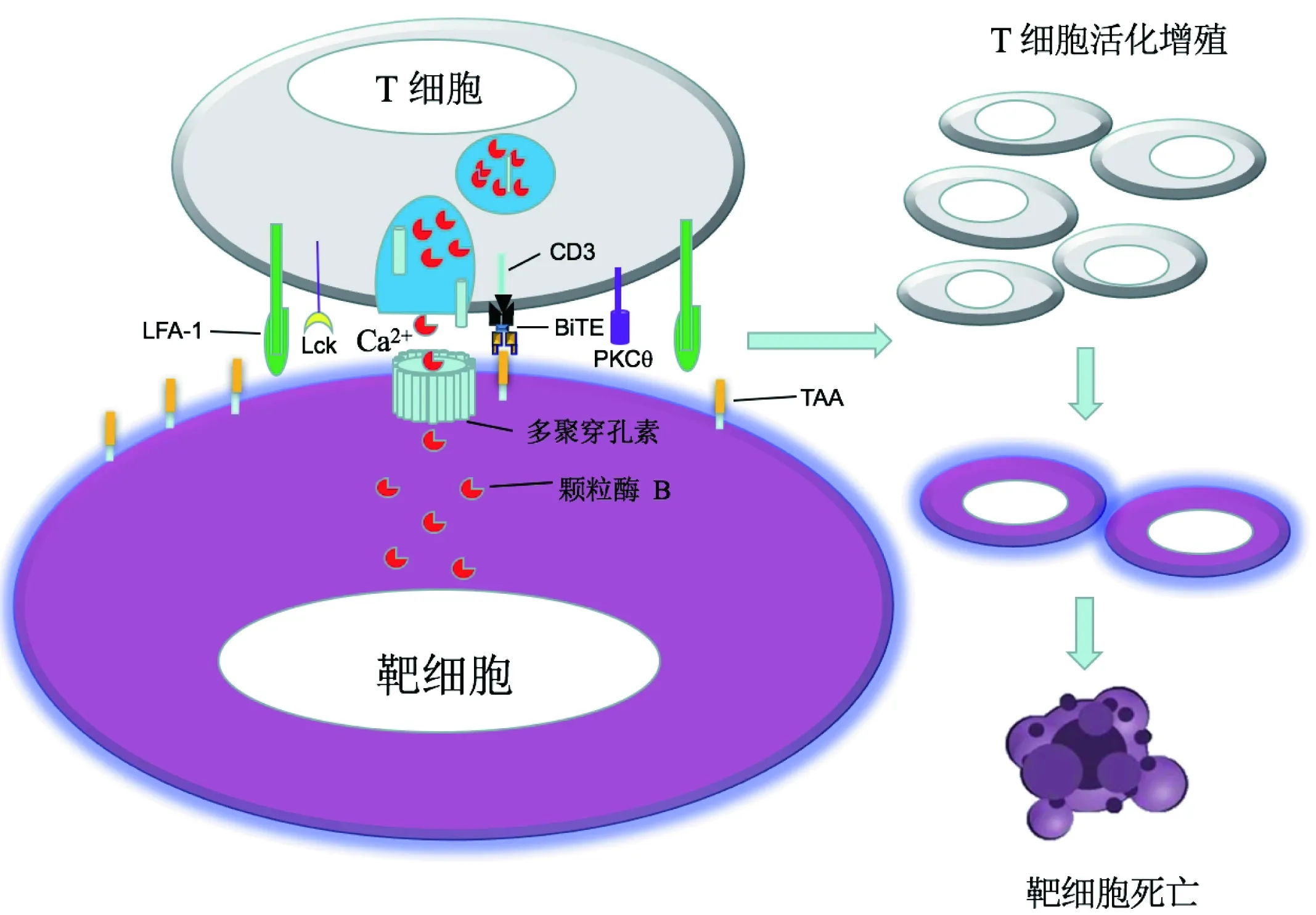
图2 BiTE作用机制示意图
BiTE通过两个scFv在肿瘤细胞和T细胞之间形成免疫突触复合体;免疫突触包括由PKCθ(protein kinase C θ,蛋白激酶θ)、Lck(lymphocyte-specific protein tyrosine kinase, 淋巴细胞特异性蛋白酪氨酸激酶)等组成的中心超分子活化簇以及由黏附分子LFA1(lymphocyte function-associated antigen-1,淋巴细胞功能相关抗原-1激酶)等组成的外周超分子激活簇;T细胞活化、增殖,通过胞吐颗粒作用于靶细胞;在Ca2+存在情况下,穿孔素在靶细胞膜上形成跨膜通道,介导T细胞释放的颗粒酶B进入靶细胞,诱导靶细胞发生死亡级联反应,靶细胞裂解
BiTE诱导的细胞毒性免疫突触的结构在组成、尺寸、亚结构与溶解突触的空间排列上与经典的细胞毒性T细胞识别诱导的突触基本相同[14]。免疫突触由含有重要信号分子的“中心超分子活化簇”(cSMAC)组成,而cSMAC被称作“外周超分子激活簇”(pSMAC)的细胞黏附分子作用域所包围。在BiTE诱导下,CD8+T细胞和表达选定TAA的靶细胞之间形成cSMAC与pSMAC,包括穿孔素(perforin)、PKC θ(protein kinase C θ)、Lck(lymphocyte-specific protein tyrosine kinase)、CD3的中心定位以及LFA1(lymphocyte function-associated antigen-1)的外周定位[15]。这种免疫突触的形成主要与BiTE介导的T细胞脱粒有关,其形成频率受TAA表达水平和BiTE浓度影响。这种免疫突触不依赖于靶细胞上的MHC I类分子,例如靶向EpCAM的BiTE对于高表达EpCAM但MHC I分子缺失的K562肿瘤细胞亦可介导形成免疫突触并发生细胞毒性作用。
BiTE主要结合CD8+细胞毒性T细胞、记忆CD4+辅助T细胞和TREG细胞,天然T细胞需经过CD3/CD28处理才能产生细胞毒性[16]。BiTE结合的细胞毒性T细胞可通过胞吐释放颗粒作用于靶细胞,包括穿孔素与颗粒酶B(granzyme B)。穿孔素以单体形式被分泌至免疫突触中,通过钙依赖的C2结构域快速结合靶细胞膜,在钙离子存在下,多个穿孔素单体(约24个)聚集在靶细胞膜上并形成直径约18 nm的跨膜孔道,靶细胞膜发生去极化,同时颗粒酶B被转运至靶细胞内,并激活胞内凋亡级联反应(如胱天蛋白酶3/7),切割靶细胞内多种死亡底物,包括DNA断裂因子(DFF)、多聚ADP核糖聚合酶(PARP)、核纤层蛋白等,最终致使肿瘤细胞死亡[17-19]。使用钙螯合剂EGTA可保护表达抗原的靶细胞免受BiTE介导的细胞毒性证明了穿孔素机制的参与。另外尚未有研究表明FasL-Fas受体系统参与BiTE介导下的杀伤作用,尽管其在正常细胞的凋亡中发挥重要作用。
此外,BiTE赋予结合的T细胞抗原特异性,这个过程不依赖于T细胞本身的抗原特异性以及共刺激信号,这样可克服肿瘤免疫逃避机制中MHC I类分子和共刺激分子的丧失或下调、以及肽抗原加工和表面递送的缺陷[20]。目前BiTE不需要共刺激即可诱导T细胞毒性产生的原因尚未清楚,有研究者认为较少刺激即可活化的记忆T细胞是主要效应细胞。印证这点的是BiTE抗体 Blinatumomab可诱导CD8+/CD45RO+记忆T细胞产生细胞毒性,但是对CD8+/CD45RA+无作用[21]。
3 BiTE的临床应用
目前多种靶向不同的肿瘤抗原BiTE抗体已经被报道有较高的抗肿瘤活性,包括CD19、EpCAM、HER2、EGFR、CEA、CD33、EphA2和MCSP(或HMW-MAA)等[22-25]。由于BiTE抗体分子量小于一般抗体类药物,所以BiTE抗体具有较好的组织渗透性,在各种异种移植瘤模型中显示较高的抗肿瘤活性,且已在临床上运用(表1)。

表1 BiTE的临床运用
3.1 Blinatumomab
Blinatumomab(MT103)是靶向CD19/CD3的BiTE,对B细胞衍生的急性淋巴白血病(ALL)和非霍奇金淋巴瘤(NHL)显示出一定疗效与安全性[26]。Blinatumomab在2014年12月获得FDA批准,成为第一个被批准用于治疗ALL与NHL的BiTE。有研究表明抗CD19/CD3双特异抗体的BiTE优于其他基于T细胞介导裂解肿瘤细胞的抗体结构形式,如双抗体(diabody),可能是BiTE的两个scFv之间的相对位置与距离促进了T细胞和肿瘤细胞的紧密接触[27]。
3.2 MT-110
MT-110是靶向EpCAM/CD3的BiTE,用于上皮起源的实体瘤,包括乳腺癌、结肠癌、胰腺癌和卵巢肿瘤。临床前数据显示在NOD/SCID异种移植结肠癌SW480细胞的小鼠模型中表现出抑瘤活性[28]。体外数据表明MT110可抑制原发性胰腺癌细胞的生长。目前正在进行临床I期研究阶段,以评估MT110在实体瘤患者中的安全性和耐受性问题。
3.3 MT-111
MT111靶向癌胚抗原CEA,是第三个进入临床实验的BiTE[29]。CEA是一种免疫球蛋白超家族糖蛋白,其表达在多种实体瘤上以及成年人的胃肠道、汗腺和前列腺上皮等多部位。临床前数据显示注射MT111与人T细胞能够显著抑制SCID小鼠模型中异种移植的结肠癌。目前MT111进入针对胃肠道腺癌的I期临床试验。
4 BiTE的创新性运用
BiTE的分子量相对较小,因此具有较强的组织渗透力,可提高肿瘤细胞的外显率,但缺乏Fc段,易在体内被快速消除,血液半衰期较短[30]。临床上检测BiTE在人体内半衰期约为1.25 h,因此需要推注泵或者一天内多次输注以维持血药浓度[31]。为了解决这一问题,有研究者创新性地将BiTE与其他肿瘤治疗策略组合运用。
4.1 痘病毒载体
使用基因重组技术,构建表达分泌型BiTE的溶瘤痘病毒(VV),可使痘病毒溶瘤的同时,通过分泌的BiTE募集体内T细胞到肿瘤部位并进行其介导肿瘤细胞杀伤。例如Yu等构建了分泌靶向EphA2/CD3抗原的BiTE的痘病毒,发现分泌表达的BiTE增强了痘病毒杀伤活性[32]。这种使用痘病毒作为载体并表达BiTE的重组痘病毒构建方式,结合溶瘤剂和BiTE作用的策略,可以延长BiTE在体内的存活时间,促进溶瘤剂的功效,具有广阔的发展前景。
4.2 Engager T 细胞
Engager T细胞是一种新兴的基因工程化T细胞。通过慢病毒或者逆转录病毒等手段,将表达BiTE的模块转入T细胞中,使其分泌表达BiTE。已报道的Engager T 细胞靶点包括CD19、EphA2等。例如Bonifant等构建了可以分泌靶向CD123 BiTE的CD123-ENG T细胞,临床前数据表明其以抗原依赖性方式识别原发性急性骨髓性白血病(AML)细胞,并可帮助旁观者T细胞重定向至AML细胞,在AML的异种移植小鼠模型中显示了抑制肿瘤的效力[33]。
Engager T细胞结合了BiTE和基因工程化T细胞的优势,既能通过分泌的BiTE,使体内常驻T细胞重定向表达相关抗原的肿瘤细胞,又能通过被靶抗原激活从而释放免疫刺激因子且促进自我扩增,从而扩大免疫应答的效应细胞数量[34]。因此,利用Engager T细胞靶向肿瘤,是一种具有优势的免疫治疗策略。
5 展望
皮摩尔浓度的BiTE能募集T细胞,并诱导T细胞在靶抗原存在下分泌细胞因子,以极高的效力杀伤肿瘤细胞,其双重结合的特异性以及强大抗肿瘤活性说明BiTE是一类具有广阔发展前景的新型靶向治疗策略。此外BiTE已被证明可以重新激活免疫抑制微环境中的T细胞,还可以转变TREG细胞由免疫抑制作用到靶向肿瘤的毒性作用[35]。BiTE自1995年第一次出现,到2014年正式被FDA批准进入临床以来,持续发展,但BiTE还需根据临床数据与现有存在问题进行改进以提高治疗选定疾病的微环境中效力,克服包括短的血清半衰期、肿瘤靶抗原丢失的潜在可能性、免疫抑制受体的抑制作用(如PD1、CTL-4),以及现有临床观察到的毒性或副作用等问题[36]。总体来说,BiTE所代表的新型高效率与靶向性的免疫疗法,未来将在免疫治疗策略中占据举足轻重的地位。
