黄粉虫胚胎细胞原代培养研究
2018-08-15路婉茹徐红伟乔自林令世鑫臧荣鑫比那儿居玛开勒德
路婉茹, 徐红伟, 乔自林, 令世鑫, 臧荣鑫, 比那儿·居玛开勒德
(1.西北民族大学 生命科学与工程学院, 兰州 730030;2.西北民族大学实验中心, 兰州 730030; 3.甘肃省动物细胞工程技术研究中心, 兰州 730030)
近年来,昆虫细胞培养技术已被广泛应用于昆虫生理学、昆虫病理学、昆虫毒理学、分子遗传学、发育学、内分泌学等领域。自1962年Grace建立桉蚕蛾(Anteraeaeucalypti)卵巢细胞系以来,特别是Smith等创建了昆虫杆状病毒表达系统(Baculovius Expression Vector System,BEVS)之后,使得昆虫细胞培养技术的应用得到了极大扩展[1-3]。目前,在全世界建立的所有昆虫细胞系中,大部分来源于鳞翅目和双翅目,来源于鞘翅目昆虫的细胞系仅占3% 左右[4],而鞘翅目昆虫应用广泛,与人类生活生产息息相关,多用于中药、食品、营养物质及化学物质的提取等方面,有着重要的经济价值和药用价值[5-8],若建立更多来自鞘翅目的昆虫细胞系,这将极大地推进对鞘翅目昆虫相关生物学的研究及应用。
黄粉虫(Tenebriomolitor),又叫面包虫,属鞘翅目,拟步行虫科,粉虫甲属。黄粉虫是一类仓储害虫,其体内蛋白质含量丰富,可以作为许多动物的活饵料,还可作为人类的食品和保健品[9]。目前,有关黄粉虫细胞的体外培养仅限于脂肪体细胞[10],其他组织细胞的培养并未见报道。本研究以黄粉虫虫卵组织为原材料,开展了黄粉虫胚胎组织原代细胞培养方法、培养基、血清浓度以及胚胎发育时间的选择研究,初步建立适合黄粉虫胚胎组织原代细胞的培养方法。
1 材料与方法
1.1 材料及主要试剂
供试黄粉虫成虫购于兰州茂祥蔬菜保鲜有限公司。
Schneider′s昆虫培养基购于SIGMA公司;Grace培养基和IPL-41培养基均购于GIBCO公司;澳洲胎牛血清(优级)和优级胎牛血清均购自兰州民海生物工程有限公司;青链霉素、0.25% 胰蛋白酶-EDTA和台盼蓝染液均购自北京索来宝生物科技有限公司;两性霉素购自生工生物工程(上海)股份有限公司;CCK-8 试剂盒购自同仁化学研究所。
1.2 黄粉虫虫卵的收集
将黄粉虫成虫置于底部铺满饲料的7~12目筛网上,25℃~28℃条件下,避光产卵;次日同一时间段,从饲料中用16~20目筛筛取虫卵,然后剔除虫卵中杂质;在25℃~28℃条件下,孵化3~7 d,备用。
1.3 黄粉虫胚胎组织原代细胞培养方法
1.3.1 胚胎组织的处理
参照Meng等[11]方法,取孵化7 d,颗粒饱满虫卵1000粒,无菌条件下,将虫卵裹于双层无菌纱布,先浸于10% 的NaClO溶液中消毒5~8 min,然后浸于75% 的酒精消毒5~6 min,接着用含至终浓度为200 U/mL青链霉素和2.5 μg/mL两性霉素B的无菌水冲洗1~3次,最后再用培养基漂洗 1~2次。
1.3.2 机械分散法
将上述处理好的虫卵转移至孔径100 μm的细胞筛,并将细胞筛置于培养皿(60 mm)中,加入8~10 mL细胞培养液,用灭菌的橡胶头充分研磨卵粒,然后吸取2.5 mL细胞滤液移入装有2.5 mL细胞培养液的T-25 cm2培养瓶,分别用Grace、IPL-41和Schneider′s昆虫培养基进行培养,且该3种培养液中均添加青链霉素100 U/mL和20% 胎牛血清,细胞培养瓶置于28℃普通培养箱中静置培养,每隔7~14 d更换60%~80% 的细胞培养液。
1.3.3 胰酶消化法
将虫卵捣碎后用双层无菌纱布过滤,加入0.25% 胰蛋白酶-EDTA溶液,在室温条件下消化5~10 min,然后加入细胞培养液终止消化。以1000 r/min离心10 min,弃上清,将细胞沉淀重悬于细胞培养液中,移入含5 mL培养液的细胞瓶,分别用Grace、IPL-41和Schneider′s昆虫培养基进行培养,且该3种培养液中均添加青链霉素100 U/mL和20% 胎牛血清,细胞培养瓶置于28℃普通培养箱中静置培养,每隔7~14 d更换60%~80% 的细胞培养液。
1.4 Grace培养基血清浓度筛选
按照机械分散法培养黄粉虫胚胎原代细胞,参照李慧等[12]的方法,实验组每孔添加5%、10%、15%和20% 4种不同浓度梯度灭活的胎牛血清的Grace培养液进行培养,以只添加Grace培养基的孔为空白组,Grace培养基加细胞为对照组,培养于4块96孔板内,每组3个重复,细胞密度均为2×104个/mL,100 μL/孔,培养周期为28 d。每隔7 d取出1板细胞,然后向每孔加入10 μL CCK-8溶液,并置于28℃培养箱内培养2.5 h,用酶标仪测定在450 nm处的吸光度值。以空白组调零,对照组细胞活力设定为100%,各实验组的细胞活力的大小是通过其各组的吸光度值与对照组相比较计算得到。通过对比同一时间段不同浓度FBS培养的细胞活力大小,从而筛选出适于黄粉虫胚胎细胞原代培养的FBS浓度。
1.5 黄粉虫虫卵发育时间的选择
选取孵化24、36、48、60、72、96、120、144和168 h的虫卵各1000粒,按照机械分散法分别培养以上不同时间段内的黄粉虫胚胎组织原代细胞,通过观察细胞生长状态及其培养时间以及传代情况,筛选出更适合用于黄粉虫胚胎原代细胞培养的原材料。
1.6 数据统计与方法
实验数据采用SPSS17.0统计软件对其进行统计分析,各组间的方差分析采用One-way ANOVA 方法,多重比较采用LSD法。
2 结果与分析
2.1 机械分散法及不同培养基培养的原代胚胎组织细胞的生长状态
1)使用Grace培养基培养黄粉虫胚胎细胞24 h后,少量细胞团组织贴壁,并从周围迁移出细胞,极少部分单细胞贴壁,呈梭状。72 h后,大部分组织团块贴壁,周围迁移出的细胞明显增多,细胞内分布少量颗粒及空泡(图1-A)。15 d后,细胞贴满整个瓶底(图1-B),进行第一次传代。采用胰酶消化法消化黄粉虫胚胎原代细胞,消化约5 min,按体积比1∶1传代。目前已传至第5代。
2)使用IPL-41培养基培养黄粉虫胚胎细胞24 h后,极少量组织块贴壁,从周围迁移出的细胞亦少,部分单细胞贴壁,多呈梭状。72 h后,部分组织团块贴壁,周围迁移出的细胞增多,细胞内有颗粒,出现空泡。10 d后,大部分细胞贴壁。15 d后,从组织块中迁移出的贴壁细胞开始变圆(图1-C),约2 d后,细胞开始脱落,悬浮于细胞液中,贴壁细胞逐渐减少,轻轻摇晃细胞瓶,贴壁的细胞组织脱落。
3)使用Schneider′s培养基培养黄粉虫胚胎原代细胞,24 h后,少量组织团块贴壁,从周围迁移出细胞,少量单细胞贴壁,呈梭状。72 h后,大部分组织块贴壁,周围迁移出大量细胞,边缘轮廓清晰(图1-D)。15 d后,细胞贴满瓶底(图1-E),进行第一次传代。采用胰酶消化法消化黄粉虫胚胎原代细胞,消化约5 min,按体积比1∶1传代。传代24 h后,少量细胞块贴壁,约72 h后,贴壁细胞变圆开始脱落(图1-F)。
2.2 胰酶消化法及不同培养基培养的原代胚胎组织细胞的生长状态
采用胰酶消化法消化黄粉虫胚胎组织,其细胞团块在Grace、IPL-41和Schneider′s 3种培养基中生长状态相似,24 h后,均呈胰岛样细胞团贴壁生长[13]。用Grace培养基培养的胚胎细胞,72 h后,贴壁生长的细胞团增多,但在其周围并未迁移出细胞,10 d后,大量细胞团贴壁,周围迁移出少量细胞(图2-A),约17 d后,细胞团部分脱落。用IPL-41培养基培养的胚胎细胞,72 h后,部分细胞团贴壁,5 d后,大量细胞团贴壁,但周围没有迁移出贴壁细胞,7 d后,细胞团周围迁移出梭状细胞,部分单细胞贴壁,呈梭状(图2-B),20 d后,细胞团开始脱落。用Schneider′s培养基培养的胚胎细胞,72 h后,少量细胞团贴壁,10 d后,少量细胞团脱落,约15 d后,仅有少量细胞团贴壁(图2-C)。

图1 用机械分散法及不同培养基培养的黄粉虫胚胎原代细胞生长形态
A:Grace′s培养基培养72 h; B: Grace′s培养基培养15 d; C:IPL-41培养基培养15 d; D: Schneider′s培养基培养72 h; E: Schneider′s培养基培养15 d ; F: 第一次传代后,Schneider′s培养基培养72 h。标尺 Scale bars=100 μm

图2 用胰酶消化法及不同培养基培养的黄粉虫胚胎原代细胞生长形态Fig 2 Cellular morphology of Tenebrio molitor embryonic cells by trypsin digestion in different media
A:Grace′s培养基培养10 d; B:IPL-41培养基培养7 d; C: Schneider′s培养基培养15 d。 标尺 Scale bars = 100 μm
2.3 胎牛血清浓度对黄粉虫胚胎原代细胞存活的影响
由图3可知,Grace培养基20% FBS组黄粉虫胚胎原代细胞在培养7、14、21和28 d时细胞活力和15%组、10%组、5%组及无血清组相比,均差异极显著(P<0.01),15% 组与无血清组差异显著(P<0.05),10% 组与5% 组差异不显著(P>0.05),28 d时10% 组和5 % 组与无血清组差异均显著(P<0.05)。综上说明没有血清则不利于黄粉虫胚胎原代细胞生长,添加20% FBS生长较好。
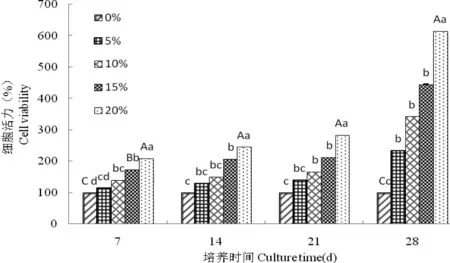
图3 不同胎牛血清浓度对黄粉虫胚胎细胞活力影响Fig 3 Effects of different concentrations of fetal bovine serum on the cell viability of Tenebrio molitor embryonic cells
图中数据为平均数±标准差; 柱上不同字母表示不同处理浓度间的差异显著性(P<0.05, LSD 法)
2.4 黄粉虫虫卵的选择
按照机械分散法分别接种孵化24、36、48、60、72、96、120、144和168 h黄粉虫虫卵胚胎组织细胞,24 h后,在倒置显微镜下观察发现孵化24、36和48 h的虫卵所培养的胚胎原代细胞并不生长,细胞呈圆形且规格不一,散落在细胞瓶底,轻轻摇晃,细胞由原来的聚集状态转至分散。1个月后,细胞裂解,细胞液浑浊。孵化60 h和72 h(孵化3 d)的虫卵接种的胚胎原代细胞,在72 h后细胞团块开始贴壁,并从周围迁移出贴壁细胞。15 d后,大量组织块贴壁,40 d后,细胞长满瓶底,进行第一次传代,目前已传至第2代。孵化96 h(孵化4 d)的虫卵接种的胚胎原代细胞,48 h后,组织块少量贴壁,14 d后,细胞大量增殖,35 d后进行第一次传代,目前传至第3代。孵化120 h和孵化144 h的虫卵接种的胚胎原代细胞,与孵化96 h的卵相似,但并未传代成功。孵化168 h(孵化7 d)的虫卵接种的胚胎原代细胞目前已传至第5代。
2.5 黄粉虫胚胎原代细胞形态观察
黄粉虫孵化3~7 d虫卵接种的胚胎原代细胞形态大致相同,以孵化7 d虫卵接种的胚胎细胞形态予以说明。黄粉虫胚胎组织在培养24 h后,组织团块开始贴壁,并在其周围迁移出细胞,大部分为梭形,有的则呈现不规则形,游离单细胞贴壁呈梭形。7 d后,大量细胞团块贴壁,周围迁移出的细胞生长迅速,有呈网状排列的梭形细胞群(图4-A),有的则为一整片无规则的薄层细胞(图4-B)。有极少数小细胞团迁移出的细胞呈长条形放射状排列(图4-C)。有一些贴壁的细胞呈圆形有大、中、小3类,在光学显微镜下呈较亮与较暗两类(图4-D); 还有的贴壁的细胞呈三角形(图4-E)、梭形(图4-F)、蝌蚪形(图4-G)、多角形(图4-H)和长条形细胞(图4-F)。一些细胞体表面出现气泡(图4-I),边缘模糊,在培养后期逐渐消失。 15 d左右,细胞贴满细胞瓶壁,此时主要以梭形细胞为主。

图4 黄粉虫胚胎原代培养中的各种形态细胞Fig 4 Cellular morphology of the primary cells of the cultured Tenebrio molitor embryonic cell
A: 网状排列细胞; B: 薄层细胞; C: 长条放射状细胞; D: 圆形细胞; E: 三角形细胞; F: 梭形细胞; G:蝌蚪样细胞; H 多角型细胞; I: 细胞充满气泡。 标尺 Scale bars = 100 μm
3 讨论与结论
3.1 黄粉虫胚胎细胞的培养方法
本研究分别采用机械消化法和胰酶消化法以及3种不同的昆虫培养基对黄粉虫胚胎原代细胞进行培养,选择适合进行原代胚胎细胞培养的孵化卵粒,比对4种不同浓度的FBS,其中采用机械消化法消化3 d至7 d孵化虫卵的胚胎组织在Grace培养基中能够更好地生长。
原代培养分离细胞一般包括机械分散法和酶解离细胞法。借助筛网分离细胞,该法可减少由于机械引起的对细胞带来的损伤,属较温和的机械分散法[14]。但并不能避免由于机械作用而产生大量细胞碎片。胰酶消化法通过消化细胞间质,组织块在胰酶的消化作用下产生更多的游离细胞,但由于消化时间不易控制、组织块消化时间过长,或胰酶浓度过高,造成对细胞损害加深,反而不利于培养。本试验采用筛网对黄粉虫胚胎组织进行分离并取得了良好的效果,可能是因为在培养初期细胞需要适应体外新的环境,而组织块可以提供原代细胞生长的微环境,增强对外界的适应能力[15]。
3.2 培养基及胎牛血清浓度的选择
本试验分别选择Grace、IPL-41和Schneider′s 3种昆虫培养基对黄粉虫胚胎原代细胞进行培养,培养初期细胞均能在3种培养基中生长,随着培养时间加长,细胞对每种培养基的适应能力不同,培养效果出现差异。Grace培养基是目前应用最广的昆虫培养基,可用于多种昆虫细胞的培养[16-17];IPL-41培养基最初用于草地贪夜蛾细胞系的培养,经过改良也可用于其它昆虫细胞的培养[18];而Schneider′s培养基主要用来培养果蝇细胞系。通过培养,细胞在Grace培养基中生长状况最好,而在IPL-41培养基中生长的细胞在未长满瓶底时就已脱落,裂解,说明该培养基并不适合用来培养黄粉虫胚胎原代细胞,细胞在Schneider′s培养基生长良好但在第一次传代后出现脱落, 无法进行后续传代。
通过在Grace培养基中添加4种不同浓度灭活的胎牛血清,测定黄粉虫胚胎原代细胞在不同浓度下的细胞活力。结果表明,在Grace培养基20% FBS组黄粉虫胚胎原代细胞在培养7、14、21和28 d时细胞活力和15%组、10%组、5%组及无血清组相比,均差异极显著(P<0.01),15% 组与无血清组差异显著(P<0.05),10% 组与5% 组差异不显著(P>0.05),28 d时10% 组和5% 组与无血清组差异均显著(P<0.05)。由此可见,FBS浓度越大,细胞活力越强,在培养基中添加20% FBS细胞生长最好。
3.3 黄粉虫虫卵发育时间的选择
胚胎发育成一个完整的个体是通过细胞分裂增殖、细胞分化、细胞迁移等一系列在分子水平和细胞水平的有序调控及相互作用下形成的。细胞分化程度越低则分化潜能越大。胚胎发育早期细胞分化程度较低,所以细胞培养效果更好。但在本研究中,孵化早期的卵所接种的细胞却没有培养成功,在倒置显微镜下观察很难发现有细胞团或组织块,在长达2个月的培养过程中仅有极个别纤维样细胞贴壁,大部分在后期裂解。发育早期的胚胎还没有形成组织器官的分化,在消毒或研磨过程中受到损伤较大,可能无法用来进行原代培养[19]。虫卵孵化60 h后接种的细胞在原代培养过程中均能贴壁生长,直至传代。关于孵化 5~6 d卵接种的细胞没有传代成功,可能与虫卵卵粒品质以及黄粉虫成虫产卵状态有关,实验发现,采产卵初期与后期孵化的卵并不能够很好地进行原代培养。
本实验采用机械分散法接种孵化7 d黄粉虫虫卵胚胎组织细胞在含20% FBS的Grace培养基中能够快速增殖且生长状态较好,目前已传至第5代。
